-
내년 3월부터 생물학제제 신약 CTD 의무화내년 3월부터 생물의약품 신약의 허가신청서는 국제공통기술문서(CTD)로 제출해야 한다. 9일 식품의약품안정청은 이 같은 내용을 포함한 ‘생물학적제제 등 허가 및 심사에 관한 규정’을 개정 고시했다고 밝혔다. 이번 고시는 의약품 등 기준 및 시험방법 심사의뢰서 심사규정을 통합, 일원화했으며 국제공통기술문서 제도 도입, 규제 합리화 등이 주요 내용이다. 주요 개정내용으로는 내년 3월부터 신약의 제조판매 품목허가신청서는 국제공통기술문서로 제출해야 한다. 의료기관 밖에서 세포를 조작하고자 하는 자는 내년 6월 8일까지 의약품 제조업 및 제조품목허가를 받아야 한다. 희귀의약품의 안전성·유효성 자료 중 품질에 관한 자료의 제출 범위가 구체화됐으며 신종 전염병에 대비한 신속한 허가 근거도 마련됐다. 이밖에 반추동물유래성분 사용 및 처리방법 상세기재 요령도 명시했다. 이와 함께 식약청은 내년 2월 병원내에서 세포를 최소한으로 조작할 수 있는 범위에 대한 상세한 가이드라인을 제시할 예정이다.2008-12-09 15:52:50천승현
-
 생동재평가 미제출 78품목 행정처분 위기심바스타틴제제 31품목, 펠로디핀제제 14품목을 비롯해 78품목이 올해 생동재평가 자료를 제출하지 않은 것으로 집계됐다. 이에 따라 이들 제품 중 대부분은 판매업무 정지 2개월의 행정처분에 처할 전망이다. 8일 식품의약품안전청이 국회에 제출한 2008년 생동성 재평가 대상품목 및 결과보고서 제출 품목(11월 13일 현재)에 따르면 총 421품목 가운데 81.5%인 343품목이 결과보고서를 제출한 것으로 나타났다. 나머지 78품목의 경우 생동시험 결과가 나오지 않았거나 생동시험 일정이 지연되는 바람에 결과보고서를 제출 못해 행정처분 위기에 처한 것. 생동재평가의 경우 최초 결과보고서를 제출하지 못할 경우 판매업무정지 2개월 처분이 내려지며 이후에는 6개월 판매정지, 허가취소로 이어진다. 품목별로는 심바스타틴제제가 전체 대상 71품목 가운데 가장 많은 31품목이 결과보고서를 제출 못했다. 심바스타틴은 대표적인 난용성 약물 중 하나로 생동결과가 쉽게 나오지 않는데도 불구하고 100여개 제품이 생동시험을 통과해 지난 2006년 생동조작 파문 당시 가장 많은 의심을 받기도 했다. 또한 재평가 과정에서 기대만큼의 결과가 나오지 않아 제약업체들의 애를 태웠으며 우려했던대로 상당수 품목이 자료를 제출하지 못해 이들 품목은 신뢰성에 타격을 입게 됐다. 펠로디핀제제는 35품목 중 14품이 자료 제출에 실패했으며 에르도스테인은 재평가 대상 35품목 중 23품목만 자료를 제출한 것으로 집계됐다. 멜록시캄은 44품목 중 6품목이 자료를 제출하지 못했으며 레바미피드, 염산티로프라미드는 각각 4품목으로 뒤를 이었다. 이에 반해 가바펜틴은 재평가 대상 20품목 모두 자료를 제출, 대조를 보였다. 업체별로는 신풍제약이 가장 많은 5품목의 생동결과보고서를 제출하지 않았으며 대한뉴팜과 보령제약이 각각 4품목, 3품목으로 뒤를 이었다. 이와 관련 식약청은 11월말까지의 재평가 결과를 제출한 품목을 집계한 이후 미제출 품목에 대해 행정처분을 내릴 방침이다. 식약청 관계자는 "당초 올해 생동재평가 결과 제출 마감일은 9월말이었지만 2개월간의 유예기간을 부여했으며 11월말까지 결과를 제출하지 않은 품목에 대해서는 조만간 판매정지 2개월 처분을 내릴 예정이다"고 말했다.2008-12-09 12:33:18천승현
생동재평가 미제출 78품목 행정처분 위기심바스타틴제제 31품목, 펠로디핀제제 14품목을 비롯해 78품목이 올해 생동재평가 자료를 제출하지 않은 것으로 집계됐다. 이에 따라 이들 제품 중 대부분은 판매업무 정지 2개월의 행정처분에 처할 전망이다. 8일 식품의약품안전청이 국회에 제출한 2008년 생동성 재평가 대상품목 및 결과보고서 제출 품목(11월 13일 현재)에 따르면 총 421품목 가운데 81.5%인 343품목이 결과보고서를 제출한 것으로 나타났다. 나머지 78품목의 경우 생동시험 결과가 나오지 않았거나 생동시험 일정이 지연되는 바람에 결과보고서를 제출 못해 행정처분 위기에 처한 것. 생동재평가의 경우 최초 결과보고서를 제출하지 못할 경우 판매업무정지 2개월 처분이 내려지며 이후에는 6개월 판매정지, 허가취소로 이어진다. 품목별로는 심바스타틴제제가 전체 대상 71품목 가운데 가장 많은 31품목이 결과보고서를 제출 못했다. 심바스타틴은 대표적인 난용성 약물 중 하나로 생동결과가 쉽게 나오지 않는데도 불구하고 100여개 제품이 생동시험을 통과해 지난 2006년 생동조작 파문 당시 가장 많은 의심을 받기도 했다. 또한 재평가 과정에서 기대만큼의 결과가 나오지 않아 제약업체들의 애를 태웠으며 우려했던대로 상당수 품목이 자료를 제출하지 못해 이들 품목은 신뢰성에 타격을 입게 됐다. 펠로디핀제제는 35품목 중 14품이 자료 제출에 실패했으며 에르도스테인은 재평가 대상 35품목 중 23품목만 자료를 제출한 것으로 집계됐다. 멜록시캄은 44품목 중 6품목이 자료를 제출하지 못했으며 레바미피드, 염산티로프라미드는 각각 4품목으로 뒤를 이었다. 이에 반해 가바펜틴은 재평가 대상 20품목 모두 자료를 제출, 대조를 보였다. 업체별로는 신풍제약이 가장 많은 5품목의 생동결과보고서를 제출하지 않았으며 대한뉴팜과 보령제약이 각각 4품목, 3품목으로 뒤를 이었다. 이와 관련 식약청은 11월말까지의 재평가 결과를 제출한 품목을 집계한 이후 미제출 품목에 대해 행정처분을 내릴 방침이다. 식약청 관계자는 "당초 올해 생동재평가 결과 제출 마감일은 9월말이었지만 2개월간의 유예기간을 부여했으며 11월말까지 결과를 제출하지 않은 품목에 대해서는 조만간 판매정지 2개월 처분을 내릴 예정이다"고 말했다.2008-12-09 12:33:18천승현 -
'크레스토', 철수압박서 초대형 품목 성장'크레스토', 발매 5년만에 청구순위 9위 랭크 아스트라제네카의 고지혈증약 ‘크레스토’가 국내 발매 5년차를 맞았다. 2004년 7월에 발매됐으니, 정확히는 4년 5개월째다. 매년 30% 이상 급성장해 올해 매출이 450억원대에 달할 것으로 전망된다. 처방약 순위도 급등해 상반기 EDI 청구기준 9위에 랭크됐다. ‘ 크레스토’는 발매초기만해도 아픔과 인고의 시간을 보내야 했다. 개발당시 아스트라제네카의 ‘유망신약’에서 부작용 논란으로 ‘미운오리새끼’가 됐다가, 다시 ‘백조’로 환골탈피하는 기세다. ‘크레스토’는 시판 초반 미국의 시민단체의 강력한 저항에 직면했다. 유명한 ‘퍼블릭시티즌’이 그들이다. ‘퍼블릭시티즌’은 지난 2004년 ‘크레스토’가 생명에 위협을 가할 수 있는 근육악회, 신부전과 신장 손상 등을 야기할 수 있다면서 미국내 시판금지를 FDA에 공식 요청했었다. 같은 해 영국에서는 4건의 ‘횡문근 용해증’ 부작용이 보고돼 논란을 부추겼다. 이후 ‘퍼블릭시티즌’의 “크레스토가 신장손상을 일으킬 수 있는 근육섬유 분해질환인 횡문근용해증 발생률 증가와 관련이 있다”는 내용의 기고문이 유명학술지인 ‘란셋’에 실려 논란에 기름을 부었다. 아스트라제네카는 ‘란셋’ 기고내용에 즉각 반발하고 뉴욕타임즈 등 유력신문에 방어광고를 게재하는 등 맞대응에 나섰지만 논란은 오히려 증폭됐다. 미 증권사도 ‘크레스토’ 매출이 35% 이상 감소할 것이라면서 성공 가능성에 부정적인 전망을 내놓기도 했다. 한때 부작용 논란으로 시장철수 요구 등 홍역 치러 이 논란은 다음해 3월에는 FDA가 “효과가 위험을 앞선다”고 발표한 뒤 진정되는 듯 했으나, 다시 ‘퍼블릭시티즌’이 다른 스타틴에 비해 중증 근육 부장용 위험이 6배 이상 높다는 주장을 발표해 논란은 2라운드로 치닫았다. 이런 주장은 미국심장학회 학술지 ‘서큘레이션’에도 게재됐지만, 심장협회가 “약물 사용을 중단해서는 안된다”는 의견을 내 사실상 시장철수에 반대입장을 피력하면서 일단락됐다. 비슷한 시기에 시판허가를 받았던 한국에서도 일부 논란이 재현되기도 했지만, 미국만큼 크게 이슈화되지는 않았다. 그리고 발매 2년차인 2005년 ‘크레스토’는 연매출 100억원을 돌파하면서 블록버스터로서의 자신감을 회복했다. 이는 ‘크레스토’의 기획시리즈 임상인 ‘갤럭시’에 힘입은 바 크다. 특히 ‘갤럭시’ 시리즈 일환으로 지난달 발표된 ‘ 주피터’ 임상은 심혈관계 질환 예방약으로서 ‘크레스토’의 가치를 한껏 제고시켰다. LDL-C 강하효과면에서는 타의 추종을 불허할 만큼 효과가 뛰어나다는 근거들을 이미 확보돼 있었다. '주피터' 임상, 스타틴 시범평가서 반전 드라마 연출 이 임상은 특히 한국에서 새로운 반전의 기회를 가져다 줬다. 기등재의약품 목록정비 시범사업에서 당초 1차 평가지표인 생존율 데이터를 제출하지 못해 30% 이상 약가인하 대상으로 분류됐던 것이 막판에 뒤바뀐 것이다. 심평원 약제급여평가위원회는 아직 ‘크레스토’ 경제성평가 결과를 어떻게 적용할 지 결론을 내리지 못하고 있다. 하지만 ‘크레스토’는 다른 스타틴과는 달리 약가가 인하되지 않거나 인하폭이 아주 적은 수준에 그칠 가능성이 커 보인다. 최종결과는 오는 19일 열리는 약제급여평가위원회에서 확정될 예정이다. 한편 이날 심포지움에서도 ‘주피터’ 임상은 가장 중요한 화제다. 사실상 이 스터디를 알리기 위해 의사 400여명을 초청한 대규모 행사를 마련했다고 볼 수 있다. ‘주피터’ 임상은 맥길의대 자크 제네스트 교수가 발표할 예정이다. 또 국내 환자들이 참여한 ‘로메오’, ‘크레스트’ 임상 등도 소개된다. 아스트라제네카 관계자는 “주피터 임상은 회사내부 뿐 아니라 학계를 흥분시킨 결과였다”면서 “아스트라제네카의 간판품목으로 성장하는 데 손색을 없을 것”이라고 자신감을 나타냈다. ‘크레스토’는 IMS데이터 기준으로 지난 2005년 125억원 매출로 블록버스터 대열에 합류한 이후, 2006년 279억원, 2007년 373억원, 올해 3분기 누계 322억원으로 매년 30% 이상 급성장 중이다. 올해 1분기부터는 분기매출이 100억원을 넘어서는 기염을 토했다.2008-12-09 12:27:00최은택
-
녹십자, BCG백신 생산으로 결핵 완전 퇴치녹십자(대표 허재회)는 정부가 추진하고 있는 ‘결핵퇴치 2030 계획’에 따라 정부가 87억원의 예산을 지원하는 ‘국가 BCG 백신생산시설 구축 및 생산’에 대한 위탁사업자로 선정되었다고 9일 밝혔다. 결핵은 에이즈에 이어 말라리아와 함께 세계 3대 질병으로 전세계 1/3인 20억명이 결핵균에 감염되어 있으며, 전세계적으로 연간 881만명이 신규 발생하고 매년 160만명이 사망하는 무서운 질병. 국내 역시 사정은 다르지 않아 인구의 30%가 결핵균에 감염되어 있으며 활동성 결핵환자는 13만2000명으로 국민 341명당 1명이 결핵환자다. 이로 인해 정부는 ‘결핵퇴치 2030 계획’을 수립하고 연간 결핵 감소율을 15% 수준으로 높여 2030년 까지 국내 결핵을 완전 퇴치한다는 계획이다. 국내 BCG백신 접종은 1952년 최초 접종이 도입된 이후 현재 접종률은 85%에 이르고 있으나 전량 완제품 형태로 수입되고 있다. 이에 따라, 녹십자는 전량 수입에 의존하고 있는 BCG백신을 전남 화순 녹십자 백신공장의 기존 인프라를 최대한 활용하여 투자비용과 시간을 최소화해 2009년 생산시설 구축을 완료하고 2012년 임상 및 허가 완료, 2013년 자체 생산, 판매 할 계획이다. 녹십자 개발본부 이병건 부사장은, “궁극적으로 국내 결핵의 완전퇴치가 목표인 정부의 의지에 공감하여 적극적으로 사업자 선정에 참여한 것”이라며, “UNICEF 등을 통해 북한 및 저개발국가에 결핵백신을 공급함으로써 세계보건 증진에 기여한다는 최고경영진의 강한 의지가 반영됐다”고 밝혔다.2008-12-09 10:32:22가인호
-
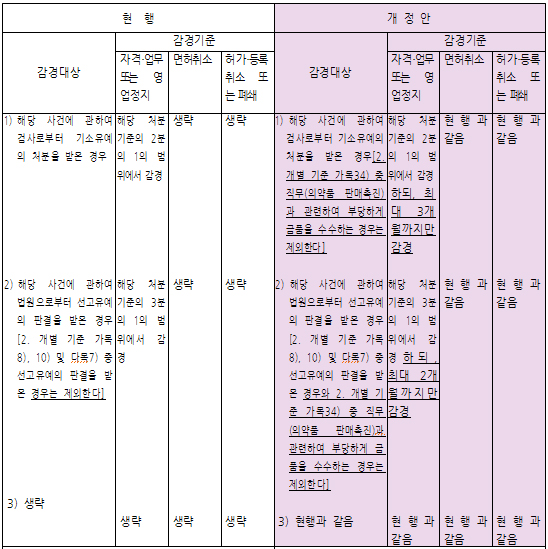 리베이트 받은 의사 행정처분 대폭 강화리베이트를 수수한 의사에 대한 행정처분 기준이 대폭 강화된다. 보건복지가족부는 8일 '의료관계 행정처분 규칙 일부 개정안'을 입법예고 하고 오는 28일까지 의견접수를 받는다고 밝혔다. 개정안을 보면 의사가 의약품 판매촉진과 관련해 금품을 수수하는 행위는 행정처분 감경기준에서 제외된다. 현재는 리베이트를 받은 의사가 기소유예 처분을 받았다면 해당 처분기준의 1/2 범위에서 최대 3개월까지 감경을 받았다. 그러나 의약품 판매촉진과 관련 부당하게 금품을 수수했을 경우는 이같은 감경 기준이 적용되지 않게 된다. 또한 선택진료 준수사항 신설에 따라 이를 위반한 경우 '시정명령'을 할 수 있도록 했다. 준수사항은 의사 등의 지정비율 80% 초과, 자격이 없는 의사를 지정한 경우 등이다. 아울러 업무정지 기간 중 의료업을 했을 경우 허가취소 또는 폐쇄 조치가 내려지는 규정도 신설됐다. 복지부는 행정처분 감경기한의 상한을 설정하고 의약품 판매촉진과 관련해 금품 수수시 감경기준 적용을 배제하는 등 현행 제도의 운영상 나타난 문제점을 개선하기 위해 개정안을 마련했다고 말했다.2008-12-08 11:18:44강신국
리베이트 받은 의사 행정처분 대폭 강화리베이트를 수수한 의사에 대한 행정처분 기준이 대폭 강화된다. 보건복지가족부는 8일 '의료관계 행정처분 규칙 일부 개정안'을 입법예고 하고 오는 28일까지 의견접수를 받는다고 밝혔다. 개정안을 보면 의사가 의약품 판매촉진과 관련해 금품을 수수하는 행위는 행정처분 감경기준에서 제외된다. 현재는 리베이트를 받은 의사가 기소유예 처분을 받았다면 해당 처분기준의 1/2 범위에서 최대 3개월까지 감경을 받았다. 그러나 의약품 판매촉진과 관련 부당하게 금품을 수수했을 경우는 이같은 감경 기준이 적용되지 않게 된다. 또한 선택진료 준수사항 신설에 따라 이를 위반한 경우 '시정명령'을 할 수 있도록 했다. 준수사항은 의사 등의 지정비율 80% 초과, 자격이 없는 의사를 지정한 경우 등이다. 아울러 업무정지 기간 중 의료업을 했을 경우 허가취소 또는 폐쇄 조치가 내려지는 규정도 신설됐다. 복지부는 행정처분 감경기한의 상한을 설정하고 의약품 판매촉진과 관련해 금품 수수시 감경기준 적용을 배제하는 등 현행 제도의 운영상 나타난 문제점을 개선하기 위해 개정안을 마련했다고 말했다.2008-12-08 11:18:44강신국 -
전동휠체어·의료용스쿠터 등 안전기준 강화식품의약품안전청은 전동휠체어 및 의료용스쿠터 등 3개 품목의 의료기기에 대한 안전성 및 성능을 강화하는 전자의료기기 기준규격을 개정고시했다고 8일 밝혔다. 우천시나 야간에 발생할 수 있는 안전사고를 예방하기 위해 전동휠체어 및 의료용스쿠터 허가시 조명등과 반사경 장착을 의무화하고 이에 대한 형태, 색상, 반사각도, 주행 등의 밝기 등에 대한 기준규격을 마련한 것. 이와 함께 근력이 약하거나 교통사고 등으로 인해 사지마비 증세를 가진 환자들의 재활치료에 사용되고 있는 정형용 운동장치인 고정식 상하지 운동치료기와 보행훈련기기에 대한 기준규격도 새롭게 마련됐다. 식약청은 “이번 기준규격 마련으로 전동휠체어 및 의료용스쿠터 사용자들의 안전사고를 예방할 수 있을 뿐만 아니라 사지마비 재활치료를 원하는 환자들에게 안전하고 우수한 품질의 의료기기가 제공될 것으로 기대된다”고 말했다.2008-12-08 11:16:28천승현
-
독성과학원, 간대사효소 일배체형 분석 특허국립독성과학원 임상약리과는 CYP2C9 유전자의 일배체형을 분석하는 기술로 특허를 출원했다고 8일 밝혔다. 약물의 체내 동태에 관여하는 주요 효소인 CYP2C9에서 알려진 단일염기다형성 등 일부 유전자 변이는 효소 활성에 영향을 미쳐 약물의 효능과 독성을 나타내는 데 중요한 영향을 미친다. 일배체형은 하나의 집단 내에서 발견된 여러 부위의 단일염기다형성을 통계학적인 개연성에 근거, 조합한 것으로 각각의 단일염기다형성보다 더 정확하고 신뢰할 수 있는 기능성 유전정보를 제공한다. 이에 독성연구원은 지난해 안전성관리기반연구 사업 중 ‘한국인 민족적 감수성관련 약물유전형연구’ 과제로 한국인에서 CYP2C9 유전자의 단일염기다형성 및 일배체형을 분석하고 그 빈도를 타인종과 비교했으며 그 연구결과를 특허출원한 것. 독성연구원은 “이번 특허출원을 통해 CYP2C9에 의해 대사되는 의약품의 가교시험 및 평가에 활용할 수 있게 됐으며 출원된 기술은 한국인의 약물유전형 특성을 반영한 의약품 평가 방법의 확립에도 기여할 것으로 기대한다”고 말했다.2008-12-08 09:54:02천승현
-
녹십자, '페라미비르 주' 임상 3상 IND 승인녹십자(대표 허재회)는 아시아 다국가 임상시험으로 실시되는 인플루엔자 감염증 치료제 ‘페라미비르 주(Peramivir)’의 한국 내 3상 임상시험에 대한 IND 승인을 식품의약품안전청으로부터 받았다고 8일 밝혔다. ‘페라미비르 주’에 대한 이번 다국가 임상시험은 한국, 일본, 대만, 홍콩에서 총 1,050명의 인플루엔자 감염증 환자를 대상으로 ‘페라미비르 주’ 1회 정맥투여 시의 유효성 및 안전성을 ‘타미플루’ 5일간 경구투여 시와 비교평가하게 되며 녹십자는 일본 시오노기(Shionogi)社와 공동으로 임상시험을 진행할 예정이다. 미국 바이오크리스트(BioCryst)사가 개발한 ‘페라미비르 주’는 인플루엔자 바이러스의 인체감염을 일으키는데 가장 중요한 특정효소를 억제해 조류인플루엔자를 비롯한 각종 인플루엔자에 대한 강력한 항바이러스 효과를 발휘한다. 또한 기존 AI치료제에 내성을 가진 바이러스에도 효과가 탁월한 신약으로 조류인플루엔자 바이러스를 포함한 다양한 인플루엔자 바이러스에도 강력한 항바이러스 효과를 갖는다. 녹십자는 지난 2006년 바이오크리스트사와 ‘페라비미르 주’에 대한 한국에서의 라이센스 계약을 체결했으며 이번 달부터 내년 6월까지 임상 3상을 실시할 계획으로 2010년 최종허가를 목표로 하고 있다. 녹십자 관계자는 “내년 하반기부터 순수 자체 기술로 개발한 국내 최초의 독감백신 ‘GC501’을 발매할 예정이다. 2010년 AI백신의 최종품목허가를 계획하고 있어 ‘페라미비르 주’의 개발이 완료되면 녹십자는 각종 인플루엔자의 예방 및 치료에 이르기까지 모든 의약품을 갖추게 될 것”이라며 “녹십자는 우리나라의 완벽한 인플루엔자 방어체계 구축을 목표로 하고 있다”고 말했다.2008-12-08 08:39:20가인호
-
이달 오리지널 약가 원상회복 기준 나온다제네릭 발매로 보험상한가가 20% 자동 인하된 오리지널 의약품의 약가 원상회복 기준이 조만간 마련된다. 복지부 관계자는 7일 데일리팜과의 전화통화에서 “이르면 이달 말, 늦어도 내달 초에는 기준을 확정해 세부지침을 공고할 계획”이라고 말했다. 약가 원상회복에 대한 언급은 지난해 8월 ‘약제 상한금액의 산정기준 제1호 가목의 (1) 후단규정 시행에 관한 세부지침’으로 이미 발표됐었다. 하지만 이 지침에는 ‘등재된 제네릭의 특허침해를 입증하면 약가를 회복’한다고 규정돼 있을 뿐, 복지부가 명확한 기준을 정하지 못해 1년 4개월여를 끌어왔었다. 또 올해 4월 입법 예고된 ‘신의료기술 등의 결정 및 조정기준’ 개정안에도 이 부분은 별도 언급되지 않았다. 이와 관련 복지부 관계자는 ‘신의료기술 결정·조정기준’ 개정안 고시와 함께 원상회복 근거기준도 함께 공표될 예정이라고 설명했다. 이를 위해 최근 제약업계 관계자들와 전문가들에게 의견을 듣는 등 막바지 조율작업을 진행하느라 분주하다. 관련 업계 관계자들에 따르면 그러나 복지부는 특허심판원의 권리범위확인 심판 심결결과를 회복기준에 포함시킬 지를 놓고 결단을 내리지 못하고 있다. 다국적 제약사 측은 “특허침해 예방청구권 측면에서 적극적 권리범위 확인심판도 확인의 이익이 있다”면서 “적극적 권리범위 확인심판에서 제네릭이 권리범위에 속한다는 심결이 나오면 약가를 원상회복해 줘야 한다”고 주장한다. 특히 이 주장을 염두 해 현재 특허가 잔존한 자사 오리지널 의약품을 목표로 국내사들이 제네릭 개발에 착수하는 족족 적극적 권리범위 확인 심판을 청구하고 있다. 제네릭의 경우 심결에서 당연히 ‘권리범위에 속한다’는 결과를 얻기 십상. 따라서 다국적 제약사 측 주장이 수용될 경우 특허가 잔존한 대부분의 오리지널 품목이 제네릭 여파로 약가가 20% 자동 인하되는 것을 피해갈 수 있을 것으로 전망된다. 국내 제약사들은 다른 측면에서 다국적사들과 이해관계를 같이 한다. 제네릭을 발매한 뒤 특허분쟁에서 패소하더라도 20% 약가인하에 따른 오리지널사의 피해액(기대수익)을 변상하지 않아도 되기 때문이다. 제약업계 한 관계자는 “실상 국내 제약사들은 원상회복 근거기준에 관심이 없다”면서 “하지만 적극적 권리범위확인심판이 대상에 포함돼 약가회복이 쉬어지면 그만큼 패소에 따른 배상책임 부담은 줄어들 것”이라고 말했다. 복지부 관계자는 이에 대해 “제약업계와 변리사 등 관련 전문가들에게 다각도로 의견을 청취하고 있다”면서 “약가정책 방향과 특허권 보호가 충돌하지 않고 이익을 얻을 수 있도록 최선의 방안을 찾기 위해 노력 중”이라고 말했다.2008-12-08 06:29:47최은택
-
"일단 등재시키고 보자"…스피드 전략 대세“보험약, 일단 등재시키고 보자.” 한 벤처제약기업 사장이 국내 제약사들의 의약품 개발전략이 최근부터 ‘스피트’ 전략으로 바뀌었다는 흥미 있는 분석을 내놔 눈길을 끌었다. 네비팜 이창규 사장은 특허청 '의약발명연구회' 세미나 주제발표를 통해 국내 제약사들의 의약품 개발전략 변화를 3단계로 구분해, 이 같이 제시했다. 이 사장은 보령제약과 현대약품에서 특허업무를 전담했으며, 제약사내 특허담당자 모임을 이끌면서 그동안 특허청, 특허심판원과 제약계의 가교역할을 도맡아 왔다. 5일 발표내용에 따르면 2004년까지인 1단계 의약품 개발전략은 주로 1987년 이전에 출원된 제법특허를 대상으로 제품 발매전에 '소극적 권리범위확인심판'이나 '무효심판'을 제기해 민사상의 가처분이 청구되는 것을 예방했었다. 대웅·보령제약의 ‘플루코나졸’ 사건, 한미약품의 ‘클래리트로마인신’ 사건, 보령의 ‘온단세트론’, ‘심바스타틴’ 사건 등을 대표적인 사례로 들었다. 이어 2004년부터 현재까지 2단계에 진입한 개발전략은 개량신약의 시대로 정의했다. 이 사장은 2단계 전략은 제품관련 특정염이나 결정형, 수화물 등만을 보호범위로 하고 있는 블록버스터 의약품을 주요대상으로 보호특허를 회피하거나 임상을 통한 개량신약 개발이 주요 이슈였다고 소개했다. 이 시기는 특히 암로디핀 캄실레이트, 시브트라민 메실레이트. 에스-오메프라졸 스트론튬염 등을 개발한 한미약품의 약진이 두드러졌던 때다. 종근당의 클로피도그렐 레지네이트도 같은 선상에 위치한다. 그는 이어 3단계 개발전략의 변화시점을 올해 7월부터 기산했다. 특허침해를 우려해 제품발매를 하지 못했던 보험약을 미생산·미청구 약가인하 대상에서 제외시킨 사건이 이를 추동시켰다는 것이다. 제약사들은 이 단계에서는 높은 약가선점을 위해 '일단 등재해 놓고 보자'는 식의 ‘스피드 전략’으로 전략을 바꿨다고 분석했다. 대상도 PMS 만료순/시장크기 순에 따라 오리지널 대부분이 타깃이 될 정도로 확대됐다.2008-12-08 06:26:53최은택
오늘의 TOP 10
- 1부산 창고형약국, 서울 진출?...700평 규모 개설 준비
- 25년 엔트레스토 분쟁 종지부...제네릭 승소 이끈 3대 쟁점
- 3'이모튼', 약국당 180T 균등 공급...19일부터 신청
- 4차바이오, 카카오·LG와 동맹...'3세 경영' 협업 전략 가동
- 5R&D·공정 다시 짠다…제약사별로 갈린 AI 활용 지도
- 6약국 개설·운영에 스며드는 외부 자본…규제장치 마련될까
- 7SK케미칼, 트루셋 저용량 쌍둥이약 허가…2031년까지 독점
- 8한국파마, CNS 외형 반등…디지털헬스로 확장 모색
- 9미국, 의약품 품목관세 조치 임박…관세율·범위 촉각
- 10담배소송 항소심도 공단 패소..."3심 상고 적극 검토"








































