총 104건
-
 '엘라히어' 국내 등장…애브비, ADC 개발 잇단 성과ADC 신약 '엘라히어'[데일리팜=손형민 기자] 애브비가 항체약물접합체(ADC) 신약 상용화에 연이어 성공하며 항암 포트폴리오를 빠르게 확장하고 있다.이 회사는 난소암에서는 첫 ADC 치료제 허가를 확보했고 비소세포폐암(NSCLC)에서는 c-Met 타깃 ADC를 허가받으며 미충족 수요 공략에 나섰다.20일 관련 업계에 따르면 애브비는 19일 백금저항성 난소암 ADC 신약 '엘라히어(미르베툭시맙 소라브탄신)'의 국내 허가를 획득했다. 구체적인 적응증은 이전에 한 가지에서 세 가지의 전신 요법을 받은 적이 있고, 엽산 수용체 알파(FRα) 양성이면서 백금기반 화학요법에 저항성이 있는 고등급 장액성 상피성 난소암, 난관암 또는 원발성 복막암 성인 환자 치료다. 엘라히어는 FRα를 발현하는 난소암을 겨냥한 ADC로, 강력한 세포독성 약물 DM4를 암세포 내로 전달해 종양을 사멸시키는 기전이다. 특히 백금계 항암제에 내성을 보이는 난소암 환자군에서 새로운 옵션으로 주목받고 있다. 이 치료제는 백금저항성난소암 치료에 약 10년만에 등장한 새로운 기전의 신약으로 올해 1월 국내에서 희귀의약품에 지정되기도 했다.엘라히어는 엽산 수용체 알파 결합 항체, 가용성 링크, 그리고 표적 암세포를 죽이도록 설계된 강력한 미세소관 억제제인 메이탄시노이드 계열의 DM4를 포함하는 최초로 개발된 ADC다.난소암의 90%를 차지하는 상피성 난소암에서는 파클리탁셀 등 탁산 계열 약물과 카보플라틴, 시스플라틴 등 백금계열 항암제가 주로 사용된다. 다만 백금계 약물에 저항성이 있는 재발성 난소암의 경우 기존의 표준요법인 항암화학요법에 대한 반응률이 전반적으로 낮게 나타나 생존율 개선에 많은 제한이 있었다. 엘라히어는 백금 저항성 난소암 환자들을 대상으로 진행한 임상3상 MIRASOL 연구를 통해 새로운 대안이 될 수 있음을 증명했다.MIRASOL 연구에서 엘라히어는 기존 비백금 항암화학요법 대비 질병 진행 또는 사망 위험을 35% 감소시켰다.무진행생존기간(PFS) 중앙값은 5.62개월로 대조군 3.98개월 대비 개선됐고, 객관적반응률(ORR)은 최대 42.3%로 표준치료요법군 15.9%보다 유의하게 높았다.전체생존기간(OS) 역시 16.85개월로, 대조군 13.34개월 대비 사망 위험을 32% 낮췄다.안전성 측면에서는 안구 관련 이상반응, 피로, 복통 등이 보고됐으나 전반적으로 관리 가능한 수준으로 평가됐다.이 같은 임상 성과를 바탕으로 엘라히어는 지난해 3월 미국, 같은 해 11월 유럽에서 허가를 받았다.미국 NCCN 가이드라인은 FRα 양성 백금저항성 난소암 환자 치료에서 엘라히어를 선호요법(preferred regimen)이자 카테고리 1로 권고하고 있으며, 대한부인종양학회 역시 최고 근거 수준(Level I), 권고 등급 A로 엘라히어 사용을 권고하고 있다비소세포폐암서도 c-Met 타깃 ‘엠렐리스’ 상용화ADC 신약 '엠렐리스'애브비는 난소암에 이어 비소세포폐암에서도 ADC 상용화에 성공했다.지난 5월 미국 식품의약국(FDA)은 c-Met 타깃 ADC '엠렐리스(텔리소투주맙 베도틴)'를 이전 치료를 받은 국소 진행성 또는 전이성 비편평 비소세포폐암 성인 환자 중 c-Met 단백 과발현 환자를 대상으로 가속 승인했다.c-Met은 상피간엽이행(Met) 유전자에 의해 발현된 단백질이다. c-Met은 세포에 신호를 전달하는 단백질 중 하나로 대표적인 암 유발 유전자로 꼽히며 비소세포폐암뿐만 아니라 대장암, 위암, 간암 등 각종 고형암 발생과 연관이 있다. 비소세포폐암 환자 중 6%에서 c-Met 변이가 나타나는 것으로 알려져 있다.현재 c-Met 변이를 타깃하는 ADC 중 상용화 된 제품은 애브비의 엠렐리스가 유일하다. 엠렐리스는 주요 평가지표인 ORR과 반응지속기간(DOR) 개선을 근거로 이뤄졌으며, 확증 임상에서 임상적 유용성이 확인될 경우 정식 승인으로 전환될 예정이다. 임상2상 LUMINOSITY 연구에서 c-Met 과발현 환자 84명을 대상으로 한 분석 결과, 엠렐리스 투여군의 ORR은 35%, DOR 중앙값은 7.2개월로 나타났다.주요 이상반응은 말초신경병증, 피로, 식욕 감소, 말초부종 등이었으며, 3~4등급 이상반응으로는 림프구 감소, 간효소 상승, 전해질 이상 등이 보고됐다.엠렐리스는 2021년 해당 임상 데이터를 근거로 FDA로부터 혁신치료제(Breakthrough Therapy Designation)로도 지정된 바 있다.현재 엠렐리스는 3상 확증 임상 TeliMET NSCLC-01 연구에서 단독요법으로 추가 평가가 진행 중이다.2025-12-20 06:00:54손형민 기자
'엘라히어' 국내 등장…애브비, ADC 개발 잇단 성과ADC 신약 '엘라히어'[데일리팜=손형민 기자] 애브비가 항체약물접합체(ADC) 신약 상용화에 연이어 성공하며 항암 포트폴리오를 빠르게 확장하고 있다.이 회사는 난소암에서는 첫 ADC 치료제 허가를 확보했고 비소세포폐암(NSCLC)에서는 c-Met 타깃 ADC를 허가받으며 미충족 수요 공략에 나섰다.20일 관련 업계에 따르면 애브비는 19일 백금저항성 난소암 ADC 신약 '엘라히어(미르베툭시맙 소라브탄신)'의 국내 허가를 획득했다. 구체적인 적응증은 이전에 한 가지에서 세 가지의 전신 요법을 받은 적이 있고, 엽산 수용체 알파(FRα) 양성이면서 백금기반 화학요법에 저항성이 있는 고등급 장액성 상피성 난소암, 난관암 또는 원발성 복막암 성인 환자 치료다. 엘라히어는 FRα를 발현하는 난소암을 겨냥한 ADC로, 강력한 세포독성 약물 DM4를 암세포 내로 전달해 종양을 사멸시키는 기전이다. 특히 백금계 항암제에 내성을 보이는 난소암 환자군에서 새로운 옵션으로 주목받고 있다. 이 치료제는 백금저항성난소암 치료에 약 10년만에 등장한 새로운 기전의 신약으로 올해 1월 국내에서 희귀의약품에 지정되기도 했다.엘라히어는 엽산 수용체 알파 결합 항체, 가용성 링크, 그리고 표적 암세포를 죽이도록 설계된 강력한 미세소관 억제제인 메이탄시노이드 계열의 DM4를 포함하는 최초로 개발된 ADC다.난소암의 90%를 차지하는 상피성 난소암에서는 파클리탁셀 등 탁산 계열 약물과 카보플라틴, 시스플라틴 등 백금계열 항암제가 주로 사용된다. 다만 백금계 약물에 저항성이 있는 재발성 난소암의 경우 기존의 표준요법인 항암화학요법에 대한 반응률이 전반적으로 낮게 나타나 생존율 개선에 많은 제한이 있었다. 엘라히어는 백금 저항성 난소암 환자들을 대상으로 진행한 임상3상 MIRASOL 연구를 통해 새로운 대안이 될 수 있음을 증명했다.MIRASOL 연구에서 엘라히어는 기존 비백금 항암화학요법 대비 질병 진행 또는 사망 위험을 35% 감소시켰다.무진행생존기간(PFS) 중앙값은 5.62개월로 대조군 3.98개월 대비 개선됐고, 객관적반응률(ORR)은 최대 42.3%로 표준치료요법군 15.9%보다 유의하게 높았다.전체생존기간(OS) 역시 16.85개월로, 대조군 13.34개월 대비 사망 위험을 32% 낮췄다.안전성 측면에서는 안구 관련 이상반응, 피로, 복통 등이 보고됐으나 전반적으로 관리 가능한 수준으로 평가됐다.이 같은 임상 성과를 바탕으로 엘라히어는 지난해 3월 미국, 같은 해 11월 유럽에서 허가를 받았다.미국 NCCN 가이드라인은 FRα 양성 백금저항성 난소암 환자 치료에서 엘라히어를 선호요법(preferred regimen)이자 카테고리 1로 권고하고 있으며, 대한부인종양학회 역시 최고 근거 수준(Level I), 권고 등급 A로 엘라히어 사용을 권고하고 있다비소세포폐암서도 c-Met 타깃 ‘엠렐리스’ 상용화ADC 신약 '엠렐리스'애브비는 난소암에 이어 비소세포폐암에서도 ADC 상용화에 성공했다.지난 5월 미국 식품의약국(FDA)은 c-Met 타깃 ADC '엠렐리스(텔리소투주맙 베도틴)'를 이전 치료를 받은 국소 진행성 또는 전이성 비편평 비소세포폐암 성인 환자 중 c-Met 단백 과발현 환자를 대상으로 가속 승인했다.c-Met은 상피간엽이행(Met) 유전자에 의해 발현된 단백질이다. c-Met은 세포에 신호를 전달하는 단백질 중 하나로 대표적인 암 유발 유전자로 꼽히며 비소세포폐암뿐만 아니라 대장암, 위암, 간암 등 각종 고형암 발생과 연관이 있다. 비소세포폐암 환자 중 6%에서 c-Met 변이가 나타나는 것으로 알려져 있다.현재 c-Met 변이를 타깃하는 ADC 중 상용화 된 제품은 애브비의 엠렐리스가 유일하다. 엠렐리스는 주요 평가지표인 ORR과 반응지속기간(DOR) 개선을 근거로 이뤄졌으며, 확증 임상에서 임상적 유용성이 확인될 경우 정식 승인으로 전환될 예정이다. 임상2상 LUMINOSITY 연구에서 c-Met 과발현 환자 84명을 대상으로 한 분석 결과, 엠렐리스 투여군의 ORR은 35%, DOR 중앙값은 7.2개월로 나타났다.주요 이상반응은 말초신경병증, 피로, 식욕 감소, 말초부종 등이었으며, 3~4등급 이상반응으로는 림프구 감소, 간효소 상승, 전해질 이상 등이 보고됐다.엠렐리스는 2021년 해당 임상 데이터를 근거로 FDA로부터 혁신치료제(Breakthrough Therapy Designation)로도 지정된 바 있다.현재 엠렐리스는 3상 확증 임상 TeliMET NSCLC-01 연구에서 단독요법으로 추가 평가가 진행 중이다.2025-12-20 06:00:54손형민 기자 -
![[2025 결산] 정은경 취임…대체조제·제네릭 인하 드라이브](https://vod.dailypharm.com/new_dailypharm/news/thumbnail/2025/12/14/fd569100-2ad4-4445-980a-53d14edcaa50.jpg) [2025 결산] 정은경 취임…대체조제·제네릭 인하 드라이브[데일리팜=이정환 기자]올해(2025년) 보건복지부는 정권 교체로 인한 신임 정은경 장관 취임으로 행정·입법 전반에 큰 변화를 겪었다.윤석열 전 대통령의 12.3 비상계엄 선포로 인한 탄핵이 결정되면서 치러진 조기 대통령 선거에서 이재명 대통령이 당선된 데 따른 영향이다.복지부는 정은경 장관 취임 후 국민 의약품 수급 불안정 사태 해결을 위한 '약국 대체조제 사후통보 활성화' 시행규칙 개정과 제네릭 약가제도 개편안 공개, 의대정원 증원 정책으로 촉발된 의정갈등 해소 등 굵직한 현안을 해소 전면에 섰다.이재명 대통령 당선·정권 교체…정은경 장관 취임이재명 대통령이 지난 6월 3일 치러진 제21대 대통령 선거에서 당선되면서 다수 야당이었던 더불어민주당이 집권여당 자리에 올랐다.정은경 복지부 장관헌법재판소가 재판관 8명 만장일치 의견으로 윤석열 전 대통령의 파면을 선고하면서 치러진 조기 대선 결과다. 파면 선고일과 시각은 지난 4월 4일 오전 11시 22분이다.이로써 복지부 역시 큰 변화에 직면하게 됐는데, 의대정원 2000명 증원 정책으로 의정갈등 전면에 섰던 조규홍 전 장관이 물러나고 의사 출신 정은경 장관이 새로 취임된 게 가장 큰 변화다.정은경(60·서울의대) 제56대 복지부 장관은 정진엽 전 장관(2015~2017) 이후 8년 만의 의사 출신 장관이다. 여성 복지부 장관으로는 진수희 전 장관(2010~2011) 이후 14년 만에 복지부 수장 자리에 올랐다.정 장관은 취임 후 비대면진료 정식 제도화, 제네릭 약가인하를 통한 건강보험재정 지속성 강화, 대체조제 활성화·제한적 성분명 처방 등을 통한 수급 불안정약 대책 마련을 국정과제로 채택해 행정에 나서고 있다.복지부, 대체조제 사후통보 전산화 시행규칙 개정…선제 행정복지부는 올해 1월 약사 대체조제 사후통보방식에 건강보험심사평가원 업무포털을 추가하는 내용의 약사법 시행규칙 일부개정안을 입법예고하면서 수급불안정 의약품 문제 해결 실마리 찾기에 나섰다.이후 의료계와 약계 의견수렴 절차를 거친 대체조제 사후통보 전산화 시행규칙 개정안은 최종적으로 '건강보험심사평가원 정보시스템'을 추가하는 내용으로 수정돼 지난 5월 2일 복지부 공포됐다.개정 시행규칙은 부칙에 따라 내년(2026년) 2월 2일부터 시행된다. 이 날을 기점으로 약사는 의사가 발행한 환자 처방전에 기재된 약과 성분·용량·제형이 동등하다고 식품의약품안전처장이 인정한 약으로 대체조제한 뒤 '전화·팩스·컴퓨터통신'외 '심평원 정보시스템'으로도 사후통보가 가능해진다.특히 복지부의 시행규칙 개정안 적극행정은 추후 국회의 약사법 개정으로도 이어지는 성과를 냈다. 약사법 상 명확한 법적 근거를 마련해야 심평원에 관련 업무를 제대로 위탁할 수 있고, 예산 차원에서도 지원을 받을 수 있다는 의견이 국회 공감대를 얻으면서다.제네릭 약가인하 담은 약가제도 개편안 공표…제약계 반발정 장관이 이끄는 복지부는 올해 제네릭 약가인하를 담은 약가제도 개편안을 건강보험정책심의위원회 보고하고 내년 의결·시행 계획을 공표하기도 했다.2012년 당해년도 일괄 약가인하 이후 현재(2025년)까지 약가 조정·인하가 전혀 되지 않았거나, 소폭 인하된 품목 4500개에 대해서만 제한적으로 제네릭 약가 산정률을 53.55%에서 40%대로 낮추는 게 핵심 내용이다.복지부는 이번 약가제도 개편안 무게중심을 약가인하를 통한 건보재정 절감이 아닌 신약 R&D 등 혁신 가치에 기여한 제약사와 국가필수의약품·퇴장방지의약품 등 수급 불안정 의약품 문제 해소 기여 제약사에 대한 보상 확대에 뒀다는 입장이다.그럼에도 불구하고 국내 제약업계는 복지부 약가제도 개편안을 "국산 제네릭 약가를 깎아 다국적사·빅파마 수입 신약에 퍼주는 행정"으로 규정하고 연일 비판 목소리를 내고 있다.일단 2012년 당해년도 제네릭 4500개 품목만 약가를 깎겠다는 복지부 발언을 일절 신뢰할 수 없다는 게 국내 제약업계 반발 이유다.결국 복지부가 2012년 이후부터 지금까지 등재된 제네릭 1만5000여개에 대해서도 순차적으로 40%대 약가인하 행정을 펴는 게 명약관화하다는 비판이다. 결국 순차적이지만 일괄 약가인하를 또 한번 단행하는 행정이란 얘기다.실제 복지부는 1만5000여개 기등재 제네릭에 대해서도 약가인하 필요성과 인하 기전·방식을 고민할 필요가 있다는 입장이다.복지부는 지난 11월 건정심 보고한 약가제도 개편안에 대해 내년 1월까지 제약업계 의견수렴 후 2월 건정심에서 의결한 뒤 7월부터 시행한다는 계획이다.국내 제약업계는 이같은 복지부 행정계획에 대해 수용할 수 없다는 분위기다. 한국제약바이오협회 등은 복지부의 약가제도 개편안의 건정심 의결 시점 자체를 더 늦춰야 하며, 약가인하율에 해당하는 제네릭 약가 산정률 '40%대'를 건정심 의결안에 포함해서도 안된다는 의견을 지속적이고 강력하게 개진할 방침이다.2025-12-15 06:00:58이정환 기자
[2025 결산] 정은경 취임…대체조제·제네릭 인하 드라이브[데일리팜=이정환 기자]올해(2025년) 보건복지부는 정권 교체로 인한 신임 정은경 장관 취임으로 행정·입법 전반에 큰 변화를 겪었다.윤석열 전 대통령의 12.3 비상계엄 선포로 인한 탄핵이 결정되면서 치러진 조기 대통령 선거에서 이재명 대통령이 당선된 데 따른 영향이다.복지부는 정은경 장관 취임 후 국민 의약품 수급 불안정 사태 해결을 위한 '약국 대체조제 사후통보 활성화' 시행규칙 개정과 제네릭 약가제도 개편안 공개, 의대정원 증원 정책으로 촉발된 의정갈등 해소 등 굵직한 현안을 해소 전면에 섰다.이재명 대통령 당선·정권 교체…정은경 장관 취임이재명 대통령이 지난 6월 3일 치러진 제21대 대통령 선거에서 당선되면서 다수 야당이었던 더불어민주당이 집권여당 자리에 올랐다.정은경 복지부 장관헌법재판소가 재판관 8명 만장일치 의견으로 윤석열 전 대통령의 파면을 선고하면서 치러진 조기 대선 결과다. 파면 선고일과 시각은 지난 4월 4일 오전 11시 22분이다.이로써 복지부 역시 큰 변화에 직면하게 됐는데, 의대정원 2000명 증원 정책으로 의정갈등 전면에 섰던 조규홍 전 장관이 물러나고 의사 출신 정은경 장관이 새로 취임된 게 가장 큰 변화다.정은경(60·서울의대) 제56대 복지부 장관은 정진엽 전 장관(2015~2017) 이후 8년 만의 의사 출신 장관이다. 여성 복지부 장관으로는 진수희 전 장관(2010~2011) 이후 14년 만에 복지부 수장 자리에 올랐다.정 장관은 취임 후 비대면진료 정식 제도화, 제네릭 약가인하를 통한 건강보험재정 지속성 강화, 대체조제 활성화·제한적 성분명 처방 등을 통한 수급 불안정약 대책 마련을 국정과제로 채택해 행정에 나서고 있다.복지부, 대체조제 사후통보 전산화 시행규칙 개정…선제 행정복지부는 올해 1월 약사 대체조제 사후통보방식에 건강보험심사평가원 업무포털을 추가하는 내용의 약사법 시행규칙 일부개정안을 입법예고하면서 수급불안정 의약품 문제 해결 실마리 찾기에 나섰다.이후 의료계와 약계 의견수렴 절차를 거친 대체조제 사후통보 전산화 시행규칙 개정안은 최종적으로 '건강보험심사평가원 정보시스템'을 추가하는 내용으로 수정돼 지난 5월 2일 복지부 공포됐다.개정 시행규칙은 부칙에 따라 내년(2026년) 2월 2일부터 시행된다. 이 날을 기점으로 약사는 의사가 발행한 환자 처방전에 기재된 약과 성분·용량·제형이 동등하다고 식품의약품안전처장이 인정한 약으로 대체조제한 뒤 '전화·팩스·컴퓨터통신'외 '심평원 정보시스템'으로도 사후통보가 가능해진다.특히 복지부의 시행규칙 개정안 적극행정은 추후 국회의 약사법 개정으로도 이어지는 성과를 냈다. 약사법 상 명확한 법적 근거를 마련해야 심평원에 관련 업무를 제대로 위탁할 수 있고, 예산 차원에서도 지원을 받을 수 있다는 의견이 국회 공감대를 얻으면서다.제네릭 약가인하 담은 약가제도 개편안 공표…제약계 반발정 장관이 이끄는 복지부는 올해 제네릭 약가인하를 담은 약가제도 개편안을 건강보험정책심의위원회 보고하고 내년 의결·시행 계획을 공표하기도 했다.2012년 당해년도 일괄 약가인하 이후 현재(2025년)까지 약가 조정·인하가 전혀 되지 않았거나, 소폭 인하된 품목 4500개에 대해서만 제한적으로 제네릭 약가 산정률을 53.55%에서 40%대로 낮추는 게 핵심 내용이다.복지부는 이번 약가제도 개편안 무게중심을 약가인하를 통한 건보재정 절감이 아닌 신약 R&D 등 혁신 가치에 기여한 제약사와 국가필수의약품·퇴장방지의약품 등 수급 불안정 의약품 문제 해소 기여 제약사에 대한 보상 확대에 뒀다는 입장이다.그럼에도 불구하고 국내 제약업계는 복지부 약가제도 개편안을 "국산 제네릭 약가를 깎아 다국적사·빅파마 수입 신약에 퍼주는 행정"으로 규정하고 연일 비판 목소리를 내고 있다.일단 2012년 당해년도 제네릭 4500개 품목만 약가를 깎겠다는 복지부 발언을 일절 신뢰할 수 없다는 게 국내 제약업계 반발 이유다.결국 복지부가 2012년 이후부터 지금까지 등재된 제네릭 1만5000여개에 대해서도 순차적으로 40%대 약가인하 행정을 펴는 게 명약관화하다는 비판이다. 결국 순차적이지만 일괄 약가인하를 또 한번 단행하는 행정이란 얘기다.실제 복지부는 1만5000여개 기등재 제네릭에 대해서도 약가인하 필요성과 인하 기전·방식을 고민할 필요가 있다는 입장이다.복지부는 지난 11월 건정심 보고한 약가제도 개편안에 대해 내년 1월까지 제약업계 의견수렴 후 2월 건정심에서 의결한 뒤 7월부터 시행한다는 계획이다.국내 제약업계는 이같은 복지부 행정계획에 대해 수용할 수 없다는 분위기다. 한국제약바이오협회 등은 복지부의 약가제도 개편안의 건정심 의결 시점 자체를 더 늦춰야 하며, 약가인하율에 해당하는 제네릭 약가 산정률 '40%대'를 건정심 의결안에 포함해서도 안된다는 의견을 지속적이고 강력하게 개진할 방침이다.2025-12-15 06:00:58이정환 기자 -
 '고마진 원료로 실탄 확보'...에스티팜, 신약 개발 외연 확장[데일리팜=차지현 기자] 에스티팜이 신약개발 분야로 보폭을 넓히고 있다. 올리고뉴클레오타이드 원료의약품(CDMO) 사업을 통해 벌어들인 안정적인 수익을 바탕으로 메신저 리보핵산(mRNA)과 유전자 편집 치료제 등 차세대 RNA 치료제 시장 공략에 속도를 내는 분위기다.13일 바이오 업계에 따르면 에스티팜은 최근 전염병예방혁신연합(CEPI)이 추진하는 중증열성혈소판감소증후군(SFTS) mRNA 백신 개발 프로젝트의 핵심 제조·기술 파트너로 선정됐다.이번 연구는 인공지능(AI)·구조기반 설계를 활용해 항원 후보물질을 도출하고 면역원성과 안전성을 검증하는 장기 연구다. 오는 2030년까지 CEPI의 지원을 받아 수행될 예정이다. 질병관리청 국립보건연구원과 국제백신연구소(IVI), 서울대학교가 공동으로 참여한다.백신 후보물질은 질병관리청과 서울대학교가 항원을 설계하고 에스티팜은 mRNA 원료 설계와 생산을 담당한다. 구체적으로 에스티팜은 자체 mRNA 5’ 캡핑 기술(SmartCap)과 지질나노입자(LNP) 전달 기술(STLNP), 글로벌 표준의 GMP 제조 역량을 제공한다.SFTS는 국내 비롯한 중국·일본·대만 등 동아시아에서 주로 발생하는 참진드기 매개 감염병이다. 고열과 혈소판 감소, 신부전 등을 일으켜 고령 환자에게서는 치명률이 높은 질환이다. 바이러스 면역 회피 특성 탓에 아직 상용화된 백신이 없는 상황으로 mRNA 백신은 항원 구조를 정밀하게 구현해 효과적인 면역 반응을 유도할 수 있을 것이라는 게 회사 측 기대다.에스티팜은 올해 들어 mRNA와 차세대 RNA 치료제 분야에서 존재감을 본격적으로 드러내고 있다. 회사는 올해 TIDES USA 2025와 CRISPR MEDiCiNE 2025 등 RNA·유전자 치료제 분야를 대표하는 국제 학회에 연이어 참가하며 적극적인 대외 행보에 나섰다. 해당 학회에서 에스티팜은 mRNA 관련 자체 플랫폼을 소개하고 gRNA 등 mRNA 플랫폼 응용 범위를 유전자치료제 영역까지 확장하겠다는 중장기 전략과 비전을 제시했다.가시적인 성과도 나오고 있다. 에스티팜은 올해 1분기와 2분기 각각 mRNA 부문 매출 6억원, 7억원을 기록하며 관련 사업에서 첫 실적을 창출했다. 3분기에는 mRNA 부문과 관련 초기 R&D 프로젝트에서 14억원의 매출을 올렸다. LNP 지질 중간체 공급과 mRNA 목록제품, 자체개발 캡핑 시약 CDMO를 통해 매출이 발생했다.에스티팜 mRNA CDMO 플랫폼 개요 (자료: 에스티팜)동아쏘시오그룹 계열사 에스티팜은 올리고와 저분자 화학합성 신약 원료의약품 위탁개발생산(CDMO)을 주력으로 영위하는 업체다. 당초 제네릭 원료의약품(API) 생산 업체로 출발했으나 이후 고성장·고부가가치 올리고 원료 생산 중심으로 사업 구조를 고도화해 왔다. 최근에는 mRNA와 유전자 편집 치료제 등 차세대 RNA 치료제 분야로 사업 영역 확장을 꾀하는 모습이다.에스티팜은 2020년 mRNA 사업에 처음 뛰어들었다. 코로나19 팬데믹을 계기로 mRNA 기술의 상업적 가능성이 부각되자 같은 해 8월 반월캠퍼스에 비임상 실험용 mRNA 생산 설비 증설에 착수하며 관련 사업을 본격화했다. 이후 단계적으로 투자를 확대해 상업화 수준 mRNA 원액 생산 설비를 완공하며 생산 인프라를 갖췄다.에스티팜은 2020년 8월 반월캠퍼스 내 비임상 실험용 규모 증설을 시작으로 2021년 5월 추가 증설을 완료했고 2023년 8월 연간 3000만~1억 도즈 상당 상업화 규모 mRNA 백신 원액을 생산할 수 있는 설비를 완공했다. mRNA 분자를 안정화하는 핵심기술을 독자화하고 mRNA 약물 전달의 핵심기술인 LNP를 공동개발하는 등 핵심 플랫폼 기술도 내재화했다.나아가 에스티팜은 신약개발 영역으로도 보폭을 넓히는 중이다. 단순 mRNA 원료 위탁생산에 그치지 않고 자체 원천기술을 바탕으로 백신·치료제 개발 과정에 직접 참여하는 전략으로 방향을 전환한 것이다.회사는 mRNA 기반 코로나19 백신 후보물질 'STP2104' 개발에 나섰다. STP2104는 코로나19 바이러스의 스파이크 단백질 정보를 담은 mRNA에 T세포 면역을 강화하는 요소를 추가해, 항체와 세포 면역을 동시에 유도하는 백신이다. 에스티팜은 STP2104 임상 1상에서 글로벌 mRNA 백신과 동등 이상의 중화항체 역가와 항체양전율을 확인했다. 다만 전략적 판단에 따라 임상 1상 이후 추가 개발은 중단한 상태다.회사는 미국 자회사를 통해 mRNA 기반 혁신 신약 파이프라인을 강화하는 데 힘을 쏟고 있다. 에스티팜은 2021년 4, 미국 샌디에이고에 mRNA와 CAR-NKT 플랫폼 기술을 이용한 신약개발 바이오텍 레바티오 테라퓨틱스를 설립했다. 또 같은 해 8월 미국 애틀랜타에 mRNA 신약개발 바이오텍 버나젠을 설립했다.현재 버나젠은 현재 10여 개의 항바이러스 질환 mRNA 백신 파이프라인을 보유 중이다. 특히 2023년 3월에는 미국질병청(CDC)와 하트랜드바이러스 mRNA 백신 공동연구개발 업무협약(MOU)을 체결하고 7월 본계약을 완료했다. 백신 개발에 에스티팜의 SmartCap과 STLNP 플랫폼 기술을 적용하는 게 골자다. 레바티오의 경우 작년 말 청산했으나 CAR-NKT, cirRNA 등 핵심 플랫폼 기술 IP와 신약 파이프라인은 모두 에스티팜에게 이전돼 관련 연구를 지속하고 있다.이 같은 신사업 확장 동력은 기존 CDMO 사업에서 창출되는 안정적인 현금흐름에서 나온다. 올 3분기 에스티팜 영업이익은 147억원으로 전년 동기 대비 141.6% 급증했다. 같은 기간 매출액은 819억원으로 전년보다 32.7% 늘었다. 고마진 올리고핵산 CDMO 비중 확대와 상업화 프로젝트 증가가 맞물린 결과다. 매출 구성을 보면 올리고 CDMO 매출이 686억원으로 전체 매출의 84%를 차지했고 이 가운데 상업화 단계 프로젝트가 절반 이상인 54%를 차지해 수익성 개선을 이끌었다.2025-12-13 06:00:53차지현 기자
'고마진 원료로 실탄 확보'...에스티팜, 신약 개발 외연 확장[데일리팜=차지현 기자] 에스티팜이 신약개발 분야로 보폭을 넓히고 있다. 올리고뉴클레오타이드 원료의약품(CDMO) 사업을 통해 벌어들인 안정적인 수익을 바탕으로 메신저 리보핵산(mRNA)과 유전자 편집 치료제 등 차세대 RNA 치료제 시장 공략에 속도를 내는 분위기다.13일 바이오 업계에 따르면 에스티팜은 최근 전염병예방혁신연합(CEPI)이 추진하는 중증열성혈소판감소증후군(SFTS) mRNA 백신 개발 프로젝트의 핵심 제조·기술 파트너로 선정됐다.이번 연구는 인공지능(AI)·구조기반 설계를 활용해 항원 후보물질을 도출하고 면역원성과 안전성을 검증하는 장기 연구다. 오는 2030년까지 CEPI의 지원을 받아 수행될 예정이다. 질병관리청 국립보건연구원과 국제백신연구소(IVI), 서울대학교가 공동으로 참여한다.백신 후보물질은 질병관리청과 서울대학교가 항원을 설계하고 에스티팜은 mRNA 원료 설계와 생산을 담당한다. 구체적으로 에스티팜은 자체 mRNA 5’ 캡핑 기술(SmartCap)과 지질나노입자(LNP) 전달 기술(STLNP), 글로벌 표준의 GMP 제조 역량을 제공한다.SFTS는 국내 비롯한 중국·일본·대만 등 동아시아에서 주로 발생하는 참진드기 매개 감염병이다. 고열과 혈소판 감소, 신부전 등을 일으켜 고령 환자에게서는 치명률이 높은 질환이다. 바이러스 면역 회피 특성 탓에 아직 상용화된 백신이 없는 상황으로 mRNA 백신은 항원 구조를 정밀하게 구현해 효과적인 면역 반응을 유도할 수 있을 것이라는 게 회사 측 기대다.에스티팜은 올해 들어 mRNA와 차세대 RNA 치료제 분야에서 존재감을 본격적으로 드러내고 있다. 회사는 올해 TIDES USA 2025와 CRISPR MEDiCiNE 2025 등 RNA·유전자 치료제 분야를 대표하는 국제 학회에 연이어 참가하며 적극적인 대외 행보에 나섰다. 해당 학회에서 에스티팜은 mRNA 관련 자체 플랫폼을 소개하고 gRNA 등 mRNA 플랫폼 응용 범위를 유전자치료제 영역까지 확장하겠다는 중장기 전략과 비전을 제시했다.가시적인 성과도 나오고 있다. 에스티팜은 올해 1분기와 2분기 각각 mRNA 부문 매출 6억원, 7억원을 기록하며 관련 사업에서 첫 실적을 창출했다. 3분기에는 mRNA 부문과 관련 초기 R&D 프로젝트에서 14억원의 매출을 올렸다. LNP 지질 중간체 공급과 mRNA 목록제품, 자체개발 캡핑 시약 CDMO를 통해 매출이 발생했다.에스티팜 mRNA CDMO 플랫폼 개요 (자료: 에스티팜)동아쏘시오그룹 계열사 에스티팜은 올리고와 저분자 화학합성 신약 원료의약품 위탁개발생산(CDMO)을 주력으로 영위하는 업체다. 당초 제네릭 원료의약품(API) 생산 업체로 출발했으나 이후 고성장·고부가가치 올리고 원료 생산 중심으로 사업 구조를 고도화해 왔다. 최근에는 mRNA와 유전자 편집 치료제 등 차세대 RNA 치료제 분야로 사업 영역 확장을 꾀하는 모습이다.에스티팜은 2020년 mRNA 사업에 처음 뛰어들었다. 코로나19 팬데믹을 계기로 mRNA 기술의 상업적 가능성이 부각되자 같은 해 8월 반월캠퍼스에 비임상 실험용 mRNA 생산 설비 증설에 착수하며 관련 사업을 본격화했다. 이후 단계적으로 투자를 확대해 상업화 수준 mRNA 원액 생산 설비를 완공하며 생산 인프라를 갖췄다.에스티팜은 2020년 8월 반월캠퍼스 내 비임상 실험용 규모 증설을 시작으로 2021년 5월 추가 증설을 완료했고 2023년 8월 연간 3000만~1억 도즈 상당 상업화 규모 mRNA 백신 원액을 생산할 수 있는 설비를 완공했다. mRNA 분자를 안정화하는 핵심기술을 독자화하고 mRNA 약물 전달의 핵심기술인 LNP를 공동개발하는 등 핵심 플랫폼 기술도 내재화했다.나아가 에스티팜은 신약개발 영역으로도 보폭을 넓히는 중이다. 단순 mRNA 원료 위탁생산에 그치지 않고 자체 원천기술을 바탕으로 백신·치료제 개발 과정에 직접 참여하는 전략으로 방향을 전환한 것이다.회사는 mRNA 기반 코로나19 백신 후보물질 'STP2104' 개발에 나섰다. STP2104는 코로나19 바이러스의 스파이크 단백질 정보를 담은 mRNA에 T세포 면역을 강화하는 요소를 추가해, 항체와 세포 면역을 동시에 유도하는 백신이다. 에스티팜은 STP2104 임상 1상에서 글로벌 mRNA 백신과 동등 이상의 중화항체 역가와 항체양전율을 확인했다. 다만 전략적 판단에 따라 임상 1상 이후 추가 개발은 중단한 상태다.회사는 미국 자회사를 통해 mRNA 기반 혁신 신약 파이프라인을 강화하는 데 힘을 쏟고 있다. 에스티팜은 2021년 4, 미국 샌디에이고에 mRNA와 CAR-NKT 플랫폼 기술을 이용한 신약개발 바이오텍 레바티오 테라퓨틱스를 설립했다. 또 같은 해 8월 미국 애틀랜타에 mRNA 신약개발 바이오텍 버나젠을 설립했다.현재 버나젠은 현재 10여 개의 항바이러스 질환 mRNA 백신 파이프라인을 보유 중이다. 특히 2023년 3월에는 미국질병청(CDC)와 하트랜드바이러스 mRNA 백신 공동연구개발 업무협약(MOU)을 체결하고 7월 본계약을 완료했다. 백신 개발에 에스티팜의 SmartCap과 STLNP 플랫폼 기술을 적용하는 게 골자다. 레바티오의 경우 작년 말 청산했으나 CAR-NKT, cirRNA 등 핵심 플랫폼 기술 IP와 신약 파이프라인은 모두 에스티팜에게 이전돼 관련 연구를 지속하고 있다.이 같은 신사업 확장 동력은 기존 CDMO 사업에서 창출되는 안정적인 현금흐름에서 나온다. 올 3분기 에스티팜 영업이익은 147억원으로 전년 동기 대비 141.6% 급증했다. 같은 기간 매출액은 819억원으로 전년보다 32.7% 늘었다. 고마진 올리고핵산 CDMO 비중 확대와 상업화 프로젝트 증가가 맞물린 결과다. 매출 구성을 보면 올리고 CDMO 매출이 686억원으로 전체 매출의 84%를 차지했고 이 가운데 상업화 단계 프로젝트가 절반 이상인 54%를 차지해 수익성 개선을 이끌었다.2025-12-13 06:00:53차지현 기자 -
 약사미래연구회, 21일 ‘직능 확장과 미래 전략’ 주제 토론회[데일리팜=김지은 기자] 젊은 약사들의 모임 약사미래연구회(회장 안준규)는 오는 21일 오후 2시부터 5시까지 서울 당산역 인근 재단법인 서울현대교육재단 현대아트홀에서 ‘약사의 직능확장과 미래에 대한 전략 토론회’를 진행한다. 연구회는 이번 토론회에 대해 창고형 약국 등장, 비대면 진료·약배달 플랫폼 확산, 인공지능(AI) 기술 도입 등으로 약사 업무 경계가 재편되는 상황에서 약사의 전문성, 역할 확장 방안을 논의하기 위해 기획됐다고 밝혔다. 특히 연구회는 약사 직능 축소에 대한 현장의 체감과 위기의식을 바탕으로 현실적 대응 방안을 모색하는 데 이번 토론회의 초점을 맞췄다고 설명했다.이날 토론회는 총 2부로 구성되며, 1부는 연사들의 주제 발표로 문제의식을 공유하고 2부는 청중이 질문하고 의견을 제시하는 참여형 자유 토론 방식으로 진행될 예정이다. 1부에서는 임명재 약사가 ‘창고형약국, 약국의 경쟁력은 쇠락할까?’를 주제로 대형화·구조화 되는 약국 시장 흐름을 조망하고, 안준규 약사가 ‘비대면 진료 시대, 망하는 약국과 흥하는 약국’을 주제로 플랫폼 환경 속 약국의 생존 전략을 공유한다. 이어 김용성 약사가 ‘근무약사의 인근 개국, 폐업 위기에서 회복까지’를 주제로 병원 기반 없이 일명 맨땅 개국으로 시작한 약국 운영 과정에서 마주한 위기와 이를 돌파해 온 실제 경험을 소개하고, 김현태 약사는 ‘개업 실패에서 얻는 나만의 노하우’를 통해 실패 경험을 바탕으로 한 경영·운영 인사이트를 제시할 방침이다.연구회 측은 “최근 약사 직능을 둘러싼 변화로 많은 약사들이 불안과 위기의식을 느끼고 있다”며 “이번 토론회는 이런 문제의식을 공유하는 데 그치지 않고 약사가 스스로 시장을 만들고 직능을 확장할 수 있는 현실적인 방안을 함께 모색하는 자리가 될 것”이라고 말했다.이번 토론회는 약사 5000원, 약대생은 무료로 참여 가능하며 참가 신청은 구글폼(https://forms.gle/KtkoBBA99Zq48kuy8)을 통해 가능하다. 자세한 내용은 카카오톡 채널(@pharmfuture) 문의를 통해 확인할 수 있다.2025-12-11 09:44:36김지은 기자
약사미래연구회, 21일 ‘직능 확장과 미래 전략’ 주제 토론회[데일리팜=김지은 기자] 젊은 약사들의 모임 약사미래연구회(회장 안준규)는 오는 21일 오후 2시부터 5시까지 서울 당산역 인근 재단법인 서울현대교육재단 현대아트홀에서 ‘약사의 직능확장과 미래에 대한 전략 토론회’를 진행한다. 연구회는 이번 토론회에 대해 창고형 약국 등장, 비대면 진료·약배달 플랫폼 확산, 인공지능(AI) 기술 도입 등으로 약사 업무 경계가 재편되는 상황에서 약사의 전문성, 역할 확장 방안을 논의하기 위해 기획됐다고 밝혔다. 특히 연구회는 약사 직능 축소에 대한 현장의 체감과 위기의식을 바탕으로 현실적 대응 방안을 모색하는 데 이번 토론회의 초점을 맞췄다고 설명했다.이날 토론회는 총 2부로 구성되며, 1부는 연사들의 주제 발표로 문제의식을 공유하고 2부는 청중이 질문하고 의견을 제시하는 참여형 자유 토론 방식으로 진행될 예정이다. 1부에서는 임명재 약사가 ‘창고형약국, 약국의 경쟁력은 쇠락할까?’를 주제로 대형화·구조화 되는 약국 시장 흐름을 조망하고, 안준규 약사가 ‘비대면 진료 시대, 망하는 약국과 흥하는 약국’을 주제로 플랫폼 환경 속 약국의 생존 전략을 공유한다. 이어 김용성 약사가 ‘근무약사의 인근 개국, 폐업 위기에서 회복까지’를 주제로 병원 기반 없이 일명 맨땅 개국으로 시작한 약국 운영 과정에서 마주한 위기와 이를 돌파해 온 실제 경험을 소개하고, 김현태 약사는 ‘개업 실패에서 얻는 나만의 노하우’를 통해 실패 경험을 바탕으로 한 경영·운영 인사이트를 제시할 방침이다.연구회 측은 “최근 약사 직능을 둘러싼 변화로 많은 약사들이 불안과 위기의식을 느끼고 있다”며 “이번 토론회는 이런 문제의식을 공유하는 데 그치지 않고 약사가 스스로 시장을 만들고 직능을 확장할 수 있는 현실적인 방안을 함께 모색하는 자리가 될 것”이라고 말했다.이번 토론회는 약사 5000원, 약대생은 무료로 참여 가능하며 참가 신청은 구글폼(https://forms.gle/KtkoBBA99Zq48kuy8)을 통해 가능하다. 자세한 내용은 카카오톡 채널(@pharmfuture) 문의를 통해 확인할 수 있다.2025-12-11 09:44:36김지은 기자 -
 전이성·절제 불가능성 GIST, 광범위 억제제 '리프레티닙'Qinlock(킨록, 성분명: ripretinib, ONO Pharma)은 광범위 KIT/PDGFRA 억제제다. 2020년 미국 FDA와 2021년 EMA에서 최소 3종의 TKI 치료 후에도 질환이 진행한 성인 전이성 또는 절제 불가능한 위장관기질종양(Gastrointestinal Stromal Tumor, GIST)에 대한 4차 치료제로 승인됐다. 국내에서는 올해 7월 희귀의약품으로 지정됐다.위장관기질종양(GIST)은 위장관 벽의 간질조직에서 발생하는 대표적인 연부조직 육종으로, 간질성 카할세포(interstitial cells of Cajal)의 발생학적·기능적 특징을 공유하는 전구세포에서 기원하는 것으로 알려져 있다. 분자생물학적 관점에서 대부분의 GIST는 KIT 또는 PDGFRA 유전자의 활성화 돌연변이를 보유하며, 이러한 변이는 주요 신호전달 경로를 지속적으로 활성화해 세포 증식, 생존, 침윤을 촉진함으로써 종양의 발병과 진행을 주도한다.한편 GIST는 위장관 어느 부위에서도 발생할 수 있으며, 내시경으로 관찰되는 점막층이 아닌 그 아래의 점막하층이나 근육층에서 기원하기 때문에 조기 발견이 어렵다. 대부분은 양성으로 진단되지만 약 20~30%는 악성으로 진행할 수 있다. 증상은 종양이 커지거나 암세포가 점막하층 또는 근육층을 뚫고 점막을 침범할 때 시작되며, 복통이 발생하거나 경우에 따라 장폐색을 유발하기도 한다.전이성 또는 절제 불가능한 GIST의 치료 패러다임은 표적치료제(tyrosine kinase inhibitor, TKI)의 등장 이후 근본적으로 변화하였다. 2001년 도입된 이마티닙(Imatinib)은 기존 세포독성 화학요법에 반응하지 않던 GIST 환자의 생존 기간을 획기적으로 연장시키며 분자표적치료 시대를 열었다.이후 수니티닙(Sunitinib), 레고라티닙(Regorafenib), 리프레티닙(Ripretinib) 등 다양한 TKI가 연속적으로 도입되면서 치료 순차 전략이 구체화되었으나, 획득 내성(acquired resistance)은 여전히 해결되지 않은 주요 임상적 과제로 남아 있다. 이에 따라 약제 순서의 최적화, 병용치료 전략, 새로운 분자 표적의 발굴 등에 대한 연구가 활발히 진행되고 있다.킨록은 INVICTUS 임상 3상 연구를 통해 유효성을 입증하였다. 총 129명의 GIST 환자를 대상으로 한 해당 연구에서 리프레티닙 투여군의 무진행생존기간(PFS) 중앙값은 6.3개월로, 위약군의 1.0개월 대비 현저한 개선을 보였다. 또한 질병 진행 또는 사망 위험을 약 85% 감소시켜 통계적으로 유의한 치료 효과를 확인하였다.전이성 또는 절제 불가능한 위장관기질종양(Gastrointestinal stromal tumor, GIST)는 어떤 질환인가?위장관기질종양(GIST)은 소화관 벽에 위치한 특수 신경세포인 카할 간질세포(interstitial cells of Cajal, ICC)에서 기원하는 드문 중간엽성 종양(mesenchymal tumor)이다. ICC는 자율신경계의 일부로 위장관 고유근층 내에서 조율 세포(pacemaker cell) 역할을 수행하며, 위장관 연동운동을 조절하는 기능을 담당한다.GIST의 발생 부위는 위가 약 60%, 소장이 약 30%로 가장 흔하며, 드물게 결장·직장·식도에서도 발생한다. 장간막이나 대망(greater omentum) 등 위장관 외부에서도 발생할 수 있으며, 이러한 경우는 장외(extra-gastrointestinal) GIST로 분류된다.GIST는 KIT(Kinase Insert Domain-containing Receptor Tyrosine Kinase) 또는 혈소판유래성장인자수용체 알파(Platelet-Derived Growth Factor Receptor Alpha, PDGFRA) 유전자의 활성화 돌연변이에 의해 발생하는 것으로 알려져 있다. 연간 발생률은 인구 백만 명당 약 10–15건으로 추정되며, 주로 50~70대에서 진단된다.KIT(CD117) 또는 PDGFRA 돌연변이는 전체 산발성 GIST의 약 85%에서 관찰되며, 티로신 키나제 수용체의 구성적 활성화를 통해 과형성과 종양 발생을 유도한다. 대부분은 후천적(somatic) 변이지만, 드물게 이러한 돌연변이가 유전되어 가족성 GIST를 일으킬 수 있다.한편 이러한 주요 변이를 보유하지 않는 야생형(wild-type) GIST는 NF1, BRAF, HRAS 등 다양한 분자 변이를 포함하는 이질적 집단이며, 신경섬유종증 1형, Carney triad, Carney-Stratakis syndrome 등 특정 종양 증후군과 연관되기도 한다.조직병리학적으로 GIST는 방추형, 상피양 또는 혼합형 세포 형태를 보이며, 면역조직화학적으로 KIT(CD117)와 DOG1(Discovered On GIST-1) 양성이 특징적이다. 임상 증상은 비특이적이며, 모호한 복부 불편감, 위장관 출혈, 조기 포만감, 혹은 촉지 가능한 종괴 등으로 다양하게 나타날 수 있다.진단에는 조영 CT 또는 MRI, 내시경 초음파를 통한 조직 채취, 그리고 분자 진단을 위한 유전자 돌연변이 분석이 포함된다. 치료 결정 시 종양의 크기, 해부학적 위치, 유사분열지수, 분자 변이 등이 종합적으로 고려된다. 국소 질환에서는 음성 절제연(R0 resection)을 확보한 수술적 절제가 기본 치료이며, 방사선 치료는 역할이 제한적이지만 일부 진행성 질환에서 증상 완화 목적으로 사용될 수 있다.임상적으로 GIST는 초기 단계에서 외과적 절제를 통해 완치를 기대할 수 있으나, 종양의 위치·크기·주변 장기 침윤 여부에 따라 완전 절제(R0)가 불가능한 경우가 적지 않다. 또한 진단 시 이미 간 또는 복막 전이가 동반된 사례가 흔하며, 이러한 전이성 또는 절제 불가능한 GIST는 더 이상 수술 중심의 국소치료로는 관리가 어렵고, 장기적인 전신 치료를 필요로 하는 만성적·재발성 종양의 특성을 보인다. 실제로 수술이 가능하더라도 광범위 절제가 필요하거나 주요 장기 기능 손상의 위험이 높아 근치적 수술의 이점이 기대되기 어려운 경우 ‘절제 불가능(unresectable)’ 범주로 분류되며, 이는 전이성 GIST와 동일한 치료 전략을 적용해야 하는 임상적 상황으로 간주된다.이와 같은 배경에서 티로신 키나제 억제제(TKI)의 도입은 GIST 전신 치료의 패러다임을 근본적으로 변화시켰다. 이마티닙(Imatinib)은 진행성·절제 불가능·전이성 GIST의 1차 치료제로 사용되며, 환자의 생존율을 의미 있게 향상시켰다.KIT(CD117) 또는 PDGFRA 돌연변이란 무엇인가?KIT(CD117) 또는 PDGFRA 돌연변이는 위장관 기질 종양(GIST)의 발생을 유도하는 핵심 분자 이상으로, 두 유전자가 암호화하는 수용체 티로신 키나제(receptor tyrosine kinase, RTK)에 구성적 활성화(activating mutation)를 일으키는 병적 변화이다.KIT 돌연변이는 전체 GIST의 약 70–80%, PDGFRA 돌연변이는 약 10–15%에서 발견되며, 이 두 유전자의 활성화 돌연변이가 전체 GIST의 약 85–90%를 차지하는 대표적 분자 병인으로 알려져 있다.특히 KIT 엑손 11, PDGFRA 엑손 18(D842V 등)의 특정 변이는 단백질 구조적 안정성과 자가활성화 억제 기전을 교란하여 종양 발생을 직접적으로 촉진한다. 동시에 이러한 변이들은 이마티닙을 포함한 여러 티로신 키나제 억제제(tyrosine kinase inhibitor,TKI)에 대한 약물 반응성을 결정하는 중요한 예측 인자로 기능한다.정상 상태에서 KIT과 PDGFRA는 성장인자 자극에 의해 제한적으로 활성화되며, 세포의 생존·증식·분화·이동을 정교하게 조절하는 신호전달 체계의 중심적 역할을 수행한다. 그러나 활성화 돌연변이가 발생하면 리간드 결합과 무관하게 수용체가 지속적으로 활성화되어, RAS–RAF–MAPK, PI3K–AKT, STAT 등 하위 신호 경로를 과도하게 자극함으로써 비조절적 세포 증식과 항아폽토시스 신호가 강화되고, 결국 종양 형성이 촉진된다.또한 KIT 엑손 9, 11, 13·14, 17·18 및 PDGFRA 엑손 18 돌연변이 등은 단백질의 활성화 루프와 구조적 균형을 변화시켜 수용체가 비활성 상태로 유지되지 못하고 지속적으로 ‘on’ 상태를 유지하게 만드는 중요한 분자적 기전을 제공한다.Structure of KIT and PDGFRA Receptors(출처: ONCOLOGY REPORTS 43: 751-764, 2020). 이처럼 KIT 또는 PDGFRA 돌연변이는 GIST 발생을 유도하는 근본 병인일 뿐 아니라, 돌연변이의 위치와 종류에 따라 약물 감수성과 내성 패턴이 뚜렷하게 달라지므로 임상적 치료 전략 전반을 좌우한다. 실제로 이마티닙을 비롯한 TKI의 반응성은 돌연변이 유형에 따라 큰 차이를 보이며, 일부 변이는 매우 좋은 초기 반응을 보이지만, 다른 변이는 고도의 내성을 나타낸다.티로신키나제 억제제(Tyrosine kinase inhibitor, TKI)의 작동 원리는?티로신 키나제는 세포 외부의 신호를 세포 내부로 전달하는 핵심 효소로, 활성화 여부에 따라 다양한 성장·분화 경로가 조절된다. 이 효소는 두 개의 판이 맞물린 형태를 이루는 상·하부 로브(N-lobe, C-lobe)를 기본 골격으로 하며, 두 로브 사이의 좁은 틈은 ATP가 결합하는 중심 자리를 형성한다. ATP가 이 틈에 정확히 결합하면 인산전달 반응이 활성화되고, 이러한 구조적 배치가 유지될 때 정상적인 신호전달이 지속된다.티로신 키나제의 활성 상태는 두 가지 주요 구조 스위치에 의해 정의된다. 첫 번째는 DFG(Aspartate–Phenylalanine–Glycine)라 불리는 스위치로, 이 잔기가 안쪽을 향하면 활성형(DFG-in), 바깥으로 뒤집히면 비활성형(DFG-out)을 형성한다. 두 번째는 αC-helix로, 이 구조가 안쪽으로 향하면 활성 배치를, 바깥으로 이동하면 비활성 배치를 이룬다. 두 스위치는 독립적으로 움직이지만, 어느 하나라도 비활성 방향으로 전환되면 전체 효소는 효과적으로 ‘잠긴’ 형태가 된다.ATP 결합 틈은 전면부와 후면부로 나눌 수 있다. 앞쪽 공간은 ATP가 결합하는 전통적인 자리로, 대부분의 억제제가 공유하는 결합 부위이다. 반면 뒤쪽 공간(back pocket)은 DFG가 바깥으로 뒤집힌 비활성 상태에서만 열리는 특수한 포켓으로, 억제제의 결합 방식 차이를 결정하는 중요한 구조적 요소이다.Type I 억제제는 활성형(DFG-in)의 ATP 앞자리만을 점유해 ATP 접근을 차단한다. 엘로티닙(Erlotinib), 게페티닙(Gefitinib), 크리조티닙(Crizotinib), 라파티닙(Lapatinib) 등이 대표적이며, 활성 상태의 키나제에 결합하기 때문에 활성형 구조에 크게 의존한다.Type II 억제제는 ATP 앞자리뿐 아니라 DFG-out 상태에서 형성되는 뒤쪽 공간까지 함께 점유한다. 이러한 결합 방식은 비활성형을 안정적으로 고정시키며, 상대적으로 길고 굴곡진 분자 구조를 가진다. 이마티닙(Imatinib), 수니티닙(Sunitinib), 레고라티닙(Regorafenib), 리프레티닙(Ripretinib) 등이 대표적이다.이 중 Ripretinib은 Type II 기전을 확장한 switch-control 억제제로, back pocket뿐 아니라 DFG 모티프와 αC-helix까지 동시에 고정한다. 이 기전은 ATP 경쟁 억제 수준을 넘어 키나제의 활성화 스위치 자체를 잠그는 방식으로, 다양한 돌연변이에 대해 보다 일관된 억제 효과를 보인다.이처럼 티로신 키나제 억제제는 ATP 결합 틈의 어느 부분을, 어떤 구조 상태에서 차단하는지에 따라 Type I, Type II, switch-control 계열로 구분된다. 이러한 구조-기전적 이해는 돌연변이에 의해 발생하는 내성 패턴을 설명하며, 새로운 약물 설계의 근거가 된다.최근에는 ATP-pocket 자체와 경쟁하지 않는 알로스테릭 기반 억제제가 개발되면서 억제제 분류는 더욱 확장되고 있다.Type III 억제제는 ATP-pocket 인접의 알로스테릭(allosteric) 포켓에 결합해 ATP와 비경쟁적으로 작용하며, 트라메티닙(Trametinib)과 코비멭닙(Cobimetinib)이 대표적이다.Type IV 억제제는 ATP 결합부와 물리적으로 떨어진 원거리 알로스테릭 포켓에 결합하며, BCR-ABL의 myristoyl 포켓을 표적하는 아시미닙(Asciminib)이 대표적이다. 이러한 원거리 결합 방식은 ATP-pocket 돌연변이에 거의 영향을 받지 않아 높은 선택성을 확보한다.Type V 억제제는 두 개 이상의 독립된 결합 부위를 동시에 점유하는 bivalent inhibitor로, ATP-pocket과 별도의 알로스테릭 포켓을 동시에 결합해 구조를 강하게 고정한다. 주로 RAF나 CDK 계열을 중심으로 전임상 연구가 진행되고 있다.마지막으로 Type VI 억제제는 특정 아미노산(주로 Cys)에 공유 결합을 형성하는 비가역 억제제로, 오시메티닙(Osimertinib), 아파티닙(Afatinib), 이부루티닙(Ibrutinib) 등이 대표적이다. 비가역적 특성으로 인해 강력한 결합 안정성과 돌연변이 선택성을 확보할 수 있으며, 기존 competitive TKI의 내성 문제를 보완하는 중요한 전략으로 자리잡았다.결국 Type I에서 Type VI에 이르는 분류는 티로신 키나제가 갖는 구조적 유연성과 활성 조절 메커니즘을 다양한 수준에서 겨냥하는 전략적 도구이다. ATP-pocket의 활성·비활성 상태를 이용하는 고전적 억제제부터 구조 스위치를 직접 제어하는 switch-control 계열, 그리고 알로스테릭·이중 결합·공유 결합 방식의 차세대 억제제까지 설계 전략이 확장되면서, 내성 극복과 선택성 향상 측면 모두에서 의미 있는 진전이 이루어지고 있다.Various Type Kinase Inhibitors(출처: Next Generation Kinase Inhibitors 15 July 2020 pp 29–59). 특히 KIT과 PDGFRA가 종양의 성장에 직접 관여하는 GIST와 같은 질환에서는 이러한 구조적 통찰이 치료 기전 이해뿐 아니라 전략적 약물 선택과 신약 개발의 핵심 기반이 된다.KIT/PDGFRA 억제제에는 어떤 약제가 있는가?KIT와 PDGFRA의 돌연변이는 GIST의 발생과 진행에 핵심적인 역할을 하며, 이러한 분자 기전을 표적으로 한 티로신 키나제 억제제(TKI)의 도입은 지난 20여 년간 GIST 치료 패러다임을 혁신적으로 변화시켰다. 현재까지 1차부터 3차까지의 표준 치료 전략이 확립되어 있다.가장 먼저 승인된 이마티닙(Imatinib, GleevecⓇ)은 2002년 미국 FDA에서 전이성 또는 절제불가능 GIST의 1차 치료제로 허가되었다. 원래 BCR-ABL 융합유전자를 표적으로 개발된 만성 골수성 백혈병 치료제로, KIT, PDGFRA, ABL 등 여러 키나제의 ATP 결합 부위를 경쟁적으로 억제한다. 이러한 기전을 바탕으로 전체 GIST 환자의 약 80%에서 우수한 초기 반응을, 약 85%에서 질병 조절 효과를 나타낸다.특히 KIT 엑손 11 변이에서 반응률이 가장 높으나, KIT 엑손 9 변이나 무변이(wild-type) 환자에서는 효과가 다소 감소한다. 반면 PDGFRA D842V 변이는 이마티닙에 대한 고도 내성을 보이므로, 치료 전략 수립 시 KIT/PDGFRA 유전자 분석은 필수적이다.이마티닙은 탁월한 초기 효과에도 불구하고, 장기 치료 과정에서 KIT에 다양한 2차 돌연변이가 축적되면서 내성이 발생할 수 있다. 이에 따라 이마티닙 실패 후 사용할 2차 치료제로 수니티닙(Sunitinib, SutentⓇ)이 2006년 미국 FDA의 승인을 받았다.수니티닙은 KIT과 PDGFRA 외에도 VEGFR-1/2, FLT3, RET 등 여러 티로신 키나제를 억제하는 다중표적 TKI로, 이마티닙 내성 환자에서 새로운 치료 기전을 제공한다. 임상시험에서 무진행 생존기간(PFS)을 1.5개월에서 6.3개월로 유의하게 연장시키고 전체 생존율도 개선한 바 있다. 다만 피부 색소 변화 및 피로감 등 부작용이 흔하며, 돌연변이 이질성에 따라 반응 정도가 다르게 나타날 수 있다.레고라페닙(Regorafenib, StivargaⓇ)은 2013년 이마티닙과 수니티닙 모두 실패한 환자를 위한 3차 치료제로 FDA 승인을 받았다. 경구 다중표적 TKI로서 KIT뿐 아니라 VEGFR-2, TIE2, PDGFRβ, FGFR, RET, RAF 계열 등을 억제한다.이로써 종양 성장에 관여하는 여러 신호전달 축을 동시에 차단할 수 있으며, 대표적인 이상반응으로 손발 피부 반응과 고혈압이 보고된다. 임상 2상에서 진행성 GIST 환자에서 중앙 PFS 10개월, 부분 반응률 12%, 안정병변 비율 66.7%를 보이며 3차 치료제로서 임상적 유효성이 입증되었다.GIST에서 KIT 또는 PDGFRA 활성화는 MAPK, PI3K–AKT, STAT3 등 다양한 하위 신호전달 경로를 자극하여 종양의 성장과 생존을 촉진한다. 이마티닙, 수니티닙, 레고라페닙은 모두 ATP 결합 부위(ATP pocket)에 경쟁적으로 결합함으로써 이러한 키나제 활성을 억제하고, 종양 진행 억제 및 생존 연장에 기여한다.Oncogenic Tyrosine Kinase Signaling and Accessory Pathways Responsible for the Pathogenesis of GISTs[출처:Oncotarget, 2017, Vol. 8, (No. 36), pp: 60589-60604]. 반면, PDGFRA exon 18 변이를 표적으로 하는 아바라티닙(Avapritinib, AyvakitⓇ)이나 다양한 KIT/PDGFRA 내성 돌연변이를 억제하는 리프리티닙(Ripretinib, QinlockⓇ)과 같은 신약들은 이미 해외에서 1차 또는 4차 치료제로 확립된 바 있음에도 불구하고 2025년 11월 현재 국내 GIST 적응증으로는 아직 허가·급여가 이뤄지지 않아 실제 임상 현장에서의 사용은 제한적이다.리프레티닙은 어떤 약제인가?리프레티닙(Ripretinib)은 이마티닙을 포함한 세 가지 이상의 티로신 키나제 억제제(TKI) 치료를 받은 성인 진행성 GIST 환자를 대상으로 2020년 5월 미국 FDA 승인을 받은 약제이다. 이 약제는 키나제의 스위치 포켓(switch pocket)과 활성화 루프(activation loop)를 동시에 조절하도록 설계된 새로운 type II switch-control kinase inhibitor로, 기존 type II 억제제의 기전을 확장한 이중 조절 구조가 특징이다.리프레티닙은 스위치 포켓에 결합해 활성화 루프의 접근을 차단함으로써 키나제가 활성형으로 전환되는 과정을 억제한다. 이러한 기전은 단순히 ATP 결합 부위를 차단하는 수준을 넘어 활성화 스위치를 직접 잠그는 방식으로, 다양한 하위 신호전달 경로를 효과적으로 억제한다.Switch Control Inhibition by Ripretinib. (A) Activated Tyrosine Kinase, (B) Inactivated Tryosine Kinase, with Ripretinib(출처: Front. Oncol. 11:672500).더불어 활성화 루프 기반의 2차 내성 돌연변이를 포함해, 기존 type I 억제제로는 표적하기 어려웠던 광범위한 KIT/PDGFRA 돌연변이를 포괄적으로 억제하도록 설계되었다. 한편 KIT exon 11 또는 PDGFRA exon 18과 같이 키나제 구조 안정성 자체를 변화시키는 특정 변이는 억제제 타입에 따라 임상 반응성이 달라질 수 있어, 치료 전략 수립 시 중요한 고려 요소가 된다.리프레티닙은 전임상 단계에서 GIST 및 비만세포증 모델에서 세포 증식 억제 및 세포사멸 유도를 통해 강력한 항종양 활성을 확인하였다. 또한 초기 TKI와 비교했을 때 야생형뿐 아니라 다양한 KIT 및 PDGFRA 돌연변이에 대해 훨씬 넓은 억제 스펙트럼을 보였으며, 특히 기존 약제에 고도의 내성을 나타내는 PDGFRA exon 18 D842V 변이에서도 우수한 억제 활성이 입증되었다.현재 전이성 또는 절제 불가능한 위장관기질종양(GIST)에 대한 국내 급여 기준은 어떠한가? GIST의 국내 치료 환경은 분자표적치료제의 도입과 건강보험 제도의 정비를 통해 점차 체계화되어 왔다. 현재 KIT(CD117) 양성이 확인된 전이성 또는 절제불가능 GIST에 대해 이마티닙이 1차 표준 치료제로 인정되고 있으며, 이는 국제 임상근거가 국내 제도에 반영된 결과이다.수술 후 보조요법(adjuvant) 영역에서도 고위험군(high-risk) GIST 환자를 대상으로 최대 3년간 이마티닙에 대해 보험급여가 적용된다. 이는 재발 위험 감소 효과에 대한 글로벌 근거를 국내 정책에 성공적으로 도입한 사례로 평가된다.1차 치료 실패 이후의 약제 선택에서도 비교적 명확한 단계적(stepwise) 급여 구조가 확립되어 있다. 즉, 이마티닙에 저항성 또는 불내약성이 발생한 경우 수니티닙을 2차 치료제로 적용하며, 두 약제 모두 실패 시 레고라페닙을 3차 치료제로 급여 인정한다.이처럼 국내 치료 알고리듬은 국제 가이드라인(NCCN, ESMO)과 대체로 일치하나, 비용-효과성 평가와 위험분담제(RSA) 도입 등을 통해 건강보험 재정의 지속가능성과 환자의 약제 접근성 간 균형을 도모했다는 점에서 국내 제도 상황이 반영된 결과라고 할 수 있다.따라서 현재 국내 GIST 보험체계는 이마티닙–수니티닙–레고라페닙으로 이어지는 3단계 TKI 기반 치료를 표준 패스웨이로 운영하고 있으며, 그 외 리프레티닙 등 신약들은 향후 허가 및 급여 여부에 따라 제한적으로 활용될 가능성이 있다.전이성 또는 절제 불가능한 위장관기질종양(GIST) 4차 치료제로서 리프레티닙의 임상적 의미는?GIST는 KIT 또는 PDGFRA 활성화 돌연변이에 의해 발생하는 대표적 분자 표적 종양으로, 이마티닙을 시작으로 수니티닙과 레고라페닙에 이르는 연속적인 티로신 키나제 억제제(TKI)가 표준 치료로 확립되어 왔다.그럼에도 불구하고 대부분의 환자에서 시간이 경과함에 따라 1차 또는 2차 치료제에 대한 내성 돌연변이가 축적되어, 결국 치료 옵션이 고갈되는 문제가 지속되고 있다.특히 KIT 엑손 13·14 및 17·18을 포함한 다양한 2차 내성 돌연변이는 기존 TKI로 충분히 억제되지 않는 경우가 많으며, 후기선 치료에서 약물학적 개입의 한계가 분명하게 드러나는 영역이었다.이러한 상황에서 리프레티닙은 키나제의 스위치 포켓과 활성화 루프를 동시에 제어하는 ‘스위치 컨트롤(switch-control)’ 이중 기전을 기반으로 개발된 새로운 type II형 TKI로, 기존 약제가 제한적으로 억제하던 광범위한 KIT 및 PDGFRA 내성 돌연변이를 포괄적으로 억제하도록 설계되었다.이 약제의 구조적 특성은 활성화 루프 기반 돌연변이를 포함한 다양한 내성 변이를 안정적으로 차단할 수 있는 분자적 기반을 제공하며, 특히 기존 약제에 고도의 내성을 보이는 PDGFRA 엑손 18 D842V 변이에서도 우수한 억제 활성을 보인다는 점에서 임상적 의미가 크다. KIT/PDGFRA 억제제의 치료적 위치이러한 기전적 우월성은 INVICTUS 임상시험에서 임상적으로 확인되었으며, 다수의 치료 실패를 경험한 환자군에서도 리프레티닙이 유의한 무진행 생존기간(PFS) 연장과 종양 성장 억제를 입증함으로써, 후기선(late-line) GIST 치료의 새로운 표준으로 자리매김이 가능하다.리프레티닙(QinlockⓇ)의 허가임상은 어떠한가?QINLOCK의 효능은 INVICTUS 연구에서 평가되었다. INVICTUS는 국제적, 다기관, 무작위배정(2:1), 이중눈가림, 위약대조 임상시험(NCT03353753)이다.대상 환자는 절제가 불가능한 국소 진행성 또는 전이성 GIST을 가지고 있으며, 이전에 이미티닙, 수니티닙, 레고라페닙 치료를 받은 환자들이었다.무작위 배정은 이전 치료 횟수(3회 vs 4회 이상)와 ECOG 수행능력 점수(0 vs 1 또는 2)에 따라 층화되었다. 환자들은 질병 진행 또는 용인할 수 없는 독성이 나타날 때까지 QINLOCK 150mg 또는 위약을 1일 1회 경구 투여받았다. 종양 반응 평가는 초기 4개월 동안은 28일마다, 그 이후에는 56일마다 시행되었다.주요 효능 평가 변수는 수정된 RECIST 1.1 기준에 따른 맹검 독립 중앙판독(BICR)의 질병 평가를 기반으로 한 무진행 생존기간(PFS)이었다. 수정된 RECIST 1.1에서는 림프절과 골 병변을 목표병변에서 제외하며, 기존 종양 내에서 새롭게 발생하는 종양 결절이 ‘명확한 진행 증거’로 간주되기 위해서는 특정 요건을 충족해야 한다.추가 효능 평가 변수로는 BICR에 의한 객관적 반응률(ORR)과 전체 생존기간(OS)이 포함되었다. 위약군으로 배정된 환자는 질병 진행 시 QINLOCK 치료로 전환이 가능했다.총 129명의 환자가 무작위 배정되었으며, 85명은 QINLOCK군, 44명은 위약군에 배정되었다. INVICTUS의 전체 분석(ITT) 집단의 환자 특성은 중앙 연령 60세(범위 29~83세)였고, 이 중 39%는 65세 이상이었다. 남성 비율은 57%였으며, 75%는 백인이었고, 92%는 ECOG 수행능력 점수가 0 또는 1이었다.이전 치료 횟수는 3회가 63%, 4회 이상이 37%였다. 위약군으로 무작위 배정된 환자의 66%는 질병 진행 후 QINLOCK으로 교차투여되었다. INVICTUS 연구의 효능 결과는 Table 6에 요약되어 있다.리프레티닙의 향후 쟁점은 무엇인가?리프레티닙은 기존 표적치료제에 모두 실패한 후기선(late-line) 위장관기질종양(GIST) 환자에게 새로운 치료적 돌파구를 제시한 약제로, 다양한 KIT 및 PDGFRA 활성화 돌연변이를 기반으로 한 GIST의 악성 생물학적 특성을 고려할 때 그 의의가 크다.진행성 GIST는 이마티닙, 수니티닙, 레고라페닙으로 이어지는 표준 치료에도 불구하고 시간이 경과함에 따라 다수의 2차 내성 돌연변이가 축적되어 약물 감수성을 잃는 경우가 흔하며, 이에 따라 치료 선택지가 급격히 협소해지는 문제가 지속되어 왔다.이러한 상황에서 스위치 포켓과 활성화 루프를 동시에 제어하는 이중 기전의 type II switch-control TKI로 설계된 리프레티닙은 기존 약제로는 충분히 억제되지 않던 활성화 루프 기반 내성 돌연변이를 포함해 KIT와 PDGFRA 돌연변이의 광범위한 스펙트럼을 효과적으로 차단하도록 고안되었다. 이를 통해 후기선 치료 영역에서 근거 기반의 생존 혜택을 제공한 최초의 약제로 평가된다.INVICTUS 연구에서 리프레티닙은 종양 크기 축소보다는 질병 진행 억제에 초점을 둔 임상 이득을 보여 위약 대비 무진행생존기간(PFS)을 유의하게 연장하였고, 독성 프로파일 또한 기존 다중표적 TKI 대비 관리가 용이해 다수의 치료 실패를 경험한 환자군에서 임상적 실용성이 높다.그럼에도 리프레티닙의 임상적 한계는 여전히 존재한다. 객관적 반응률(ORR)은 낮고 효과의 중심이 종양 축소보다는 질병 안정화에 있으며, 반응의 지속 기간 또한 제한적이어서 결국 대부분의 환자에서 새로운 내성이 발생한다. 또한 PDGFRA D842V 변이와 같은 고도 내성 아형에서는 전임상에서의 억제 가능성과 달리 실제 임상에서는 아바프리티닙 대비 효능이 제한적이다.더불어 INVICTUS 시험은 다수의 치료에 실패한 고도로 선택된 환자군을 대상으로 한 위약 대조 연구로 표본 규모가 작아, 엑손별·클론별 내성 패턴에 대한 정밀 분석 및 실제 임상 현실의 다양성을 충분히 반영하기에는 한계가 있었다.이러한 점들은 향후 연구 방향을 제시한다. 즉, 리프레티닙 내성의 구조적·분자적 기전을 규명하고, 초기선 또는 중간선 치료로의 확장 가능성을 평가하며, 병용 전략이나 돌연변이 기반 개인맞춤 치료 시퀀스 확립을 위한 연구가 필요하다.리프레티닙은 4차 치료에서 의미 있는 생존 혜택을 입증한 중요한 선택지이지만, 내성 극복 및 정밀한 치료 전략의 확립이라는 과제가 남아 있다. 이러한 개선 과정은 향후 GIST 치료 패러다임의 확장과 진화를 이끌 중요한 전환점이 될 것으로 기대된다.결국 리프레티닙은 기존 약제의 내성 장벽을 넘어 약제 선택지가 소진된 환자에게 새로운 생존 기회를 제공함으로써, GIST TKI 치료의 연속성과 확장성을 재정립한 약제로 평가된다.참고문헌 1. HAIXIANG DING1 “Clinical significance of the molecular heterogeneity of gastrointestinal stromal tumors and related research: A systematic review” ONCOLOGY REPORTS 43: 751-764, 20202. Ramon Martinez III “Avoiding or Co-Opting ATP Inhibition: Overview of Type III, IV, V, and VI Kinase Inhibitors” Next Generation Kinase Inhibitors, First Online: 15 July 2020 pp 29–59. 3. Ke Li1 “Genetic progression in gastrointestinal stromal tumors: mechanisms and molecular interventions” Oncotarget, 2017, Vol. 8, (No. 36), pp: 60589-60604.4. Sebastian Baue “Early and Next-Generation KIT/PDGFRA Kinase Inhibitors and the Future of Treatment for Advanced Gastrointestinal Stromal Tumor” Front. Oncol. 11:672500.5. Vaibhav Kumar “FDA Approval Summary: Ripretinib for advanced gastrointestinal stromal tumor (GIST)” Clin Cancer Res. 2023 June 01; 29(11): 2020–2024. 6. Koji Umezawa “Druggable Transient Pockets in Protein Kinases” Molecules 2021, 26, 651.7. Hiba Mechahougui “Precision Oncology in Gastrointestinal Stromal Tumors” Curr. Oncol. 2023, 30(5), 4648-4662.8. 기타 인터넷 자료(보도 자료, 제품 설명서 등2025-12-05 06:00:55최병철 박사
전이성·절제 불가능성 GIST, 광범위 억제제 '리프레티닙'Qinlock(킨록, 성분명: ripretinib, ONO Pharma)은 광범위 KIT/PDGFRA 억제제다. 2020년 미국 FDA와 2021년 EMA에서 최소 3종의 TKI 치료 후에도 질환이 진행한 성인 전이성 또는 절제 불가능한 위장관기질종양(Gastrointestinal Stromal Tumor, GIST)에 대한 4차 치료제로 승인됐다. 국내에서는 올해 7월 희귀의약품으로 지정됐다.위장관기질종양(GIST)은 위장관 벽의 간질조직에서 발생하는 대표적인 연부조직 육종으로, 간질성 카할세포(interstitial cells of Cajal)의 발생학적·기능적 특징을 공유하는 전구세포에서 기원하는 것으로 알려져 있다. 분자생물학적 관점에서 대부분의 GIST는 KIT 또는 PDGFRA 유전자의 활성화 돌연변이를 보유하며, 이러한 변이는 주요 신호전달 경로를 지속적으로 활성화해 세포 증식, 생존, 침윤을 촉진함으로써 종양의 발병과 진행을 주도한다.한편 GIST는 위장관 어느 부위에서도 발생할 수 있으며, 내시경으로 관찰되는 점막층이 아닌 그 아래의 점막하층이나 근육층에서 기원하기 때문에 조기 발견이 어렵다. 대부분은 양성으로 진단되지만 약 20~30%는 악성으로 진행할 수 있다. 증상은 종양이 커지거나 암세포가 점막하층 또는 근육층을 뚫고 점막을 침범할 때 시작되며, 복통이 발생하거나 경우에 따라 장폐색을 유발하기도 한다.전이성 또는 절제 불가능한 GIST의 치료 패러다임은 표적치료제(tyrosine kinase inhibitor, TKI)의 등장 이후 근본적으로 변화하였다. 2001년 도입된 이마티닙(Imatinib)은 기존 세포독성 화학요법에 반응하지 않던 GIST 환자의 생존 기간을 획기적으로 연장시키며 분자표적치료 시대를 열었다.이후 수니티닙(Sunitinib), 레고라티닙(Regorafenib), 리프레티닙(Ripretinib) 등 다양한 TKI가 연속적으로 도입되면서 치료 순차 전략이 구체화되었으나, 획득 내성(acquired resistance)은 여전히 해결되지 않은 주요 임상적 과제로 남아 있다. 이에 따라 약제 순서의 최적화, 병용치료 전략, 새로운 분자 표적의 발굴 등에 대한 연구가 활발히 진행되고 있다.킨록은 INVICTUS 임상 3상 연구를 통해 유효성을 입증하였다. 총 129명의 GIST 환자를 대상으로 한 해당 연구에서 리프레티닙 투여군의 무진행생존기간(PFS) 중앙값은 6.3개월로, 위약군의 1.0개월 대비 현저한 개선을 보였다. 또한 질병 진행 또는 사망 위험을 약 85% 감소시켜 통계적으로 유의한 치료 효과를 확인하였다.전이성 또는 절제 불가능한 위장관기질종양(Gastrointestinal stromal tumor, GIST)는 어떤 질환인가?위장관기질종양(GIST)은 소화관 벽에 위치한 특수 신경세포인 카할 간질세포(interstitial cells of Cajal, ICC)에서 기원하는 드문 중간엽성 종양(mesenchymal tumor)이다. ICC는 자율신경계의 일부로 위장관 고유근층 내에서 조율 세포(pacemaker cell) 역할을 수행하며, 위장관 연동운동을 조절하는 기능을 담당한다.GIST의 발생 부위는 위가 약 60%, 소장이 약 30%로 가장 흔하며, 드물게 결장·직장·식도에서도 발생한다. 장간막이나 대망(greater omentum) 등 위장관 외부에서도 발생할 수 있으며, 이러한 경우는 장외(extra-gastrointestinal) GIST로 분류된다.GIST는 KIT(Kinase Insert Domain-containing Receptor Tyrosine Kinase) 또는 혈소판유래성장인자수용체 알파(Platelet-Derived Growth Factor Receptor Alpha, PDGFRA) 유전자의 활성화 돌연변이에 의해 발생하는 것으로 알려져 있다. 연간 발생률은 인구 백만 명당 약 10–15건으로 추정되며, 주로 50~70대에서 진단된다.KIT(CD117) 또는 PDGFRA 돌연변이는 전체 산발성 GIST의 약 85%에서 관찰되며, 티로신 키나제 수용체의 구성적 활성화를 통해 과형성과 종양 발생을 유도한다. 대부분은 후천적(somatic) 변이지만, 드물게 이러한 돌연변이가 유전되어 가족성 GIST를 일으킬 수 있다.한편 이러한 주요 변이를 보유하지 않는 야생형(wild-type) GIST는 NF1, BRAF, HRAS 등 다양한 분자 변이를 포함하는 이질적 집단이며, 신경섬유종증 1형, Carney triad, Carney-Stratakis syndrome 등 특정 종양 증후군과 연관되기도 한다.조직병리학적으로 GIST는 방추형, 상피양 또는 혼합형 세포 형태를 보이며, 면역조직화학적으로 KIT(CD117)와 DOG1(Discovered On GIST-1) 양성이 특징적이다. 임상 증상은 비특이적이며, 모호한 복부 불편감, 위장관 출혈, 조기 포만감, 혹은 촉지 가능한 종괴 등으로 다양하게 나타날 수 있다.진단에는 조영 CT 또는 MRI, 내시경 초음파를 통한 조직 채취, 그리고 분자 진단을 위한 유전자 돌연변이 분석이 포함된다. 치료 결정 시 종양의 크기, 해부학적 위치, 유사분열지수, 분자 변이 등이 종합적으로 고려된다. 국소 질환에서는 음성 절제연(R0 resection)을 확보한 수술적 절제가 기본 치료이며, 방사선 치료는 역할이 제한적이지만 일부 진행성 질환에서 증상 완화 목적으로 사용될 수 있다.임상적으로 GIST는 초기 단계에서 외과적 절제를 통해 완치를 기대할 수 있으나, 종양의 위치·크기·주변 장기 침윤 여부에 따라 완전 절제(R0)가 불가능한 경우가 적지 않다. 또한 진단 시 이미 간 또는 복막 전이가 동반된 사례가 흔하며, 이러한 전이성 또는 절제 불가능한 GIST는 더 이상 수술 중심의 국소치료로는 관리가 어렵고, 장기적인 전신 치료를 필요로 하는 만성적·재발성 종양의 특성을 보인다. 실제로 수술이 가능하더라도 광범위 절제가 필요하거나 주요 장기 기능 손상의 위험이 높아 근치적 수술의 이점이 기대되기 어려운 경우 ‘절제 불가능(unresectable)’ 범주로 분류되며, 이는 전이성 GIST와 동일한 치료 전략을 적용해야 하는 임상적 상황으로 간주된다.이와 같은 배경에서 티로신 키나제 억제제(TKI)의 도입은 GIST 전신 치료의 패러다임을 근본적으로 변화시켰다. 이마티닙(Imatinib)은 진행성·절제 불가능·전이성 GIST의 1차 치료제로 사용되며, 환자의 생존율을 의미 있게 향상시켰다.KIT(CD117) 또는 PDGFRA 돌연변이란 무엇인가?KIT(CD117) 또는 PDGFRA 돌연변이는 위장관 기질 종양(GIST)의 발생을 유도하는 핵심 분자 이상으로, 두 유전자가 암호화하는 수용체 티로신 키나제(receptor tyrosine kinase, RTK)에 구성적 활성화(activating mutation)를 일으키는 병적 변화이다.KIT 돌연변이는 전체 GIST의 약 70–80%, PDGFRA 돌연변이는 약 10–15%에서 발견되며, 이 두 유전자의 활성화 돌연변이가 전체 GIST의 약 85–90%를 차지하는 대표적 분자 병인으로 알려져 있다.특히 KIT 엑손 11, PDGFRA 엑손 18(D842V 등)의 특정 변이는 단백질 구조적 안정성과 자가활성화 억제 기전을 교란하여 종양 발생을 직접적으로 촉진한다. 동시에 이러한 변이들은 이마티닙을 포함한 여러 티로신 키나제 억제제(tyrosine kinase inhibitor,TKI)에 대한 약물 반응성을 결정하는 중요한 예측 인자로 기능한다.정상 상태에서 KIT과 PDGFRA는 성장인자 자극에 의해 제한적으로 활성화되며, 세포의 생존·증식·분화·이동을 정교하게 조절하는 신호전달 체계의 중심적 역할을 수행한다. 그러나 활성화 돌연변이가 발생하면 리간드 결합과 무관하게 수용체가 지속적으로 활성화되어, RAS–RAF–MAPK, PI3K–AKT, STAT 등 하위 신호 경로를 과도하게 자극함으로써 비조절적 세포 증식과 항아폽토시스 신호가 강화되고, 결국 종양 형성이 촉진된다.또한 KIT 엑손 9, 11, 13·14, 17·18 및 PDGFRA 엑손 18 돌연변이 등은 단백질의 활성화 루프와 구조적 균형을 변화시켜 수용체가 비활성 상태로 유지되지 못하고 지속적으로 ‘on’ 상태를 유지하게 만드는 중요한 분자적 기전을 제공한다.Structure of KIT and PDGFRA Receptors(출처: ONCOLOGY REPORTS 43: 751-764, 2020). 이처럼 KIT 또는 PDGFRA 돌연변이는 GIST 발생을 유도하는 근본 병인일 뿐 아니라, 돌연변이의 위치와 종류에 따라 약물 감수성과 내성 패턴이 뚜렷하게 달라지므로 임상적 치료 전략 전반을 좌우한다. 실제로 이마티닙을 비롯한 TKI의 반응성은 돌연변이 유형에 따라 큰 차이를 보이며, 일부 변이는 매우 좋은 초기 반응을 보이지만, 다른 변이는 고도의 내성을 나타낸다.티로신키나제 억제제(Tyrosine kinase inhibitor, TKI)의 작동 원리는?티로신 키나제는 세포 외부의 신호를 세포 내부로 전달하는 핵심 효소로, 활성화 여부에 따라 다양한 성장·분화 경로가 조절된다. 이 효소는 두 개의 판이 맞물린 형태를 이루는 상·하부 로브(N-lobe, C-lobe)를 기본 골격으로 하며, 두 로브 사이의 좁은 틈은 ATP가 결합하는 중심 자리를 형성한다. ATP가 이 틈에 정확히 결합하면 인산전달 반응이 활성화되고, 이러한 구조적 배치가 유지될 때 정상적인 신호전달이 지속된다.티로신 키나제의 활성 상태는 두 가지 주요 구조 스위치에 의해 정의된다. 첫 번째는 DFG(Aspartate–Phenylalanine–Glycine)라 불리는 스위치로, 이 잔기가 안쪽을 향하면 활성형(DFG-in), 바깥으로 뒤집히면 비활성형(DFG-out)을 형성한다. 두 번째는 αC-helix로, 이 구조가 안쪽으로 향하면 활성 배치를, 바깥으로 이동하면 비활성 배치를 이룬다. 두 스위치는 독립적으로 움직이지만, 어느 하나라도 비활성 방향으로 전환되면 전체 효소는 효과적으로 ‘잠긴’ 형태가 된다.ATP 결합 틈은 전면부와 후면부로 나눌 수 있다. 앞쪽 공간은 ATP가 결합하는 전통적인 자리로, 대부분의 억제제가 공유하는 결합 부위이다. 반면 뒤쪽 공간(back pocket)은 DFG가 바깥으로 뒤집힌 비활성 상태에서만 열리는 특수한 포켓으로, 억제제의 결합 방식 차이를 결정하는 중요한 구조적 요소이다.Type I 억제제는 활성형(DFG-in)의 ATP 앞자리만을 점유해 ATP 접근을 차단한다. 엘로티닙(Erlotinib), 게페티닙(Gefitinib), 크리조티닙(Crizotinib), 라파티닙(Lapatinib) 등이 대표적이며, 활성 상태의 키나제에 결합하기 때문에 활성형 구조에 크게 의존한다.Type II 억제제는 ATP 앞자리뿐 아니라 DFG-out 상태에서 형성되는 뒤쪽 공간까지 함께 점유한다. 이러한 결합 방식은 비활성형을 안정적으로 고정시키며, 상대적으로 길고 굴곡진 분자 구조를 가진다. 이마티닙(Imatinib), 수니티닙(Sunitinib), 레고라티닙(Regorafenib), 리프레티닙(Ripretinib) 등이 대표적이다.이 중 Ripretinib은 Type II 기전을 확장한 switch-control 억제제로, back pocket뿐 아니라 DFG 모티프와 αC-helix까지 동시에 고정한다. 이 기전은 ATP 경쟁 억제 수준을 넘어 키나제의 활성화 스위치 자체를 잠그는 방식으로, 다양한 돌연변이에 대해 보다 일관된 억제 효과를 보인다.이처럼 티로신 키나제 억제제는 ATP 결합 틈의 어느 부분을, 어떤 구조 상태에서 차단하는지에 따라 Type I, Type II, switch-control 계열로 구분된다. 이러한 구조-기전적 이해는 돌연변이에 의해 발생하는 내성 패턴을 설명하며, 새로운 약물 설계의 근거가 된다.최근에는 ATP-pocket 자체와 경쟁하지 않는 알로스테릭 기반 억제제가 개발되면서 억제제 분류는 더욱 확장되고 있다.Type III 억제제는 ATP-pocket 인접의 알로스테릭(allosteric) 포켓에 결합해 ATP와 비경쟁적으로 작용하며, 트라메티닙(Trametinib)과 코비멭닙(Cobimetinib)이 대표적이다.Type IV 억제제는 ATP 결합부와 물리적으로 떨어진 원거리 알로스테릭 포켓에 결합하며, BCR-ABL의 myristoyl 포켓을 표적하는 아시미닙(Asciminib)이 대표적이다. 이러한 원거리 결합 방식은 ATP-pocket 돌연변이에 거의 영향을 받지 않아 높은 선택성을 확보한다.Type V 억제제는 두 개 이상의 독립된 결합 부위를 동시에 점유하는 bivalent inhibitor로, ATP-pocket과 별도의 알로스테릭 포켓을 동시에 결합해 구조를 강하게 고정한다. 주로 RAF나 CDK 계열을 중심으로 전임상 연구가 진행되고 있다.마지막으로 Type VI 억제제는 특정 아미노산(주로 Cys)에 공유 결합을 형성하는 비가역 억제제로, 오시메티닙(Osimertinib), 아파티닙(Afatinib), 이부루티닙(Ibrutinib) 등이 대표적이다. 비가역적 특성으로 인해 강력한 결합 안정성과 돌연변이 선택성을 확보할 수 있으며, 기존 competitive TKI의 내성 문제를 보완하는 중요한 전략으로 자리잡았다.결국 Type I에서 Type VI에 이르는 분류는 티로신 키나제가 갖는 구조적 유연성과 활성 조절 메커니즘을 다양한 수준에서 겨냥하는 전략적 도구이다. ATP-pocket의 활성·비활성 상태를 이용하는 고전적 억제제부터 구조 스위치를 직접 제어하는 switch-control 계열, 그리고 알로스테릭·이중 결합·공유 결합 방식의 차세대 억제제까지 설계 전략이 확장되면서, 내성 극복과 선택성 향상 측면 모두에서 의미 있는 진전이 이루어지고 있다.Various Type Kinase Inhibitors(출처: Next Generation Kinase Inhibitors 15 July 2020 pp 29–59). 특히 KIT과 PDGFRA가 종양의 성장에 직접 관여하는 GIST와 같은 질환에서는 이러한 구조적 통찰이 치료 기전 이해뿐 아니라 전략적 약물 선택과 신약 개발의 핵심 기반이 된다.KIT/PDGFRA 억제제에는 어떤 약제가 있는가?KIT와 PDGFRA의 돌연변이는 GIST의 발생과 진행에 핵심적인 역할을 하며, 이러한 분자 기전을 표적으로 한 티로신 키나제 억제제(TKI)의 도입은 지난 20여 년간 GIST 치료 패러다임을 혁신적으로 변화시켰다. 현재까지 1차부터 3차까지의 표준 치료 전략이 확립되어 있다.가장 먼저 승인된 이마티닙(Imatinib, GleevecⓇ)은 2002년 미국 FDA에서 전이성 또는 절제불가능 GIST의 1차 치료제로 허가되었다. 원래 BCR-ABL 융합유전자를 표적으로 개발된 만성 골수성 백혈병 치료제로, KIT, PDGFRA, ABL 등 여러 키나제의 ATP 결합 부위를 경쟁적으로 억제한다. 이러한 기전을 바탕으로 전체 GIST 환자의 약 80%에서 우수한 초기 반응을, 약 85%에서 질병 조절 효과를 나타낸다.특히 KIT 엑손 11 변이에서 반응률이 가장 높으나, KIT 엑손 9 변이나 무변이(wild-type) 환자에서는 효과가 다소 감소한다. 반면 PDGFRA D842V 변이는 이마티닙에 대한 고도 내성을 보이므로, 치료 전략 수립 시 KIT/PDGFRA 유전자 분석은 필수적이다.이마티닙은 탁월한 초기 효과에도 불구하고, 장기 치료 과정에서 KIT에 다양한 2차 돌연변이가 축적되면서 내성이 발생할 수 있다. 이에 따라 이마티닙 실패 후 사용할 2차 치료제로 수니티닙(Sunitinib, SutentⓇ)이 2006년 미국 FDA의 승인을 받았다.수니티닙은 KIT과 PDGFRA 외에도 VEGFR-1/2, FLT3, RET 등 여러 티로신 키나제를 억제하는 다중표적 TKI로, 이마티닙 내성 환자에서 새로운 치료 기전을 제공한다. 임상시험에서 무진행 생존기간(PFS)을 1.5개월에서 6.3개월로 유의하게 연장시키고 전체 생존율도 개선한 바 있다. 다만 피부 색소 변화 및 피로감 등 부작용이 흔하며, 돌연변이 이질성에 따라 반응 정도가 다르게 나타날 수 있다.레고라페닙(Regorafenib, StivargaⓇ)은 2013년 이마티닙과 수니티닙 모두 실패한 환자를 위한 3차 치료제로 FDA 승인을 받았다. 경구 다중표적 TKI로서 KIT뿐 아니라 VEGFR-2, TIE2, PDGFRβ, FGFR, RET, RAF 계열 등을 억제한다.이로써 종양 성장에 관여하는 여러 신호전달 축을 동시에 차단할 수 있으며, 대표적인 이상반응으로 손발 피부 반응과 고혈압이 보고된다. 임상 2상에서 진행성 GIST 환자에서 중앙 PFS 10개월, 부분 반응률 12%, 안정병변 비율 66.7%를 보이며 3차 치료제로서 임상적 유효성이 입증되었다.GIST에서 KIT 또는 PDGFRA 활성화는 MAPK, PI3K–AKT, STAT3 등 다양한 하위 신호전달 경로를 자극하여 종양의 성장과 생존을 촉진한다. 이마티닙, 수니티닙, 레고라페닙은 모두 ATP 결합 부위(ATP pocket)에 경쟁적으로 결합함으로써 이러한 키나제 활성을 억제하고, 종양 진행 억제 및 생존 연장에 기여한다.Oncogenic Tyrosine Kinase Signaling and Accessory Pathways Responsible for the Pathogenesis of GISTs[출처:Oncotarget, 2017, Vol. 8, (No. 36), pp: 60589-60604]. 반면, PDGFRA exon 18 변이를 표적으로 하는 아바라티닙(Avapritinib, AyvakitⓇ)이나 다양한 KIT/PDGFRA 내성 돌연변이를 억제하는 리프리티닙(Ripretinib, QinlockⓇ)과 같은 신약들은 이미 해외에서 1차 또는 4차 치료제로 확립된 바 있음에도 불구하고 2025년 11월 현재 국내 GIST 적응증으로는 아직 허가·급여가 이뤄지지 않아 실제 임상 현장에서의 사용은 제한적이다.리프레티닙은 어떤 약제인가?리프레티닙(Ripretinib)은 이마티닙을 포함한 세 가지 이상의 티로신 키나제 억제제(TKI) 치료를 받은 성인 진행성 GIST 환자를 대상으로 2020년 5월 미국 FDA 승인을 받은 약제이다. 이 약제는 키나제의 스위치 포켓(switch pocket)과 활성화 루프(activation loop)를 동시에 조절하도록 설계된 새로운 type II switch-control kinase inhibitor로, 기존 type II 억제제의 기전을 확장한 이중 조절 구조가 특징이다.리프레티닙은 스위치 포켓에 결합해 활성화 루프의 접근을 차단함으로써 키나제가 활성형으로 전환되는 과정을 억제한다. 이러한 기전은 단순히 ATP 결합 부위를 차단하는 수준을 넘어 활성화 스위치를 직접 잠그는 방식으로, 다양한 하위 신호전달 경로를 효과적으로 억제한다.Switch Control Inhibition by Ripretinib. (A) Activated Tyrosine Kinase, (B) Inactivated Tryosine Kinase, with Ripretinib(출처: Front. Oncol. 11:672500).더불어 활성화 루프 기반의 2차 내성 돌연변이를 포함해, 기존 type I 억제제로는 표적하기 어려웠던 광범위한 KIT/PDGFRA 돌연변이를 포괄적으로 억제하도록 설계되었다. 한편 KIT exon 11 또는 PDGFRA exon 18과 같이 키나제 구조 안정성 자체를 변화시키는 특정 변이는 억제제 타입에 따라 임상 반응성이 달라질 수 있어, 치료 전략 수립 시 중요한 고려 요소가 된다.리프레티닙은 전임상 단계에서 GIST 및 비만세포증 모델에서 세포 증식 억제 및 세포사멸 유도를 통해 강력한 항종양 활성을 확인하였다. 또한 초기 TKI와 비교했을 때 야생형뿐 아니라 다양한 KIT 및 PDGFRA 돌연변이에 대해 훨씬 넓은 억제 스펙트럼을 보였으며, 특히 기존 약제에 고도의 내성을 나타내는 PDGFRA exon 18 D842V 변이에서도 우수한 억제 활성이 입증되었다.현재 전이성 또는 절제 불가능한 위장관기질종양(GIST)에 대한 국내 급여 기준은 어떠한가? GIST의 국내 치료 환경은 분자표적치료제의 도입과 건강보험 제도의 정비를 통해 점차 체계화되어 왔다. 현재 KIT(CD117) 양성이 확인된 전이성 또는 절제불가능 GIST에 대해 이마티닙이 1차 표준 치료제로 인정되고 있으며, 이는 국제 임상근거가 국내 제도에 반영된 결과이다.수술 후 보조요법(adjuvant) 영역에서도 고위험군(high-risk) GIST 환자를 대상으로 최대 3년간 이마티닙에 대해 보험급여가 적용된다. 이는 재발 위험 감소 효과에 대한 글로벌 근거를 국내 정책에 성공적으로 도입한 사례로 평가된다.1차 치료 실패 이후의 약제 선택에서도 비교적 명확한 단계적(stepwise) 급여 구조가 확립되어 있다. 즉, 이마티닙에 저항성 또는 불내약성이 발생한 경우 수니티닙을 2차 치료제로 적용하며, 두 약제 모두 실패 시 레고라페닙을 3차 치료제로 급여 인정한다.이처럼 국내 치료 알고리듬은 국제 가이드라인(NCCN, ESMO)과 대체로 일치하나, 비용-효과성 평가와 위험분담제(RSA) 도입 등을 통해 건강보험 재정의 지속가능성과 환자의 약제 접근성 간 균형을 도모했다는 점에서 국내 제도 상황이 반영된 결과라고 할 수 있다.따라서 현재 국내 GIST 보험체계는 이마티닙–수니티닙–레고라페닙으로 이어지는 3단계 TKI 기반 치료를 표준 패스웨이로 운영하고 있으며, 그 외 리프레티닙 등 신약들은 향후 허가 및 급여 여부에 따라 제한적으로 활용될 가능성이 있다.전이성 또는 절제 불가능한 위장관기질종양(GIST) 4차 치료제로서 리프레티닙의 임상적 의미는?GIST는 KIT 또는 PDGFRA 활성화 돌연변이에 의해 발생하는 대표적 분자 표적 종양으로, 이마티닙을 시작으로 수니티닙과 레고라페닙에 이르는 연속적인 티로신 키나제 억제제(TKI)가 표준 치료로 확립되어 왔다.그럼에도 불구하고 대부분의 환자에서 시간이 경과함에 따라 1차 또는 2차 치료제에 대한 내성 돌연변이가 축적되어, 결국 치료 옵션이 고갈되는 문제가 지속되고 있다.특히 KIT 엑손 13·14 및 17·18을 포함한 다양한 2차 내성 돌연변이는 기존 TKI로 충분히 억제되지 않는 경우가 많으며, 후기선 치료에서 약물학적 개입의 한계가 분명하게 드러나는 영역이었다.이러한 상황에서 리프레티닙은 키나제의 스위치 포켓과 활성화 루프를 동시에 제어하는 ‘스위치 컨트롤(switch-control)’ 이중 기전을 기반으로 개발된 새로운 type II형 TKI로, 기존 약제가 제한적으로 억제하던 광범위한 KIT 및 PDGFRA 내성 돌연변이를 포괄적으로 억제하도록 설계되었다.이 약제의 구조적 특성은 활성화 루프 기반 돌연변이를 포함한 다양한 내성 변이를 안정적으로 차단할 수 있는 분자적 기반을 제공하며, 특히 기존 약제에 고도의 내성을 보이는 PDGFRA 엑손 18 D842V 변이에서도 우수한 억제 활성을 보인다는 점에서 임상적 의미가 크다. KIT/PDGFRA 억제제의 치료적 위치이러한 기전적 우월성은 INVICTUS 임상시험에서 임상적으로 확인되었으며, 다수의 치료 실패를 경험한 환자군에서도 리프레티닙이 유의한 무진행 생존기간(PFS) 연장과 종양 성장 억제를 입증함으로써, 후기선(late-line) GIST 치료의 새로운 표준으로 자리매김이 가능하다.리프레티닙(QinlockⓇ)의 허가임상은 어떠한가?QINLOCK의 효능은 INVICTUS 연구에서 평가되었다. INVICTUS는 국제적, 다기관, 무작위배정(2:1), 이중눈가림, 위약대조 임상시험(NCT03353753)이다.대상 환자는 절제가 불가능한 국소 진행성 또는 전이성 GIST을 가지고 있으며, 이전에 이미티닙, 수니티닙, 레고라페닙 치료를 받은 환자들이었다.무작위 배정은 이전 치료 횟수(3회 vs 4회 이상)와 ECOG 수행능력 점수(0 vs 1 또는 2)에 따라 층화되었다. 환자들은 질병 진행 또는 용인할 수 없는 독성이 나타날 때까지 QINLOCK 150mg 또는 위약을 1일 1회 경구 투여받았다. 종양 반응 평가는 초기 4개월 동안은 28일마다, 그 이후에는 56일마다 시행되었다.주요 효능 평가 변수는 수정된 RECIST 1.1 기준에 따른 맹검 독립 중앙판독(BICR)의 질병 평가를 기반으로 한 무진행 생존기간(PFS)이었다. 수정된 RECIST 1.1에서는 림프절과 골 병변을 목표병변에서 제외하며, 기존 종양 내에서 새롭게 발생하는 종양 결절이 ‘명확한 진행 증거’로 간주되기 위해서는 특정 요건을 충족해야 한다.추가 효능 평가 변수로는 BICR에 의한 객관적 반응률(ORR)과 전체 생존기간(OS)이 포함되었다. 위약군으로 배정된 환자는 질병 진행 시 QINLOCK 치료로 전환이 가능했다.총 129명의 환자가 무작위 배정되었으며, 85명은 QINLOCK군, 44명은 위약군에 배정되었다. INVICTUS의 전체 분석(ITT) 집단의 환자 특성은 중앙 연령 60세(범위 29~83세)였고, 이 중 39%는 65세 이상이었다. 남성 비율은 57%였으며, 75%는 백인이었고, 92%는 ECOG 수행능력 점수가 0 또는 1이었다.이전 치료 횟수는 3회가 63%, 4회 이상이 37%였다. 위약군으로 무작위 배정된 환자의 66%는 질병 진행 후 QINLOCK으로 교차투여되었다. INVICTUS 연구의 효능 결과는 Table 6에 요약되어 있다.리프레티닙의 향후 쟁점은 무엇인가?리프레티닙은 기존 표적치료제에 모두 실패한 후기선(late-line) 위장관기질종양(GIST) 환자에게 새로운 치료적 돌파구를 제시한 약제로, 다양한 KIT 및 PDGFRA 활성화 돌연변이를 기반으로 한 GIST의 악성 생물학적 특성을 고려할 때 그 의의가 크다.진행성 GIST는 이마티닙, 수니티닙, 레고라페닙으로 이어지는 표준 치료에도 불구하고 시간이 경과함에 따라 다수의 2차 내성 돌연변이가 축적되어 약물 감수성을 잃는 경우가 흔하며, 이에 따라 치료 선택지가 급격히 협소해지는 문제가 지속되어 왔다.이러한 상황에서 스위치 포켓과 활성화 루프를 동시에 제어하는 이중 기전의 type II switch-control TKI로 설계된 리프레티닙은 기존 약제로는 충분히 억제되지 않던 활성화 루프 기반 내성 돌연변이를 포함해 KIT와 PDGFRA 돌연변이의 광범위한 스펙트럼을 효과적으로 차단하도록 고안되었다. 이를 통해 후기선 치료 영역에서 근거 기반의 생존 혜택을 제공한 최초의 약제로 평가된다.INVICTUS 연구에서 리프레티닙은 종양 크기 축소보다는 질병 진행 억제에 초점을 둔 임상 이득을 보여 위약 대비 무진행생존기간(PFS)을 유의하게 연장하였고, 독성 프로파일 또한 기존 다중표적 TKI 대비 관리가 용이해 다수의 치료 실패를 경험한 환자군에서 임상적 실용성이 높다.그럼에도 리프레티닙의 임상적 한계는 여전히 존재한다. 객관적 반응률(ORR)은 낮고 효과의 중심이 종양 축소보다는 질병 안정화에 있으며, 반응의 지속 기간 또한 제한적이어서 결국 대부분의 환자에서 새로운 내성이 발생한다. 또한 PDGFRA D842V 변이와 같은 고도 내성 아형에서는 전임상에서의 억제 가능성과 달리 실제 임상에서는 아바프리티닙 대비 효능이 제한적이다.더불어 INVICTUS 시험은 다수의 치료에 실패한 고도로 선택된 환자군을 대상으로 한 위약 대조 연구로 표본 규모가 작아, 엑손별·클론별 내성 패턴에 대한 정밀 분석 및 실제 임상 현실의 다양성을 충분히 반영하기에는 한계가 있었다.이러한 점들은 향후 연구 방향을 제시한다. 즉, 리프레티닙 내성의 구조적·분자적 기전을 규명하고, 초기선 또는 중간선 치료로의 확장 가능성을 평가하며, 병용 전략이나 돌연변이 기반 개인맞춤 치료 시퀀스 확립을 위한 연구가 필요하다.리프레티닙은 4차 치료에서 의미 있는 생존 혜택을 입증한 중요한 선택지이지만, 내성 극복 및 정밀한 치료 전략의 확립이라는 과제가 남아 있다. 이러한 개선 과정은 향후 GIST 치료 패러다임의 확장과 진화를 이끌 중요한 전환점이 될 것으로 기대된다.결국 리프레티닙은 기존 약제의 내성 장벽을 넘어 약제 선택지가 소진된 환자에게 새로운 생존 기회를 제공함으로써, GIST TKI 치료의 연속성과 확장성을 재정립한 약제로 평가된다.참고문헌 1. HAIXIANG DING1 “Clinical significance of the molecular heterogeneity of gastrointestinal stromal tumors and related research: A systematic review” ONCOLOGY REPORTS 43: 751-764, 20202. Ramon Martinez III “Avoiding or Co-Opting ATP Inhibition: Overview of Type III, IV, V, and VI Kinase Inhibitors” Next Generation Kinase Inhibitors, First Online: 15 July 2020 pp 29–59. 3. Ke Li1 “Genetic progression in gastrointestinal stromal tumors: mechanisms and molecular interventions” Oncotarget, 2017, Vol. 8, (No. 36), pp: 60589-60604.4. Sebastian Baue “Early and Next-Generation KIT/PDGFRA Kinase Inhibitors and the Future of Treatment for Advanced Gastrointestinal Stromal Tumor” Front. Oncol. 11:672500.5. Vaibhav Kumar “FDA Approval Summary: Ripretinib for advanced gastrointestinal stromal tumor (GIST)” Clin Cancer Res. 2023 June 01; 29(11): 2020–2024. 6. Koji Umezawa “Druggable Transient Pockets in Protein Kinases” Molecules 2021, 26, 651.7. Hiba Mechahougui “Precision Oncology in Gastrointestinal Stromal Tumors” Curr. Oncol. 2023, 30(5), 4648-4662.8. 기타 인터넷 자료(보도 자료, 제품 설명서 등2025-12-05 06:00:55최병철 박사 -
 방광암 면역치료 최초 IL-15 초작용제 '안크티바'안크티바(Anktiva®, 성분명: 노가펜데킨 알파 인바키셉트-pmln, nogapendekin alfa inbakicept-pmln, ImmunityBio)는 IL-15 초작용제(superagonist) 복합체로 개발된 최초의 방광 내 면역치료제다.2024년 4월 미국 FDA에서 유두종 유무와 관계없이 상피내암(CIS)을 동반한 BCG-불응성 비근육침윤성 방광암(non-muscle invasive bladder cancer, NMIBC) 성인 환자를 대상으로 BCG와 병용 사용하는 치료제로 승인됐다.방광암은 전 세계적으로 흔한 악성 종양 중 하나다. 국내에서도 발생 빈도가 높은 암종으로 알려져 있다. 이 중 약 75%는 비근육침윤성 방광암(NMIBC)으로 분류되며, 초기 치료는 대개 경요도 방광 종양 절제술(transurethral resection of bladder tumor, TURBT)로 시작된다.그러나 NMIBC는 60& 8211;70%의 재발률을 보이므로, TURBT 이후 방광 내 치료(intravesical therapy)가 질병의 재발을 억제하고 진행을 지연시키는 데 핵심적인 역할을 한다.현재 방광 내 치료는 크게 두 가지로 구분되며, 하나는 BCG 요법을 기반으로 하는 면역치료, 다른 하나는 미토마이신 C, 젬시타빈, 에피루비신, 독소루비신 등으로 구성되는 화학요법이다.BCG는 NMIBC의 표준 치료 중 하나이지만, 약 40%의 환자에서는 충분한 치료 효과를 보이지 못한다. 안크티바는 이러한 BCG-불응성 환자에서 방광 절제술을 피할 수 있는 새로운 치료 대안으로 개발됐다.IL-15는 NK 세포와 CD8& 8314; T 세포의 활성, 증식, 기억 형성에 관여하는 중요한 사이토카인이다. 안크티바는 IL-15 변형체와 IL-15Rα의 sushi(반복 단백질 구조) domain이 결합한 IL-15 초작용제(superagonist) 복합체를 통해 NK 세포, CD4& 8314; T 세포, CD8& 8314; T 세포의 활성을 강력하게 유도하며, 특히 종양 특이적 기억 T 세포 반응을 증폭시켜 항종양 면역반응을 강화한다.임상시험에서 BCG 유지요법과 함께 안크티바를 투여받은 77명의 환자 중 62%(95% CI, 51& 8211;73)가 완전관해에 도달했다. 이 반응은 일부 환자에서 최대 47개월까지 지속됐다. 완전관해가 12개월 이상 유지된 비율은 58%, 24개월 이상 유지된 비율은 40%였다.치료 스케줄은 방광 내 카테터를 통한 유도요법(6주간 주 1회) 후, 4, 7, 10, 13, 19개월째의 유지요법(각 3주간 주 1회)으로 구성된다. 3개월 시점에 완전 반응이 확인되지 않으면 두 번째 유도요법을 시행할 수 있으며, 25개월 이후에도 완전 반응이 지속되는 경우에는 25, 31, 37개월째에 추가 BCG 유지투여를 실시할 수 있다. 투여 시 약물 혼합액은 방광 내에 2시간 동안 유지한 뒤 배출한다.안크티바 치료에는 몇 가지 중요한 주의사항이 있다. 방광절제술을 지연함으로써 전이성 방광암으로 진행할 위험이 존재하며, 배아& 8211;태아 독성 가능성이 보고되어 가임기 여성은 치료 중과 마지막 투여 후 최소 1주일 동안 피임이 필요하다.흔하게 보고되는 이상반응으로는 배뇨곤란, 혈뇨, 빈뇨, 절박뇨, 요로감염, 근골격계 통증, 발열 및 오한 등이 있으며, 실험실 검사에서는 크레아티닌 상승과 칼륨 상승이 비교적 흔하게 관찰된다.방광암(Bladder Cancer)이란 무엇인가?방광암은 요로계에서 가장 흔히 발생하는 악성 종양 중 하나로, 소변을 저장하는 장기인 방광의 점막 상피세포에서 주로 기원한다.전 세계적으로 방광암은 발생률과 사망률 측면에서 중요한 건강 문제를 야기하고 있으며, 특히 남성에서 높은 발생 빈도를 보인다. 방광암의 발생에는 흡연이 가장 강력한 위험 요인으로 작용하는 것으로 알려져 있다. 이 외에도 직업적 발암물질 노출, 만성 요로 감염 및 요로 결석 등이 발병과 연관돼 있다.조직학적으로 방광암의 대다수는 요로상피암(urothelial carcinoma)으로, 전체 방광암의 약 90%를 차지한다. 요로상피암은 방광뿐 아니라 요관, 신우, 요도 등 요로 전반에 걸쳐 발생할 수 있는 특성을 지니고 있다.이 외에도 만성 자극이나 염증과 관련된 편평세포암(squamous cell carcinoma), 드물게 선종 양상의 조직학적 특징을 보이는 선암(adenocarcinoma), 그리고 고도로 공격적인 생물학적 특성을 나타내는 소세포암(small cell carcinoma) 등 다양한 형태가 존재한다. 이러한 조직형의 차이는 임상적 경과, 치료 전략 및 예후와 밀접하게 연관되어 있어 진단 시 정확한 병리학적 분류가 필수적이다.방광암의 병기 결정은 치료 방침 수립과 예후 평가에 있어 핵심적인 요소이다. 국제적으로 널리 사용되는 TNM 병기 체계는 종양의 침윤 정도(T), 국소 림프절 전이 여부(N), 및 원격 전이 여부(M)에 기반하여 병기를 구분한다.특히 방광벽의 근육층 침윤 여부는 임상적 의사결정에서 매우 중요한 기준으로 작용한다. 종양이 점막층에 국한된 Ta 병기, 상피 내에서 편평하게 확산되는 상피내암(carcinoma in situ, CIS), 그리고 점막하층을 침범하나 근육층에는 도달하지 않은 T1 병기는 비근침윤성 방광암(non& 8211;muscle invasive bladder cancer, NMIBC)으로 분류된다.반면, 종양이 방광 근육층을 침범하는 T2 병기부터는 근침윤성 방광암(muscle invasive bladder cancer, MIBC)으로 정의되며, 이후 주변 지방조직(T3) 및 인접 장기(T4)로의 침윤 여부에 따라 병기가 상승한다. 림프절 전이(N1& 8211;N3)와 원격 전이(M1)의 존재는 질병의 진행을 시사하며 전신적 치료 전략이 요구된다.Non& 8211;Muscle Invasive Bladder Cancer(NMIBC) and Muscle Invasive Bladder Cancer(출처: https://cgoncology.com/science/).이와 같이 방광암은 조직학적 이질성과 침윤 정도에 따른 이분화된 임상 양상을 보이며, 병기 및 조직형은 환자의 치료 선택과 예후에 결정적인 영향을 미친다.비근침윤성 방광암(Non& 8211;muscle invasive bladder cancer, NMIBC)은 무엇인가?비근육 침습성 방광암(NMIBC)은 새로 진단되는 방광암의 약 75%를 차지하며, 병변이 주로 요로상피의 표층(Ta), 점막하층(T1) 또는 상피내암(CIS)에 국한되는 질환이다.NMIBC는 즉각적으로 생명을 위협하는 경우는 드물지만, 높은 재발률과 적지 않은 진행 위험으로 인해 임상적으로 중요한 도전 과제로 여겨진다. 실제로 환자의 약 50~70%가 초기 치료 이후 재발을 경험하며, 최대 30%는 근육 침습성 또는 전이성 방광암으로 진행한다.수십 년 동안 고위험군 NMIBC 환자에서 경요도 방광 종양 절제술(transurethral resection of bladder tumor, TURBT) 후 시행되는 BCG(Bacillus Calmette& 8211;Gu& 233;rin) 치료는 재발과 진행을 효과적으로 억제하는 표준 치료로 자리매김해 왔다.그러나 BCG 치료의 임상적 이점에도 불구하고 약 40%의 환자에서 실패가 발생하며, 이 경우 추가적인 치료 전략이 필요하다. 이러한 환자군에서 전통적으로 가장 선호된 치료는 근치적 방광절제술(radical cystectomy)이었으나, 이 수술은 상당한 이환율과 삶의 질 저하를 초래하는 고난도 치료로, 실제 임상 적용에는 한계가 적지 않다.NMIBC의 위험도 분류& 8212;저위험군, 중간위험군, 고위험군& 8212;는 종양의 병기, 등급, 크기, 다초점성, 재발력 등의 임상·병리학적 지표를 종합해 이루어지며, 특히 고위험군 환자, 그중에서도 CIS 또는 T1 병변을 가진 환자는 진행 위험이 높아 보다 적극적인 치료가 요구된다.근치적 방광절제술은 BCG 불응 NMIBC에서 높은 질병 조절 효과를 보이지만, 그 침습성과 장기적인 기능 상실로 인해 방광을 보존하면서도 충분한 종양 조절을 달성할 수 있는 새로운 치료 전략의 필요성이 크게 대두되고 있다.이에 따라 면역관문억제제, 종양용해성 바이러스(oncolytic virus) 치료, 방광내 약물전달 플랫폼, 표적 치료제 등 다양한 신기술 기반 치료법이 개발되고 있으며, 이들 접근법은 방광 기능을 유지하면서도 지속적이고 임상적으로 의미 있는 치료 효과를 달성하는 것을 목표로 한다.최근 NMIBC 치료 환경은 과거와 달리 빠르게 확장되고 있으며, 새로운 약제의 등장, 기존 약물의 새로운 적응증 또는 약물 전달 방식의 진화, 그리고 완전히 새로운 치료 플랫폼의 출현 등 혁신적 변화가 지속되고 있다.초기에는 대부분의 신약 개발이 BCG 불응성 고위험군 NMIBC 환자를 대상으로 이루어졌으나, 점차 고위험군뿐 아니라 중간위험군 환자에서도 BCG와 직접 경쟁 가능한 후보 약제가 등장하면서 치료 선택지는 더욱 다양해지고 있다.비근침윤성 방광암(NMIBC)은 어떻게 치료하고, 치료 성적은 어떠한가?비근침윤성 방광암(NMIBC)은 대부분 경요도 방광 종양 절제술(TURBT) 후 시행되는 보조요법을 통해 관리된다. 이 질환의 임상적 특징은 높은 재발률과 상대적으로 낮은 진행률로 요약된다.실제로 5년 재발률은 50~70%에 이르며, 진행률은 10~20% 수준으로 보고된다. 이러한 자연경과는 단순 TURBT만으로는 장기적인 종양 조절이 어렵다는 점을 시사하며, 보조적 방광내 치료의 중요성을 부각시킨다.TURBT 직후 시행되는 단회 방광내 항암제 주입요법은 저위험군 및 일부 중위험군에서 재발률을 유의하게 낮추는 것으로 입증됐다. 특히 mitomycin C(MMC)는 절제 후 잔존 암세포를 제거하고 세포 재부착을 방지하는 작용을 통해 초기 재발 감소 전략의 표준요법으로 자리잡았다. 그러나 MMC를 포함한 기존 화학요법은 병변의 진행 억제 효과가 제한적이어서 고위험군에서는 단독 치료만으로는 충분하지 않다.고위험군 NMIBC, 특히 고등급 Ta/T1 병변 및 상피내암(CIS)의 경우 BCG 면역요법이 여전히 가장 강력하고 일관된 치료 효과를 제공한다. BCG의 초기 완전반응률은 유두종양에서 55~65%, CIS에서 70~75%로 보고되며, 재발 억제와 진행 위험 감소를 동시에 입증한 유일한 방광내 치료법이다.그럼에도 불구하고 전체 환자의 약 30~40%는 BCG에 초기 반응을 보이지 않는다. 초기 완전반응을 얻더라도 약 절반은 결국 재발한다. 여기에 장기화된 BCG 공급 부족 문제까지 겹치면서 고위험군 외의 환자에게 BCG 사용을 제한해야 하는 현실적인 어려움도 지속되고 있다.이러한 한계를 보완하기 위해 다양한 대체 전략이 개발되고 있다. Gemcitabine, Epirubicin, MMC 등 기존 항암제의 방광내 투여는 BCG 불응성 또는 BCG 금기 환자에서 활용되고 있으며, 특히 gemcitabine& 8211;docetaxel 병용요법은 BCG 불응 환자에서 1년 완전반응률 50~60%를 보이며 salvage therapy로 임상적 관심이 높아지고 있다.최근에는 방광보존 치료 옵션이 기존 면역요법을 넘어 유전자치료 영역으로까지 확장되고 있다. Nadofaragene firadenovec(Adstiladrin& 9415;)은 IFN-α2b 유전자를 방광 점막에 전달하여 국소 면역반응을 활성화하는 비증식성 아데노바이러스 벡터 기반 치료제로, 고위험 BCG 불응성 NMIBC에서 2022년 미국 FDA 승인을 받았다. 주요 임상시험에서는 3개월 완전반응률 53%, 12개월 지속반응률 24~30%가 보고되며, BCG 불응성 환자에서 새로운 치료 기전의 확립이라는 의의를 가진다.종합하면 NMIBC 치료 전략은 위험군에 따라 크게 달라지며, 저위험군에서는 TURBT와 단회 항암제 주입만으로도 비교적 양호한 성적을 기대할 수 있다. 반면 고위험군에서는 BCG를 중심으로 한 적극적 면역치료가 필수적이며, BCG 불응성 증가와 공급 제한 문제로 인해 새로운 치료제 개발이 더욱 활발히 이루어지고 있다.Bacillus Calmette-Gu& 233;rin(BCG)는 어떤 치료 방법인가?BCG는 1990년 미국 FDA에서 승인된 비특이적 면역요법으로, 비근육침윤성 방광암(NMIBC) 치료에 널리 사용돼 왔다.BCG의 항종양 효과는 Th1 중심의 면역 반응을 유도하는 기전에 기반한다. BCG가 요로상피세포에 부착되면 IL-1, IL-6, IL-8, TNF-α 등 다양한 사이토카인과 케모카인이 분비되며, 이로 인해 면역세포들이 방광 점막으로 집중된다. 이어서 대식세포, 호중구, 수지상세포 등 항원제시세포가 활성화되고, 변화된 사이토카인 환경 속에서 미성숙 CD4+ T 세포는 Th1 또는 Th2 세포로 분화한다.이 중 Th1 반응은 IFN-γ를 포함한 사이토카인 분비를 통해 BCG 치료 효과와 밀접히 연관되며, 반대로 IL-10을 중심으로 한 Th2 반응은 BCG 실패와 관련된다. 실제로 IL-10 억제 또는 IFN-γ 증가가 Th1 우세 상태를 유도하며, 이는 BCG 매개 종양 퇴행에 필수적인 요소로 알려져 있다.이처럼 BCG는 Th1 면역 반응을 활성화함으로써 방광암이 유발하는 면역 억제 환경을 극복하는 데 효과적이지만, 환자 예후를 더 향상시키기 위해서는 보다 강력한 면역조절 능력을 가진 새로운 치료제의 개발이 필요하다.특히 BCG에 반응하지 않는 NMIBC는 예후가 불량하고 전통적으로 치료 옵션이 제한적이었다. 고위험 BCG-불응성 질환의 경우 근치적 방광 절제술이 표준 치료로 권고되지만, 모든 환자가 수술을 감내할 수 있는 것은 아니다.임상시험 기준으로 BCG의 초기 완전반응률은 유두종양에서 약 55~65%, CIS에서 70~75% 수준이다. 그러나 전체 NMIBC 환자의 약 3분의 1은 BCG에 전혀 반응하지 않으며, 초기 반응을 보인 환자의 약 절반도 결국 재발하거나 진행을 경험한다.미국 FDA는 BCG-불응성 NMIBC를 다음과 같이 정의한다: ▲ 적절한 BCG 요법 후 12개월 이내 지속성 또는 재발성 CIS, 또는 재발성 Ta/T1 질환이 있는 경우(초기 유도 6회 중 ≥5회, 유지 3회 중 ≥2회 또는 2차 유도 6회 중 ≥2회 투여 완료를 ‘적절한 요법’으로 정의), ▲ 적절한 BCG 요법 후 6개월 이내 재발한 고등급 Ta/T1 질환, ▲ 유도요법 후 첫 평가에서 고등급 T1 질환이 확인된 경우이다.Bacillus Calmette-Gu& 233;rin(BCG)-불응성은 왜 일어나는가?BCG-불응성은 단일 요인보다는 종양 미세환경, 면역반응의 왜곡, 종양세포의 생물학적 저항성이 복합적으로 작용하여 발생한다. 일부 NMIBC는 이미 강한 면역억제 환경을 형성하고 있어, BCG가 유도하는 Th1 중심 면역 반응이 충분히 활성화되지 못한다.이들 종양에서는 IL-10과 TGF-β 같은 면역억제성 사이토카인이 증가하고, Treg와 MDSC가 축적되며, 종양세포의 PD-L1 발현도 높아져 T 세포 기능이 억제된다. 이러한 환경에서는 BCG가 방출시키는 사이토카인이 존재하더라도 Th1 분화보다는 Th2 또는 억제성 면역반응이 우세해져 IFN-γ 중심의 항종양 면역이 제대로 형성되지 않는다.또한 종양세포 자체가 BCG에 대한 내성을 가지는 경우도 있다. 상피세포 표면의 BCG 부착·내재화에 필요한 integrin 등 분자의 발현이 낮거나, BCG가 유도하는 세포사멸 신호(TRAIL, Fas 등)에 저항성을 나타내는 경우가 이에 해당한다. 일부 NMIBC는 특정 유전자 변이나 생존 신호의 과활성화로 인해 BCG 면역 반응에 본질적으로 둔감하다.여기에 고령, 기저질환, 면역노화 등 환자 요인이 더해지면 APC 활성 및 T 세포 반응성이 감소해 BCG가 충분한 면역 강화 효과를 내지 못한다. 균주 간 면역원성 차이, BCG 부족으로 인한 불충분한 치료 역시 면역반응 축적을 방해해 불응 위험을 높인다.결국 BCG 불응성은 종양 미세환경의 면역억제성, Th1 면역 활성화의 실패, 종양세포의 내재적 저항성, 그리고 숙주 면역 기능 저하가 상호 작용하여 나타나는 복합적 면역치료 실패 현상으로 이해된다. 이러한 이유로 BCG 불응성 NMIBC에서는 보다 강력한 면역조절 능력을 갖춘 새로운 치료 전략이 필요하다.인터루킨-15(IL-15)는 어떤 역할을 하는가?IL-15는 공통 γ사슬(γc) 사이토카인 패밀리에 속하는 면역 조절 인자로, 선천 면역과 적응 면역의 경계를 연결하며 항종양 면역을 강화하는 데 핵심적인 역할을 수행한다. IL-2, IL-4, IL-7, IL-9, IL-21과 함께 γc 계열을 이루는 IL-15는 특히 CD8+ T 세포와 자연살해(NK) 세포의 발달, 생존, 증식, 그리고 기능적 활성화 전반을 조절하는 중심적 사이토카인이다.Pleiotropic Effects of IL-15(출처: Cells 2023, 12, 1611).이러한 생물학적 중요성은 다양한 전임상·임상 연구에서 반복적으로 입증되어 왔으며, IL-15가 항암 면역을 유지하는 데 필수적인 조절자로 작용함을 뚜렷하게 보여준다.생리학적으로 IL-15는 IL-15 수용체 α(IL-15Rα)와 함께 이종이량체 형태로 합성된다. IL-15Rα는 자체적으로 신호 전달 기능을 갖고 있지는 않지만 IL-15에 높은 친화도로 결합하여 내질망에서 안정적인 복합체를 형성하고 이를 세포 표면까지 운반함으로써 생물학적 기능 발현을 위한 핵심적인 플랫폼을 제공한다.이 복합체는 생산 세포 표면에 제시된 뒤 인접한 수용 세포의 IL-2/IL-15Rβ와 공통 γ사슬과 결합하여 신호를 전달하는데, 이러한 ‘트랜스제시(trans-presentation)’는 IL-15 생물학을 규정하는 대표적 기전이자 IL-2와 구별되는 가장 특징적인 작동 방식이다.따라서 IL-15와 IL-15Rα는 단핵구, 대식세포, 수지상세포, 혈관내피세포, 골수 및 림프절의 기질세포 등 다양한 세포 유형에서 발현되며, 특히 수지상세포와 대식세포가 주요 생산자인 것으로 보고되었다. 이들 세포는 항원 제시뿐 아니라 IL-15 제시 기능을 통해 CD8+ T 세포와 NK 세포의 생존 신호를 제공함으로써 면역계의 항상성을 유지하는 데 기여한다.IL-15 초작용제(superagonist) 복합체는 무엇인가?최근 면역조절 치료제 개발은 기존 사이토카인 신호 경로를 선택적으로 증폭하여 항종양 면역 반응을 극대화하는 방향으로 진화하고 있으며, 그 중심에는 IL-15 경로 기반의 차세대 초작용제(superagonist) 기술이 있다.IL-15는 본래 NK 세포와 CD8& 8314; T 세포의 생존, 증식, 기억 형성에 핵심적인 사이토카인이지만, 생체 내 반감기가 짧고 수용체 결합 효율이 낮아 단독 활용에는 한계가 있었다.이러한 제약을 극복하기 위해 고안된 IL-15 초작용제 복합체는 IL-15의 생물학적 활성을 비약적으로 증폭하도록 설계된 구조적 혁신체로, 대표적인 예가 IL-15N72D 변형체와 IL-15Rα의 sushi 도메인을 융합한 노가펜데킨 알파 인바키셉트이다.IL-15N72D는 아스파라긴(N)에서 아스파트산(D)으로의 단일 아미노산 치환을 통해 수용체 친화성과 신호전달 강도를 향상시킨 기능적 변형체이며, IL-15Rα의 sushi 도메인 결합을 통해 자연적인 trans-presentation 기전을 모사하도록 설계되었다.이 두 구성요소는 IgG1 Fc 영역과 융합되어 약물의 안정성, 체내 반감기, 조직 내 지속 시간을 획기적으로 개선하며, 그 결과 NK 세포와 CD8& 8314; T 세포의 활성화 및 항종양 세포독성 반응을 장기간 유도하는 강력한 IL-15 신호 증폭체를 형성한다.이러한 기전은 기존 BCG 치료로 유도되는 국소 면역 반응을 효과적으로 증폭시키며, BCG-불응성 비근육침윤성 방광암에서 관찰되는 높은 완전관해율과 반응 지속성을 설명하는 면역학적 기반을 제공한다.결과적으로 IL-15 변형체와 IL-15Rα가 융합된 초작용제 플랫폼은 단순한 사이토카인 보충을 넘어, 정밀하게 설계된 면역 신호 조절을 통해 종양 미세환경 내에서 효과적인 항암 면역을 재활성화하려는 현대 면역항암제 개발의 중요한 패러다임을 제시한다노가펜데킨 알파 인바키셉트의 약리 기전은?노가펜데킨 알파 인바키셉트는 IL-15 돌연변이체(IL-15N72D)와 IL-15Rα를 융합한 복합체로, 자연 면역세포가 제공하는 IL-15 제시 기전을 모방한다. 이를 통해 CD8+ T 세포, NK 세포, 기억 T 세포의 증식·활성화를 강하게 유도하면서도, 면역억제성 조절 T 세포의 확장은 최소화한다.전임상 모델에서 방광 내 투여된 노가펜데킨 알파 인바키셉트는 단독 또는 BCG와 병용 시 BCG 단독보다 우수한 항종양 효과를 보였다. 또한 비융합(native) IL-15에 비해 림프조직 내 지속시간이 길고, 약동학적 안정성이 크게 향상되어 보다 강력하고 지속적인 항종양 면역반응을 유발한다.결과적으로 노가펜데킨 알파 인바키셉트는 IL-15 신호를 증폭해 킬러 T 세포 중심의 면역반응을 재가동시키는 기전적 특성을 기반으로, BCG-불응성 NMIBC에서 의미 있는 치료적 이점을 제공하는 IL-15 기반 면역증강제이다.Immune Effects of nogapendekin alfa inbakicept(출처: Cells 2023, 12, 1611).위 사진자료에 대해 설명하면, A. 노가펜데킨 알파 인바키셉트는 인간 IgG1 Fc와 융합된 IL15Rα에 결합된 돌연변이(N72D) 인간 IL-15로 구성된다. B. 노가펜데킨 알파 인바키셉트는 IL-15 수용체를 통해 순환 면역 세포에 결합한다. C. 노가펜데킨 알파 인바키셉트가 림프구에 결합하면 자연 살해(NK) 세포와 CD8+ T 세포 집단이 활성화된다되고 확장되어 고효과 CD56 dim 및 CD56 bright NK 세포와 중앙 기억 T 세포(TCM)가 확장된다. D. 비장 CD8+ T 세포 표면의 CXCR3가 상향 조절되면 종양 미세 환경(TME)으로 이동할 가능성이 높아집니다. 활성화된 NK 세포도 종양으로 이동한다. E. 활성화된 종양 침윤 CD8+ T 림프구(TIL)는 MHC 클래스 I 복합체가 제시하는 종양 관련 항원 에피토프를 인식하여 암세포를 인식한다. 활성화된 CD8+ T 세포와 NK 세포는 세포독성이 증가하여 암세포 사멸을 유도한다.CD8+ T 세포는 IFNγ 및 TNF& 9082;와 같은 Th1 사이토카인을 분비하여 염증성 TME를 촉진하고 과립구 및 단핵구 골수유래 억제 세포(MDSC)의 PD-L1을 상향 조절합니다. 노가펜데킨 알파 인바키셉트는 NK TIL이 TGF-β의 영향에 저항성을 갖도록 하고 항체 의존성 세포독성(ADCC)을 증가시킬 수 있도록 한다.노가펜데킨 알파 인바키셉트의 치료적 위치는?비근육침윤성 방광암(NMIBC)은 초기 치료로 경요도 방광종양절제술(TURBT)이 시행되지만, 재발률이 높고 병변이 지속·활성화되는 경우가 많아 반복적 치료가 필요하다. 특히 CIS를 동반한 고위험군에서는 BCG 치료가 표준으로 자리잡아 있으나, 충분한 BCG 노출에도 불구하고 재발·지속·진행이 나타나는 BCG-불응성 환자군이 적지 않다.이러한 환자에서 근치적 방광적출술(radical cystectomy)은 표준 치료로 권고되지만, 고령, 동반질환, 삶의 질 저하에 대한 우려, 환자 선호 등의 이유로 수술 적용이 어려운 경우가 많다. 이에 따라 방광을 보존하면서도 충분한 항종양 효과를 제공할 수 있는 새로운 치료 전략의 필요성이 지속적으로 제기되어 왔다.노가펜데킨 알파 인바키셉트는 IL-15/IL-15Rα 복합체 기반의 IL-15 초작동제로, CD8+ T 세포와 NK 세포의 증식·활성화를 강력하게 유도하는 면역 증강형 생물학적 제제이다. NMIBC에서 BCG 치료는 국소 면역활성에 의존하지만, BCG-불응성 환자에서는 방광 내 면역 미세환경의 소진, T/NK 세포 감소, BCG 반응 저하 등이 주요 병태생리로 지적된다.이러한 맥락에서 노가펜데킨 알파 인바키셉트는 고갈된 면역계를 다시 활성화하여 기존 BCG 효과를 강화하고, 단독 BCG로는 확보하기 어려운 항종양 면역반응을 확대하는 기전적 장점을 가진다.전신 면역관문억제제인 pembrolizumab(키트루다)은 일부 환자에서 의미 있는 완전반응을 유도하지만, 전신 면역 관련 부작용과 장기 치료에 따른 독성·비용 부담이 중요한 제약으로 남아 있다. 반면 노가펜데킨 알파 인바키셉트는 방광 내 국소 투여를 기반으로 하여 전신 독성이 극히 낮으며, 고령 또는 동반질환이 많은 실제 진료 환경에서 사용하기 용이하다.또한 바이러스 벡터를 이용하는 AAV 기반 유전자치료제(nadofaragene firadenovec)와 달리 벡터 노출에 따른 안전성 우려가 없고, 기존 BCG 치료 패턴과 자연스럽게 연계되어 임상적 채택성이 높다는 점도 장점이다.노가펜데킨 알파 인바키셉트의 임상적 의미는 단순한 반응률 개선을 넘어, BCG-불응성 CIS 환자에서 방광적출술을 지연하거나 회피할 수 있는 실질적 치료 대안을 제공한다는 데에 있다.실제 임상에서 의미 있는 완전반응률과 지속기간이 확인되었으며, 이는 방광적출술을 바로 시행하기 어려운 환자에게 중요한 시간적 여유와 치료 선택권을 제공한다. 전신 독성의 부담이 거의 없고, BCG 기반 면역작동 기전을 확장하는 방식이라는 점 또한 치료적 위치를 공고히 한다.노가펜데킨 알파 인바키셉트(ANKTIVA)의 허가임상은 어떠한가?ANKTIVA의 효능은 QUILT-3.032(NCT03022825) 시험에서 평가되었다. 이 연구는 경요도 방광종양절제술(TURBT) 이후 BCG에 반응하지 않는 고위험 비근육침윤성 방광암(NMIBC) 중 상피내암(CIS)을 동반한 성인 환자 77명을 대상으로 한 단일군, 다기관 임상시험이었다. 여기에는 Ta/T1 유두상 병변의 동반 여부와 상관없이 CIS를 가진 환자들이 포함되었다.BCG 불응성 고위험군 NMIBC의 CIS는, 충분한 BCG 치료를 완료한 후 12개월 이내에 CIS가 단독으로 또는 Ta/T1 병변과 함께 지속되거나 재발한 경우로 정의되었다. 충분한 BCG 치료는 초기 유도요법 6회 중 최소 5회를 투여하고, 이어서 유지요법 3회 중 최소 2회 또는 두 번째 유도요법 6회 중 최소 2회를 투여한 경우로 정의되었다.치료 전 Ta 또는 T1 병변 환자들은 절제가 가능한 모든 병변을 제거하기 위해 TURBT를 시행받았다. 절제, 소작 또는 전기소작이 불가능한 잔여 CIS는 허용되었다. 한편 근침윤성 방광암(T2~T4), 국소 진행성, 전이성 또는 방광 외부(요도, 요관, 신우) 침범이 있거나 그 병력이 있는 환자는 시험에서 제외되었다.환자들은 유도요법 동안 ANKTIVA 400mcg와 BCG를 주 1회, 6주 연속 투여받았다. 이후 질병이 없거나 저등급 질환을 가진 경우 4, 7, 10, 13, 19개월째에 3주 간격으로 주 1회 추가 투여를 받았다. 치료 3개월 시점에 CIS가 지속되거나 고등급 Ta 병변이 남아 있는 경우에는 두 번째 유도요법을 받을 수 있었다. 치료 25개월 시점에 완전반응(CR)이 유지되는 환자는 25, 31, 37개월째에 동일한 방식으로 추가 투여가 가능했다.종양 상태 평가는 최대 2년 동안 3개월마다 시행되었다. 24개월 이후의 반응 평가는 각 기관의 진료 기준에 따라 시행되었다. 치료 시작 후 첫 6개월 동안은 무작위 또는 방광경 유도 조직검사가 필수적으로 시행되었다. 주요 효능 평가지표는 어느 시점에서든 완전반응을 달성했는지와(방광경 검사 및 필요 시 TURBT/조직검사 결과 음성, 요세포검사 음성 기준) 그 반응의 지속기간이었다.등록 환자의 중앙 연령은 73세(범위 50~91세)였고, 86%가 남성이었다. 인종 분포는 백인 90%, 흑인 6%, 아시아인 1%, 아메리칸 인디언/알래스카 원주민 1%, 미상 1%였다. ECOG 수행능력은 0점이 83%, 1점이 17%였다.연구 등록 시 종양 특성은 CIS 단독 69%, CIS + Ta 병변 21%, CIS + T1(±Ta) 병변 10%였다. 기저 질환 상태는 불응성 43%, 재발성 57%였다. 이전 BCG 투여 횟수의 중앙값은 12회(범위 8~45회)였고, 13%는 분할 용량 BCG를 받은 경험이 있었다. 방광경 영상 방식은 백색광 57%, 청색광 또는 협대역 영상 40%, 미상 3%였다.효능 결과는 표 3에 제시되어 있으며, 전체 환자의 31%(24명)는 두 번째 유도요법을 받았다.노가펜데킨 알파 인바키셉트의 쟁점을 무엇인가?노가펜데킨 알파 인바키셉트는 IL-15의 생물학적 활성을 기반으로 설계된 차세대 면역작용제로, 고위험 BCG 불응성 비근침윤성 방광암(NMIBC) 치료에서 새로운 치료적 가능성을 제시하고 있다.IL-15는 CD8& 8314; T 세포와 NK 세포의 생존과 기능을 강화하는 핵심 사이토카인으로 알려져 있으나, 자연 상태의 IL-15는 짧은 반감기, 불안정한 구조, 수용체 결합의 가변성 등으로 인해 치료제로 활용하는 데 본질적인 제약이 존재해왔다.노가펜데킨 알파 인바키셉트는 IL-15와 IL-15Rα 수용체 도메인을 결합해 형성한 안정적 이종이량체 기반의 IL-15 초작용제로, 내재 IL-15에 비해 우수한 생체 내 안정성과 장기적 면역 활성 유도가 가능하다는 점에서 임상적 의미가 크다.특히 BCG 치료에 반응하지 않는 NMIBC 환자는 방광적출술이 표준 치료임에도 불구하고, 고령 및 동반질환 등으로 수술이 어려운 경우가 많아 실질적인 치료 공백이 존재해왔다. 이러한 점에서 BCG와 병용하여 국소 종양 미세환경을 재활성화할 수 있는 약제의 개발은 방광보존 전략을 확장할 수 있는 새로운 치료 패러다임이라 할 수 있다.노가펜데킨 알파 인바키셉트의 주요 장점은 BCG와 병용 시 강력한 상승효과를 보인다는 점이다. IL-15Rα와의 결합을 통해 강화된 생물학적 활성은 APC, NK 세포, CD8& 8314; T 세포의 집적과 기능을 촉진하여 항종양 면역반응을 증폭시키며, 이는 허가 근거가 된 QUILT-3.032 연구에서 3개월 완전반응률 53%, 12개월 반응 지속률 24~30%로 나타났다.이러한 치료 성적은 기존 BCG 불응 환자에서 보고된 방광내 요법의 성적을 상회하는 결과이며, 이 약제가 임상적으로 의미 있는 반응을 유도하는 면역치료제로 기능함을 보여준다.그러나 노가펜데킨 알파 인바키셉트는의 개발과 허가 과정에는 여러 한계와 도전이 병존한다. 가장 큰 문제는 근거 임상이 무작위 대조군이 없는 단일군(single-arm) 연구로 수행되었다는 점으로, 이는 약제의 효과를 BCG 재투여 효과와 명확히 구분하기 어렵게 만들며, 역사적 대조(historical control)와의 비교에서 발생할 수 있는 해석의 변이를 피하기 어렵다.또한 환자군 내 BCG 노출량, CIS 단독 여부, 종양 특성 등에서 이질성이 존재하여 반응률과 반응 지속성의 정확한 비교가 제한된다. 반응의 지속성 역시 완전반응을 보인 환자의 일부에서만 장기적으로 유지되는 경향이 관찰되었고, 12개월 이후 장기 추적자료는 아직 충분히 축적되지 않아 방광보존 전략의 장기적 안전성과 유효성에 대한 확정적 결론을 내리기 어렵다.더불어 치료효과의 기저에 있는 종양면역미세환경의 상태가 환자별로 크게 달라, 이 약제가 NK/T 세포 결핍 또는 극도로 억제된 미세환경을 충분히 회복시키지 못하는 경우가 존재할 것으로 예상되며, 이러한 점은 향후 바이오마커 기반 환자선택 전략의 필요성을 시사한다.이처럼 노가펜데킨 알파 인바키셉트는 IL-15 생물학을 임상적으로 구현한 최초의 치료제로서 BCG 불응성 NMIBC라는 미충족 의료수요 영역에서 실질적인 치료 옵션을 제공하고 있다.초기 반응률과 독성 프로파일은 고무적이지만, 단일군 연구 설계, 병용요법의 기여도 분리 문제, 반응 지속성의 제한, 장기 추적자료 부족 등은 여전히 해결해야 할 과제로 남아 있다.그럼에도 불구하고 노가펜데킨 알파 인바키셉트는 기존 치료제와는 차별화된 기전을 바탕으로 난치성 NMIBC에서 방광보존 전력을 확장할 수 있는 중요한 면역치료제로 자리매김할 가능성이 높으며, 향후 병용 전략, 내성 기전 규명, 예측 바이오마커 개발 등을 통해 그 임상적 가치가 더욱 강화될 것으로 기대된다.참고문헌 1. Grace Lui et al. “Exploiting an Interleukin-15 Heterodimeric Agonist (N803) for Effective Immunotherapy of Solid Malignancies” Cells 2023, 12(12), 1611. 3. Richard S et al. “Non& 8211;muscle-invasive Bladder Cancer: Overview and Contemporary Treatment Landscape of Neoadjuvant Chemoablative Therapies” Reviews in Urology, Vol. 22 No. 2 2020. 3. Jong Ho Park et al. “The Emerging Treatment of BCG (Bacillus Calmette-Gu& 233;rin)- Unresponsive Non& 8211;Muscle-Invasive Bladder Cancer“ Journal of Urologic Oncology 2024;22(3):246-255. 4. Aiman Waheed et al. “Nogapendekin alfa inbakicept-PMLN: first approval milestone for BCG-unresponsive noninvasive bladder cancer: editorial” Annals of Medicine & Surgery (2024) 86:6386& 8211;6388. 5. Brian L. Heiss et al. “FDA Approval Summary: Nogapendekin Alfa Inbakicept-pmln with BCG for BCG-unresponsive carcinoma in situ” Clin Cancer Res. 2025 October 15; 31(20): 4223& 8211;4229. 6. Vikram M et al. “Mechanism of action of nadofaragene firadenovec-vncg” Front. Oncol. 14:1359725. 7. 기타 인터넷 자료(보도 자료, 제품 설명서 등)2025-11-20 17:29:43최병철 박사
방광암 면역치료 최초 IL-15 초작용제 '안크티바'안크티바(Anktiva®, 성분명: 노가펜데킨 알파 인바키셉트-pmln, nogapendekin alfa inbakicept-pmln, ImmunityBio)는 IL-15 초작용제(superagonist) 복합체로 개발된 최초의 방광 내 면역치료제다.2024년 4월 미국 FDA에서 유두종 유무와 관계없이 상피내암(CIS)을 동반한 BCG-불응성 비근육침윤성 방광암(non-muscle invasive bladder cancer, NMIBC) 성인 환자를 대상으로 BCG와 병용 사용하는 치료제로 승인됐다.방광암은 전 세계적으로 흔한 악성 종양 중 하나다. 국내에서도 발생 빈도가 높은 암종으로 알려져 있다. 이 중 약 75%는 비근육침윤성 방광암(NMIBC)으로 분류되며, 초기 치료는 대개 경요도 방광 종양 절제술(transurethral resection of bladder tumor, TURBT)로 시작된다.그러나 NMIBC는 60& 8211;70%의 재발률을 보이므로, TURBT 이후 방광 내 치료(intravesical therapy)가 질병의 재발을 억제하고 진행을 지연시키는 데 핵심적인 역할을 한다.현재 방광 내 치료는 크게 두 가지로 구분되며, 하나는 BCG 요법을 기반으로 하는 면역치료, 다른 하나는 미토마이신 C, 젬시타빈, 에피루비신, 독소루비신 등으로 구성되는 화학요법이다.BCG는 NMIBC의 표준 치료 중 하나이지만, 약 40%의 환자에서는 충분한 치료 효과를 보이지 못한다. 안크티바는 이러한 BCG-불응성 환자에서 방광 절제술을 피할 수 있는 새로운 치료 대안으로 개발됐다.IL-15는 NK 세포와 CD8& 8314; T 세포의 활성, 증식, 기억 형성에 관여하는 중요한 사이토카인이다. 안크티바는 IL-15 변형체와 IL-15Rα의 sushi(반복 단백질 구조) domain이 결합한 IL-15 초작용제(superagonist) 복합체를 통해 NK 세포, CD4& 8314; T 세포, CD8& 8314; T 세포의 활성을 강력하게 유도하며, 특히 종양 특이적 기억 T 세포 반응을 증폭시켜 항종양 면역반응을 강화한다.임상시험에서 BCG 유지요법과 함께 안크티바를 투여받은 77명의 환자 중 62%(95% CI, 51& 8211;73)가 완전관해에 도달했다. 이 반응은 일부 환자에서 최대 47개월까지 지속됐다. 완전관해가 12개월 이상 유지된 비율은 58%, 24개월 이상 유지된 비율은 40%였다.치료 스케줄은 방광 내 카테터를 통한 유도요법(6주간 주 1회) 후, 4, 7, 10, 13, 19개월째의 유지요법(각 3주간 주 1회)으로 구성된다. 3개월 시점에 완전 반응이 확인되지 않으면 두 번째 유도요법을 시행할 수 있으며, 25개월 이후에도 완전 반응이 지속되는 경우에는 25, 31, 37개월째에 추가 BCG 유지투여를 실시할 수 있다. 투여 시 약물 혼합액은 방광 내에 2시간 동안 유지한 뒤 배출한다.안크티바 치료에는 몇 가지 중요한 주의사항이 있다. 방광절제술을 지연함으로써 전이성 방광암으로 진행할 위험이 존재하며, 배아& 8211;태아 독성 가능성이 보고되어 가임기 여성은 치료 중과 마지막 투여 후 최소 1주일 동안 피임이 필요하다.흔하게 보고되는 이상반응으로는 배뇨곤란, 혈뇨, 빈뇨, 절박뇨, 요로감염, 근골격계 통증, 발열 및 오한 등이 있으며, 실험실 검사에서는 크레아티닌 상승과 칼륨 상승이 비교적 흔하게 관찰된다.방광암(Bladder Cancer)이란 무엇인가?방광암은 요로계에서 가장 흔히 발생하는 악성 종양 중 하나로, 소변을 저장하는 장기인 방광의 점막 상피세포에서 주로 기원한다.전 세계적으로 방광암은 발생률과 사망률 측면에서 중요한 건강 문제를 야기하고 있으며, 특히 남성에서 높은 발생 빈도를 보인다. 방광암의 발생에는 흡연이 가장 강력한 위험 요인으로 작용하는 것으로 알려져 있다. 이 외에도 직업적 발암물질 노출, 만성 요로 감염 및 요로 결석 등이 발병과 연관돼 있다.조직학적으로 방광암의 대다수는 요로상피암(urothelial carcinoma)으로, 전체 방광암의 약 90%를 차지한다. 요로상피암은 방광뿐 아니라 요관, 신우, 요도 등 요로 전반에 걸쳐 발생할 수 있는 특성을 지니고 있다.이 외에도 만성 자극이나 염증과 관련된 편평세포암(squamous cell carcinoma), 드물게 선종 양상의 조직학적 특징을 보이는 선암(adenocarcinoma), 그리고 고도로 공격적인 생물학적 특성을 나타내는 소세포암(small cell carcinoma) 등 다양한 형태가 존재한다. 이러한 조직형의 차이는 임상적 경과, 치료 전략 및 예후와 밀접하게 연관되어 있어 진단 시 정확한 병리학적 분류가 필수적이다.방광암의 병기 결정은 치료 방침 수립과 예후 평가에 있어 핵심적인 요소이다. 국제적으로 널리 사용되는 TNM 병기 체계는 종양의 침윤 정도(T), 국소 림프절 전이 여부(N), 및 원격 전이 여부(M)에 기반하여 병기를 구분한다.특히 방광벽의 근육층 침윤 여부는 임상적 의사결정에서 매우 중요한 기준으로 작용한다. 종양이 점막층에 국한된 Ta 병기, 상피 내에서 편평하게 확산되는 상피내암(carcinoma in situ, CIS), 그리고 점막하층을 침범하나 근육층에는 도달하지 않은 T1 병기는 비근침윤성 방광암(non& 8211;muscle invasive bladder cancer, NMIBC)으로 분류된다.반면, 종양이 방광 근육층을 침범하는 T2 병기부터는 근침윤성 방광암(muscle invasive bladder cancer, MIBC)으로 정의되며, 이후 주변 지방조직(T3) 및 인접 장기(T4)로의 침윤 여부에 따라 병기가 상승한다. 림프절 전이(N1& 8211;N3)와 원격 전이(M1)의 존재는 질병의 진행을 시사하며 전신적 치료 전략이 요구된다.Non& 8211;Muscle Invasive Bladder Cancer(NMIBC) and Muscle Invasive Bladder Cancer(출처: https://cgoncology.com/science/).이와 같이 방광암은 조직학적 이질성과 침윤 정도에 따른 이분화된 임상 양상을 보이며, 병기 및 조직형은 환자의 치료 선택과 예후에 결정적인 영향을 미친다.비근침윤성 방광암(Non& 8211;muscle invasive bladder cancer, NMIBC)은 무엇인가?비근육 침습성 방광암(NMIBC)은 새로 진단되는 방광암의 약 75%를 차지하며, 병변이 주로 요로상피의 표층(Ta), 점막하층(T1) 또는 상피내암(CIS)에 국한되는 질환이다.NMIBC는 즉각적으로 생명을 위협하는 경우는 드물지만, 높은 재발률과 적지 않은 진행 위험으로 인해 임상적으로 중요한 도전 과제로 여겨진다. 실제로 환자의 약 50~70%가 초기 치료 이후 재발을 경험하며, 최대 30%는 근육 침습성 또는 전이성 방광암으로 진행한다.수십 년 동안 고위험군 NMIBC 환자에서 경요도 방광 종양 절제술(transurethral resection of bladder tumor, TURBT) 후 시행되는 BCG(Bacillus Calmette& 8211;Gu& 233;rin) 치료는 재발과 진행을 효과적으로 억제하는 표준 치료로 자리매김해 왔다.그러나 BCG 치료의 임상적 이점에도 불구하고 약 40%의 환자에서 실패가 발생하며, 이 경우 추가적인 치료 전략이 필요하다. 이러한 환자군에서 전통적으로 가장 선호된 치료는 근치적 방광절제술(radical cystectomy)이었으나, 이 수술은 상당한 이환율과 삶의 질 저하를 초래하는 고난도 치료로, 실제 임상 적용에는 한계가 적지 않다.NMIBC의 위험도 분류& 8212;저위험군, 중간위험군, 고위험군& 8212;는 종양의 병기, 등급, 크기, 다초점성, 재발력 등의 임상·병리학적 지표를 종합해 이루어지며, 특히 고위험군 환자, 그중에서도 CIS 또는 T1 병변을 가진 환자는 진행 위험이 높아 보다 적극적인 치료가 요구된다.근치적 방광절제술은 BCG 불응 NMIBC에서 높은 질병 조절 효과를 보이지만, 그 침습성과 장기적인 기능 상실로 인해 방광을 보존하면서도 충분한 종양 조절을 달성할 수 있는 새로운 치료 전략의 필요성이 크게 대두되고 있다.이에 따라 면역관문억제제, 종양용해성 바이러스(oncolytic virus) 치료, 방광내 약물전달 플랫폼, 표적 치료제 등 다양한 신기술 기반 치료법이 개발되고 있으며, 이들 접근법은 방광 기능을 유지하면서도 지속적이고 임상적으로 의미 있는 치료 효과를 달성하는 것을 목표로 한다.최근 NMIBC 치료 환경은 과거와 달리 빠르게 확장되고 있으며, 새로운 약제의 등장, 기존 약물의 새로운 적응증 또는 약물 전달 방식의 진화, 그리고 완전히 새로운 치료 플랫폼의 출현 등 혁신적 변화가 지속되고 있다.초기에는 대부분의 신약 개발이 BCG 불응성 고위험군 NMIBC 환자를 대상으로 이루어졌으나, 점차 고위험군뿐 아니라 중간위험군 환자에서도 BCG와 직접 경쟁 가능한 후보 약제가 등장하면서 치료 선택지는 더욱 다양해지고 있다.비근침윤성 방광암(NMIBC)은 어떻게 치료하고, 치료 성적은 어떠한가?비근침윤성 방광암(NMIBC)은 대부분 경요도 방광 종양 절제술(TURBT) 후 시행되는 보조요법을 통해 관리된다. 이 질환의 임상적 특징은 높은 재발률과 상대적으로 낮은 진행률로 요약된다.실제로 5년 재발률은 50~70%에 이르며, 진행률은 10~20% 수준으로 보고된다. 이러한 자연경과는 단순 TURBT만으로는 장기적인 종양 조절이 어렵다는 점을 시사하며, 보조적 방광내 치료의 중요성을 부각시킨다.TURBT 직후 시행되는 단회 방광내 항암제 주입요법은 저위험군 및 일부 중위험군에서 재발률을 유의하게 낮추는 것으로 입증됐다. 특히 mitomycin C(MMC)는 절제 후 잔존 암세포를 제거하고 세포 재부착을 방지하는 작용을 통해 초기 재발 감소 전략의 표준요법으로 자리잡았다. 그러나 MMC를 포함한 기존 화학요법은 병변의 진행 억제 효과가 제한적이어서 고위험군에서는 단독 치료만으로는 충분하지 않다.고위험군 NMIBC, 특히 고등급 Ta/T1 병변 및 상피내암(CIS)의 경우 BCG 면역요법이 여전히 가장 강력하고 일관된 치료 효과를 제공한다. BCG의 초기 완전반응률은 유두종양에서 55~65%, CIS에서 70~75%로 보고되며, 재발 억제와 진행 위험 감소를 동시에 입증한 유일한 방광내 치료법이다.그럼에도 불구하고 전체 환자의 약 30~40%는 BCG에 초기 반응을 보이지 않는다. 초기 완전반응을 얻더라도 약 절반은 결국 재발한다. 여기에 장기화된 BCG 공급 부족 문제까지 겹치면서 고위험군 외의 환자에게 BCG 사용을 제한해야 하는 현실적인 어려움도 지속되고 있다.이러한 한계를 보완하기 위해 다양한 대체 전략이 개발되고 있다. Gemcitabine, Epirubicin, MMC 등 기존 항암제의 방광내 투여는 BCG 불응성 또는 BCG 금기 환자에서 활용되고 있으며, 특히 gemcitabine& 8211;docetaxel 병용요법은 BCG 불응 환자에서 1년 완전반응률 50~60%를 보이며 salvage therapy로 임상적 관심이 높아지고 있다.최근에는 방광보존 치료 옵션이 기존 면역요법을 넘어 유전자치료 영역으로까지 확장되고 있다. Nadofaragene firadenovec(Adstiladrin& 9415;)은 IFN-α2b 유전자를 방광 점막에 전달하여 국소 면역반응을 활성화하는 비증식성 아데노바이러스 벡터 기반 치료제로, 고위험 BCG 불응성 NMIBC에서 2022년 미국 FDA 승인을 받았다. 주요 임상시험에서는 3개월 완전반응률 53%, 12개월 지속반응률 24~30%가 보고되며, BCG 불응성 환자에서 새로운 치료 기전의 확립이라는 의의를 가진다.종합하면 NMIBC 치료 전략은 위험군에 따라 크게 달라지며, 저위험군에서는 TURBT와 단회 항암제 주입만으로도 비교적 양호한 성적을 기대할 수 있다. 반면 고위험군에서는 BCG를 중심으로 한 적극적 면역치료가 필수적이며, BCG 불응성 증가와 공급 제한 문제로 인해 새로운 치료제 개발이 더욱 활발히 이루어지고 있다.Bacillus Calmette-Gu& 233;rin(BCG)는 어떤 치료 방법인가?BCG는 1990년 미국 FDA에서 승인된 비특이적 면역요법으로, 비근육침윤성 방광암(NMIBC) 치료에 널리 사용돼 왔다.BCG의 항종양 효과는 Th1 중심의 면역 반응을 유도하는 기전에 기반한다. BCG가 요로상피세포에 부착되면 IL-1, IL-6, IL-8, TNF-α 등 다양한 사이토카인과 케모카인이 분비되며, 이로 인해 면역세포들이 방광 점막으로 집중된다. 이어서 대식세포, 호중구, 수지상세포 등 항원제시세포가 활성화되고, 변화된 사이토카인 환경 속에서 미성숙 CD4+ T 세포는 Th1 또는 Th2 세포로 분화한다.이 중 Th1 반응은 IFN-γ를 포함한 사이토카인 분비를 통해 BCG 치료 효과와 밀접히 연관되며, 반대로 IL-10을 중심으로 한 Th2 반응은 BCG 실패와 관련된다. 실제로 IL-10 억제 또는 IFN-γ 증가가 Th1 우세 상태를 유도하며, 이는 BCG 매개 종양 퇴행에 필수적인 요소로 알려져 있다.이처럼 BCG는 Th1 면역 반응을 활성화함으로써 방광암이 유발하는 면역 억제 환경을 극복하는 데 효과적이지만, 환자 예후를 더 향상시키기 위해서는 보다 강력한 면역조절 능력을 가진 새로운 치료제의 개발이 필요하다.특히 BCG에 반응하지 않는 NMIBC는 예후가 불량하고 전통적으로 치료 옵션이 제한적이었다. 고위험 BCG-불응성 질환의 경우 근치적 방광 절제술이 표준 치료로 권고되지만, 모든 환자가 수술을 감내할 수 있는 것은 아니다.임상시험 기준으로 BCG의 초기 완전반응률은 유두종양에서 약 55~65%, CIS에서 70~75% 수준이다. 그러나 전체 NMIBC 환자의 약 3분의 1은 BCG에 전혀 반응하지 않으며, 초기 반응을 보인 환자의 약 절반도 결국 재발하거나 진행을 경험한다.미국 FDA는 BCG-불응성 NMIBC를 다음과 같이 정의한다: ▲ 적절한 BCG 요법 후 12개월 이내 지속성 또는 재발성 CIS, 또는 재발성 Ta/T1 질환이 있는 경우(초기 유도 6회 중 ≥5회, 유지 3회 중 ≥2회 또는 2차 유도 6회 중 ≥2회 투여 완료를 ‘적절한 요법’으로 정의), ▲ 적절한 BCG 요법 후 6개월 이내 재발한 고등급 Ta/T1 질환, ▲ 유도요법 후 첫 평가에서 고등급 T1 질환이 확인된 경우이다.Bacillus Calmette-Gu& 233;rin(BCG)-불응성은 왜 일어나는가?BCG-불응성은 단일 요인보다는 종양 미세환경, 면역반응의 왜곡, 종양세포의 생물학적 저항성이 복합적으로 작용하여 발생한다. 일부 NMIBC는 이미 강한 면역억제 환경을 형성하고 있어, BCG가 유도하는 Th1 중심 면역 반응이 충분히 활성화되지 못한다.이들 종양에서는 IL-10과 TGF-β 같은 면역억제성 사이토카인이 증가하고, Treg와 MDSC가 축적되며, 종양세포의 PD-L1 발현도 높아져 T 세포 기능이 억제된다. 이러한 환경에서는 BCG가 방출시키는 사이토카인이 존재하더라도 Th1 분화보다는 Th2 또는 억제성 면역반응이 우세해져 IFN-γ 중심의 항종양 면역이 제대로 형성되지 않는다.또한 종양세포 자체가 BCG에 대한 내성을 가지는 경우도 있다. 상피세포 표면의 BCG 부착·내재화에 필요한 integrin 등 분자의 발현이 낮거나, BCG가 유도하는 세포사멸 신호(TRAIL, Fas 등)에 저항성을 나타내는 경우가 이에 해당한다. 일부 NMIBC는 특정 유전자 변이나 생존 신호의 과활성화로 인해 BCG 면역 반응에 본질적으로 둔감하다.여기에 고령, 기저질환, 면역노화 등 환자 요인이 더해지면 APC 활성 및 T 세포 반응성이 감소해 BCG가 충분한 면역 강화 효과를 내지 못한다. 균주 간 면역원성 차이, BCG 부족으로 인한 불충분한 치료 역시 면역반응 축적을 방해해 불응 위험을 높인다.결국 BCG 불응성은 종양 미세환경의 면역억제성, Th1 면역 활성화의 실패, 종양세포의 내재적 저항성, 그리고 숙주 면역 기능 저하가 상호 작용하여 나타나는 복합적 면역치료 실패 현상으로 이해된다. 이러한 이유로 BCG 불응성 NMIBC에서는 보다 강력한 면역조절 능력을 갖춘 새로운 치료 전략이 필요하다.인터루킨-15(IL-15)는 어떤 역할을 하는가?IL-15는 공통 γ사슬(γc) 사이토카인 패밀리에 속하는 면역 조절 인자로, 선천 면역과 적응 면역의 경계를 연결하며 항종양 면역을 강화하는 데 핵심적인 역할을 수행한다. IL-2, IL-4, IL-7, IL-9, IL-21과 함께 γc 계열을 이루는 IL-15는 특히 CD8+ T 세포와 자연살해(NK) 세포의 발달, 생존, 증식, 그리고 기능적 활성화 전반을 조절하는 중심적 사이토카인이다.Pleiotropic Effects of IL-15(출처: Cells 2023, 12, 1611).이러한 생물학적 중요성은 다양한 전임상·임상 연구에서 반복적으로 입증되어 왔으며, IL-15가 항암 면역을 유지하는 데 필수적인 조절자로 작용함을 뚜렷하게 보여준다.생리학적으로 IL-15는 IL-15 수용체 α(IL-15Rα)와 함께 이종이량체 형태로 합성된다. IL-15Rα는 자체적으로 신호 전달 기능을 갖고 있지는 않지만 IL-15에 높은 친화도로 결합하여 내질망에서 안정적인 복합체를 형성하고 이를 세포 표면까지 운반함으로써 생물학적 기능 발현을 위한 핵심적인 플랫폼을 제공한다.이 복합체는 생산 세포 표면에 제시된 뒤 인접한 수용 세포의 IL-2/IL-15Rβ와 공통 γ사슬과 결합하여 신호를 전달하는데, 이러한 ‘트랜스제시(trans-presentation)’는 IL-15 생물학을 규정하는 대표적 기전이자 IL-2와 구별되는 가장 특징적인 작동 방식이다.따라서 IL-15와 IL-15Rα는 단핵구, 대식세포, 수지상세포, 혈관내피세포, 골수 및 림프절의 기질세포 등 다양한 세포 유형에서 발현되며, 특히 수지상세포와 대식세포가 주요 생산자인 것으로 보고되었다. 이들 세포는 항원 제시뿐 아니라 IL-15 제시 기능을 통해 CD8+ T 세포와 NK 세포의 생존 신호를 제공함으로써 면역계의 항상성을 유지하는 데 기여한다.IL-15 초작용제(superagonist) 복합체는 무엇인가?최근 면역조절 치료제 개발은 기존 사이토카인 신호 경로를 선택적으로 증폭하여 항종양 면역 반응을 극대화하는 방향으로 진화하고 있으며, 그 중심에는 IL-15 경로 기반의 차세대 초작용제(superagonist) 기술이 있다.IL-15는 본래 NK 세포와 CD8& 8314; T 세포의 생존, 증식, 기억 형성에 핵심적인 사이토카인이지만, 생체 내 반감기가 짧고 수용체 결합 효율이 낮아 단독 활용에는 한계가 있었다.이러한 제약을 극복하기 위해 고안된 IL-15 초작용제 복합체는 IL-15의 생물학적 활성을 비약적으로 증폭하도록 설계된 구조적 혁신체로, 대표적인 예가 IL-15N72D 변형체와 IL-15Rα의 sushi 도메인을 융합한 노가펜데킨 알파 인바키셉트이다.IL-15N72D는 아스파라긴(N)에서 아스파트산(D)으로의 단일 아미노산 치환을 통해 수용체 친화성과 신호전달 강도를 향상시킨 기능적 변형체이며, IL-15Rα의 sushi 도메인 결합을 통해 자연적인 trans-presentation 기전을 모사하도록 설계되었다.이 두 구성요소는 IgG1 Fc 영역과 융합되어 약물의 안정성, 체내 반감기, 조직 내 지속 시간을 획기적으로 개선하며, 그 결과 NK 세포와 CD8& 8314; T 세포의 활성화 및 항종양 세포독성 반응을 장기간 유도하는 강력한 IL-15 신호 증폭체를 형성한다.이러한 기전은 기존 BCG 치료로 유도되는 국소 면역 반응을 효과적으로 증폭시키며, BCG-불응성 비근육침윤성 방광암에서 관찰되는 높은 완전관해율과 반응 지속성을 설명하는 면역학적 기반을 제공한다.결과적으로 IL-15 변형체와 IL-15Rα가 융합된 초작용제 플랫폼은 단순한 사이토카인 보충을 넘어, 정밀하게 설계된 면역 신호 조절을 통해 종양 미세환경 내에서 효과적인 항암 면역을 재활성화하려는 현대 면역항암제 개발의 중요한 패러다임을 제시한다노가펜데킨 알파 인바키셉트의 약리 기전은?노가펜데킨 알파 인바키셉트는 IL-15 돌연변이체(IL-15N72D)와 IL-15Rα를 융합한 복합체로, 자연 면역세포가 제공하는 IL-15 제시 기전을 모방한다. 이를 통해 CD8+ T 세포, NK 세포, 기억 T 세포의 증식·활성화를 강하게 유도하면서도, 면역억제성 조절 T 세포의 확장은 최소화한다.전임상 모델에서 방광 내 투여된 노가펜데킨 알파 인바키셉트는 단독 또는 BCG와 병용 시 BCG 단독보다 우수한 항종양 효과를 보였다. 또한 비융합(native) IL-15에 비해 림프조직 내 지속시간이 길고, 약동학적 안정성이 크게 향상되어 보다 강력하고 지속적인 항종양 면역반응을 유발한다.결과적으로 노가펜데킨 알파 인바키셉트는 IL-15 신호를 증폭해 킬러 T 세포 중심의 면역반응을 재가동시키는 기전적 특성을 기반으로, BCG-불응성 NMIBC에서 의미 있는 치료적 이점을 제공하는 IL-15 기반 면역증강제이다.Immune Effects of nogapendekin alfa inbakicept(출처: Cells 2023, 12, 1611).위 사진자료에 대해 설명하면, A. 노가펜데킨 알파 인바키셉트는 인간 IgG1 Fc와 융합된 IL15Rα에 결합된 돌연변이(N72D) 인간 IL-15로 구성된다. B. 노가펜데킨 알파 인바키셉트는 IL-15 수용체를 통해 순환 면역 세포에 결합한다. C. 노가펜데킨 알파 인바키셉트가 림프구에 결합하면 자연 살해(NK) 세포와 CD8+ T 세포 집단이 활성화된다되고 확장되어 고효과 CD56 dim 및 CD56 bright NK 세포와 중앙 기억 T 세포(TCM)가 확장된다. D. 비장 CD8+ T 세포 표면의 CXCR3가 상향 조절되면 종양 미세 환경(TME)으로 이동할 가능성이 높아집니다. 활성화된 NK 세포도 종양으로 이동한다. E. 활성화된 종양 침윤 CD8+ T 림프구(TIL)는 MHC 클래스 I 복합체가 제시하는 종양 관련 항원 에피토프를 인식하여 암세포를 인식한다. 활성화된 CD8+ T 세포와 NK 세포는 세포독성이 증가하여 암세포 사멸을 유도한다.CD8+ T 세포는 IFNγ 및 TNF& 9082;와 같은 Th1 사이토카인을 분비하여 염증성 TME를 촉진하고 과립구 및 단핵구 골수유래 억제 세포(MDSC)의 PD-L1을 상향 조절합니다. 노가펜데킨 알파 인바키셉트는 NK TIL이 TGF-β의 영향에 저항성을 갖도록 하고 항체 의존성 세포독성(ADCC)을 증가시킬 수 있도록 한다.노가펜데킨 알파 인바키셉트의 치료적 위치는?비근육침윤성 방광암(NMIBC)은 초기 치료로 경요도 방광종양절제술(TURBT)이 시행되지만, 재발률이 높고 병변이 지속·활성화되는 경우가 많아 반복적 치료가 필요하다. 특히 CIS를 동반한 고위험군에서는 BCG 치료가 표준으로 자리잡아 있으나, 충분한 BCG 노출에도 불구하고 재발·지속·진행이 나타나는 BCG-불응성 환자군이 적지 않다.이러한 환자에서 근치적 방광적출술(radical cystectomy)은 표준 치료로 권고되지만, 고령, 동반질환, 삶의 질 저하에 대한 우려, 환자 선호 등의 이유로 수술 적용이 어려운 경우가 많다. 이에 따라 방광을 보존하면서도 충분한 항종양 효과를 제공할 수 있는 새로운 치료 전략의 필요성이 지속적으로 제기되어 왔다.노가펜데킨 알파 인바키셉트는 IL-15/IL-15Rα 복합체 기반의 IL-15 초작동제로, CD8+ T 세포와 NK 세포의 증식·활성화를 강력하게 유도하는 면역 증강형 생물학적 제제이다. NMIBC에서 BCG 치료는 국소 면역활성에 의존하지만, BCG-불응성 환자에서는 방광 내 면역 미세환경의 소진, T/NK 세포 감소, BCG 반응 저하 등이 주요 병태생리로 지적된다.이러한 맥락에서 노가펜데킨 알파 인바키셉트는 고갈된 면역계를 다시 활성화하여 기존 BCG 효과를 강화하고, 단독 BCG로는 확보하기 어려운 항종양 면역반응을 확대하는 기전적 장점을 가진다.전신 면역관문억제제인 pembrolizumab(키트루다)은 일부 환자에서 의미 있는 완전반응을 유도하지만, 전신 면역 관련 부작용과 장기 치료에 따른 독성·비용 부담이 중요한 제약으로 남아 있다. 반면 노가펜데킨 알파 인바키셉트는 방광 내 국소 투여를 기반으로 하여 전신 독성이 극히 낮으며, 고령 또는 동반질환이 많은 실제 진료 환경에서 사용하기 용이하다.또한 바이러스 벡터를 이용하는 AAV 기반 유전자치료제(nadofaragene firadenovec)와 달리 벡터 노출에 따른 안전성 우려가 없고, 기존 BCG 치료 패턴과 자연스럽게 연계되어 임상적 채택성이 높다는 점도 장점이다.노가펜데킨 알파 인바키셉트의 임상적 의미는 단순한 반응률 개선을 넘어, BCG-불응성 CIS 환자에서 방광적출술을 지연하거나 회피할 수 있는 실질적 치료 대안을 제공한다는 데에 있다.실제 임상에서 의미 있는 완전반응률과 지속기간이 확인되었으며, 이는 방광적출술을 바로 시행하기 어려운 환자에게 중요한 시간적 여유와 치료 선택권을 제공한다. 전신 독성의 부담이 거의 없고, BCG 기반 면역작동 기전을 확장하는 방식이라는 점 또한 치료적 위치를 공고히 한다.노가펜데킨 알파 인바키셉트(ANKTIVA)의 허가임상은 어떠한가?ANKTIVA의 효능은 QUILT-3.032(NCT03022825) 시험에서 평가되었다. 이 연구는 경요도 방광종양절제술(TURBT) 이후 BCG에 반응하지 않는 고위험 비근육침윤성 방광암(NMIBC) 중 상피내암(CIS)을 동반한 성인 환자 77명을 대상으로 한 단일군, 다기관 임상시험이었다. 여기에는 Ta/T1 유두상 병변의 동반 여부와 상관없이 CIS를 가진 환자들이 포함되었다.BCG 불응성 고위험군 NMIBC의 CIS는, 충분한 BCG 치료를 완료한 후 12개월 이내에 CIS가 단독으로 또는 Ta/T1 병변과 함께 지속되거나 재발한 경우로 정의되었다. 충분한 BCG 치료는 초기 유도요법 6회 중 최소 5회를 투여하고, 이어서 유지요법 3회 중 최소 2회 또는 두 번째 유도요법 6회 중 최소 2회를 투여한 경우로 정의되었다.치료 전 Ta 또는 T1 병변 환자들은 절제가 가능한 모든 병변을 제거하기 위해 TURBT를 시행받았다. 절제, 소작 또는 전기소작이 불가능한 잔여 CIS는 허용되었다. 한편 근침윤성 방광암(T2~T4), 국소 진행성, 전이성 또는 방광 외부(요도, 요관, 신우) 침범이 있거나 그 병력이 있는 환자는 시험에서 제외되었다.환자들은 유도요법 동안 ANKTIVA 400mcg와 BCG를 주 1회, 6주 연속 투여받았다. 이후 질병이 없거나 저등급 질환을 가진 경우 4, 7, 10, 13, 19개월째에 3주 간격으로 주 1회 추가 투여를 받았다. 치료 3개월 시점에 CIS가 지속되거나 고등급 Ta 병변이 남아 있는 경우에는 두 번째 유도요법을 받을 수 있었다. 치료 25개월 시점에 완전반응(CR)이 유지되는 환자는 25, 31, 37개월째에 동일한 방식으로 추가 투여가 가능했다.종양 상태 평가는 최대 2년 동안 3개월마다 시행되었다. 24개월 이후의 반응 평가는 각 기관의 진료 기준에 따라 시행되었다. 치료 시작 후 첫 6개월 동안은 무작위 또는 방광경 유도 조직검사가 필수적으로 시행되었다. 주요 효능 평가지표는 어느 시점에서든 완전반응을 달성했는지와(방광경 검사 및 필요 시 TURBT/조직검사 결과 음성, 요세포검사 음성 기준) 그 반응의 지속기간이었다.등록 환자의 중앙 연령은 73세(범위 50~91세)였고, 86%가 남성이었다. 인종 분포는 백인 90%, 흑인 6%, 아시아인 1%, 아메리칸 인디언/알래스카 원주민 1%, 미상 1%였다. ECOG 수행능력은 0점이 83%, 1점이 17%였다.연구 등록 시 종양 특성은 CIS 단독 69%, CIS + Ta 병변 21%, CIS + T1(±Ta) 병변 10%였다. 기저 질환 상태는 불응성 43%, 재발성 57%였다. 이전 BCG 투여 횟수의 중앙값은 12회(범위 8~45회)였고, 13%는 분할 용량 BCG를 받은 경험이 있었다. 방광경 영상 방식은 백색광 57%, 청색광 또는 협대역 영상 40%, 미상 3%였다.효능 결과는 표 3에 제시되어 있으며, 전체 환자의 31%(24명)는 두 번째 유도요법을 받았다.노가펜데킨 알파 인바키셉트의 쟁점을 무엇인가?노가펜데킨 알파 인바키셉트는 IL-15의 생물학적 활성을 기반으로 설계된 차세대 면역작용제로, 고위험 BCG 불응성 비근침윤성 방광암(NMIBC) 치료에서 새로운 치료적 가능성을 제시하고 있다.IL-15는 CD8& 8314; T 세포와 NK 세포의 생존과 기능을 강화하는 핵심 사이토카인으로 알려져 있으나, 자연 상태의 IL-15는 짧은 반감기, 불안정한 구조, 수용체 결합의 가변성 등으로 인해 치료제로 활용하는 데 본질적인 제약이 존재해왔다.노가펜데킨 알파 인바키셉트는 IL-15와 IL-15Rα 수용체 도메인을 결합해 형성한 안정적 이종이량체 기반의 IL-15 초작용제로, 내재 IL-15에 비해 우수한 생체 내 안정성과 장기적 면역 활성 유도가 가능하다는 점에서 임상적 의미가 크다.특히 BCG 치료에 반응하지 않는 NMIBC 환자는 방광적출술이 표준 치료임에도 불구하고, 고령 및 동반질환 등으로 수술이 어려운 경우가 많아 실질적인 치료 공백이 존재해왔다. 이러한 점에서 BCG와 병용하여 국소 종양 미세환경을 재활성화할 수 있는 약제의 개발은 방광보존 전략을 확장할 수 있는 새로운 치료 패러다임이라 할 수 있다.노가펜데킨 알파 인바키셉트의 주요 장점은 BCG와 병용 시 강력한 상승효과를 보인다는 점이다. IL-15Rα와의 결합을 통해 강화된 생물학적 활성은 APC, NK 세포, CD8& 8314; T 세포의 집적과 기능을 촉진하여 항종양 면역반응을 증폭시키며, 이는 허가 근거가 된 QUILT-3.032 연구에서 3개월 완전반응률 53%, 12개월 반응 지속률 24~30%로 나타났다.이러한 치료 성적은 기존 BCG 불응 환자에서 보고된 방광내 요법의 성적을 상회하는 결과이며, 이 약제가 임상적으로 의미 있는 반응을 유도하는 면역치료제로 기능함을 보여준다.그러나 노가펜데킨 알파 인바키셉트는의 개발과 허가 과정에는 여러 한계와 도전이 병존한다. 가장 큰 문제는 근거 임상이 무작위 대조군이 없는 단일군(single-arm) 연구로 수행되었다는 점으로, 이는 약제의 효과를 BCG 재투여 효과와 명확히 구분하기 어렵게 만들며, 역사적 대조(historical control)와의 비교에서 발생할 수 있는 해석의 변이를 피하기 어렵다.또한 환자군 내 BCG 노출량, CIS 단독 여부, 종양 특성 등에서 이질성이 존재하여 반응률과 반응 지속성의 정확한 비교가 제한된다. 반응의 지속성 역시 완전반응을 보인 환자의 일부에서만 장기적으로 유지되는 경향이 관찰되었고, 12개월 이후 장기 추적자료는 아직 충분히 축적되지 않아 방광보존 전략의 장기적 안전성과 유효성에 대한 확정적 결론을 내리기 어렵다.더불어 치료효과의 기저에 있는 종양면역미세환경의 상태가 환자별로 크게 달라, 이 약제가 NK/T 세포 결핍 또는 극도로 억제된 미세환경을 충분히 회복시키지 못하는 경우가 존재할 것으로 예상되며, 이러한 점은 향후 바이오마커 기반 환자선택 전략의 필요성을 시사한다.이처럼 노가펜데킨 알파 인바키셉트는 IL-15 생물학을 임상적으로 구현한 최초의 치료제로서 BCG 불응성 NMIBC라는 미충족 의료수요 영역에서 실질적인 치료 옵션을 제공하고 있다.초기 반응률과 독성 프로파일은 고무적이지만, 단일군 연구 설계, 병용요법의 기여도 분리 문제, 반응 지속성의 제한, 장기 추적자료 부족 등은 여전히 해결해야 할 과제로 남아 있다.그럼에도 불구하고 노가펜데킨 알파 인바키셉트는 기존 치료제와는 차별화된 기전을 바탕으로 난치성 NMIBC에서 방광보존 전력을 확장할 수 있는 중요한 면역치료제로 자리매김할 가능성이 높으며, 향후 병용 전략, 내성 기전 규명, 예측 바이오마커 개발 등을 통해 그 임상적 가치가 더욱 강화될 것으로 기대된다.참고문헌 1. Grace Lui et al. “Exploiting an Interleukin-15 Heterodimeric Agonist (N803) for Effective Immunotherapy of Solid Malignancies” Cells 2023, 12(12), 1611. 3. Richard S et al. “Non& 8211;muscle-invasive Bladder Cancer: Overview and Contemporary Treatment Landscape of Neoadjuvant Chemoablative Therapies” Reviews in Urology, Vol. 22 No. 2 2020. 3. Jong Ho Park et al. “The Emerging Treatment of BCG (Bacillus Calmette-Gu& 233;rin)- Unresponsive Non& 8211;Muscle-Invasive Bladder Cancer“ Journal of Urologic Oncology 2024;22(3):246-255. 4. Aiman Waheed et al. “Nogapendekin alfa inbakicept-PMLN: first approval milestone for BCG-unresponsive noninvasive bladder cancer: editorial” Annals of Medicine & Surgery (2024) 86:6386& 8211;6388. 5. Brian L. Heiss et al. “FDA Approval Summary: Nogapendekin Alfa Inbakicept-pmln with BCG for BCG-unresponsive carcinoma in situ” Clin Cancer Res. 2025 October 15; 31(20): 4223& 8211;4229. 6. Vikram M et al. “Mechanism of action of nadofaragene firadenovec-vncg” Front. Oncol. 14:1359725. 7. 기타 인터넷 자료(보도 자료, 제품 설명서 등)2025-11-20 17:29:43최병철 박사 -
 루닛, 미국 진단시장 1위 랩콥과 전략적 협업[데일리팜=황병우 기자] 루닛은 글로벌 진단·임상시험 서비스 업계 리딩 기업인 랩콥(Labcorp)과 AI 기반 디지털병리 분야 협력을 위한 전략적 파트너십을 체결했다고 18일 밝혔다.양사는 최근 미국에서 열린 미국면역항암학회(SITC 2025)와 미국분자병리학회(AMP 2025)에서 첫 공동연구 성과를 발표하며 협력을 공식화했다.랩콥은 미국 노스캐롤라이나에 본사를 둔 글로벌 진단·임상시험 서비스 업계 1위 기업으로, 시가총액 221억 달러(약 32조원), 지난해 연매출 130억 달러(약 19조원) 규모를 자랑한다.100여 개국에서 7만여 명의 직원이 연간 7억 건 이상의 진단 검사를 수행하고 있으며, 미국 식품의약국(FDA)에 승인된 다수의 신약과 치료제 개발 과정에 임상시험과 분석 서비스를 제공한 글로벌 대표 기업이다.이번 협력은 랩콥의 방대한 임상 및 병리학 전문성과 루닛의 첨단 AI 알고리즘을 결합해 종양미세환경(Tumor Microenvironment) 분석 방식을 획기적으로 개선, 면역항암제 반응을 예측하는 바이오마커 발굴을 가속화하는 데 목적이 있다.양사의 첫 협업 성과는 비소세포폐암(NSCLC) 환자의 MET 변이 유형에 따른 종양미세환경 특성을 규명한 연구로, 두 개의 주요 글로벌 학회에서 연이어 발표됐다.먼저 SITC 2025에서 루닛-랩콥 공동 연구진은 루닛 스코프 IO를 활용해 MET 엑손 14 결손 환자, MET 증폭 환자, MET 변이가 없는 환자 등 총 371명의 병리 슬라이드를 분석하고, 각 변이 유형에 따른 면역항암제 치료 반응 효과를 분류했다.또한 AMP 2025에서도 루닛 스코프 IO를 활용한 분석을 통해 MET 변이 유형에 따라 비소세포폐암 환자의 종양미세환경이 뚜렷한 차이를 보이며, 면역항암제 치료 반응도 각각 다르게 나타남을 확인했다.양사는 두 건 연구를 통해 AI 기반 디지털병리 기술이 면역항암제 관련 연구에 기여할 수 있는 가능성을 확인했으며, 향후 리얼월드 데이터(RWD) 기반 대규모 연구 및 다른 암종으로 협력 범위를 확대할 계획이다.서범석 루닛 대표는 "랩콥과 같은 글로벌 리더로부터 인정받은 것은 루닛의 AI 기술이 종양학 분야 실제 임상 현장에서 광범위하게 활용될 수 있는 중요한 발판이 될 것"이라며 "AI와 디지털병리의 결합은 연구 단계에서 얻은 인사이트를 실제 치료 관련 의사결정으로 자연스럽게 이어지게 하는 핵심 동력이 될 것"이라고 말했다.샤크티 람키순(Shakti Ramkissoon) 랩콥 종양학부문 의학총괄은 "루닛과 함께 방대하고 복잡한 병리 데이터 속에서 의미있는 임상적 가치를 이끌어내길 기대한다"며 "이번 연구는 AI 기반 디지털병리 기술이 종양의 특성을 정확히 파악하고 맞춤형 치료 전략을 설계하는 데 도움을 줄 수 있음을 보여줬다"고 말했다.한편, 루닛과 랩콥은 이번 긍정적인 연구 결과를 바탕으로 다양한 암종으로 공동연구 범위를 확대하고, 면역항암제 개발 지원·바이오마커 발굴·동반진단 등 글로벌 제약사와의 협업 모델로 확장할 방침이다.2025-11-18 10:49:15황병우
루닛, 미국 진단시장 1위 랩콥과 전략적 협업[데일리팜=황병우 기자] 루닛은 글로벌 진단·임상시험 서비스 업계 리딩 기업인 랩콥(Labcorp)과 AI 기반 디지털병리 분야 협력을 위한 전략적 파트너십을 체결했다고 18일 밝혔다.양사는 최근 미국에서 열린 미국면역항암학회(SITC 2025)와 미국분자병리학회(AMP 2025)에서 첫 공동연구 성과를 발표하며 협력을 공식화했다.랩콥은 미국 노스캐롤라이나에 본사를 둔 글로벌 진단·임상시험 서비스 업계 1위 기업으로, 시가총액 221억 달러(약 32조원), 지난해 연매출 130억 달러(약 19조원) 규모를 자랑한다.100여 개국에서 7만여 명의 직원이 연간 7억 건 이상의 진단 검사를 수행하고 있으며, 미국 식품의약국(FDA)에 승인된 다수의 신약과 치료제 개발 과정에 임상시험과 분석 서비스를 제공한 글로벌 대표 기업이다.이번 협력은 랩콥의 방대한 임상 및 병리학 전문성과 루닛의 첨단 AI 알고리즘을 결합해 종양미세환경(Tumor Microenvironment) 분석 방식을 획기적으로 개선, 면역항암제 반응을 예측하는 바이오마커 발굴을 가속화하는 데 목적이 있다.양사의 첫 협업 성과는 비소세포폐암(NSCLC) 환자의 MET 변이 유형에 따른 종양미세환경 특성을 규명한 연구로, 두 개의 주요 글로벌 학회에서 연이어 발표됐다.먼저 SITC 2025에서 루닛-랩콥 공동 연구진은 루닛 스코프 IO를 활용해 MET 엑손 14 결손 환자, MET 증폭 환자, MET 변이가 없는 환자 등 총 371명의 병리 슬라이드를 분석하고, 각 변이 유형에 따른 면역항암제 치료 반응 효과를 분류했다.또한 AMP 2025에서도 루닛 스코프 IO를 활용한 분석을 통해 MET 변이 유형에 따라 비소세포폐암 환자의 종양미세환경이 뚜렷한 차이를 보이며, 면역항암제 치료 반응도 각각 다르게 나타남을 확인했다.양사는 두 건 연구를 통해 AI 기반 디지털병리 기술이 면역항암제 관련 연구에 기여할 수 있는 가능성을 확인했으며, 향후 리얼월드 데이터(RWD) 기반 대규모 연구 및 다른 암종으로 협력 범위를 확대할 계획이다.서범석 루닛 대표는 "랩콥과 같은 글로벌 리더로부터 인정받은 것은 루닛의 AI 기술이 종양학 분야 실제 임상 현장에서 광범위하게 활용될 수 있는 중요한 발판이 될 것"이라며 "AI와 디지털병리의 결합은 연구 단계에서 얻은 인사이트를 실제 치료 관련 의사결정으로 자연스럽게 이어지게 하는 핵심 동력이 될 것"이라고 말했다.샤크티 람키순(Shakti Ramkissoon) 랩콥 종양학부문 의학총괄은 "루닛과 함께 방대하고 복잡한 병리 데이터 속에서 의미있는 임상적 가치를 이끌어내길 기대한다"며 "이번 연구는 AI 기반 디지털병리 기술이 종양의 특성을 정확히 파악하고 맞춤형 치료 전략을 설계하는 데 도움을 줄 수 있음을 보여줬다"고 말했다.한편, 루닛과 랩콥은 이번 긍정적인 연구 결과를 바탕으로 다양한 암종으로 공동연구 범위를 확대하고, 면역항암제 개발 지원·바이오마커 발굴·동반진단 등 글로벌 제약사와의 협업 모델로 확장할 방침이다.2025-11-18 10:49:15황병우 -
 로슈진단, 림프종 진단 기술 '벤타나 카파람다' 급여 등재대한병리학회 부스에서 로슈진단 병리진단 40주년을 축하하고 있다 [데일리팜=황병우 기자] 한국로슈진단은 혈액병리 진단 신기술인 'VENTANA Kappa and Lambda Dual ISH mRNA Probe Cocktail (이하 벤타나 카파람다)'이 최근 보험 급여 적용 대상으로 등재됐다고 4일 밝혔다.이번 급여 결정은 기존 SISH(Silver In Situ Hybridization) 기술을 준용해 신속하게 급여가 적용됐다는 점에서 의미가 크다.회사는 제품의 임상적 혁신성과 기술적 우수성이 공식적으로 인정받은 결과인 만큼 혁신 기술의 조기 의료기관 도입 및 신뢰성 확보하는 중요한 계기가 됐다는 평가다.벤타나 카파람다는 이중 염색 기반 혈액 병리 제품으로 하나의 슬라이드에서 Kappa와 Lambda 경쇄를 동시에 분석할 수 있는 초민감 ISH 기술로, B세포 림프종 환자 또는 의심 환자에서 높은 민감도의 클론성(clonality) 분석을 구현한다. 이를 통해 기존 진단법의 한계를 보완하고, 림프종 진단의 정확성과 효율성을 향상시킬 수 있다.지난 10월 30일부터 31일에 열린 2025 대한병리학회 가을학술대회에서는 해당 기술을 주제로 한 런천 심포지엄을 개최하기도 했다.개최된 런천 심포지엄에서는 ‘림프종 진단에서 클론성 분석의 역할: VENTANA Kappa and Lambda Dual ISH 검사 소개’라는 주제로 미국 메이요 클리닉의 사라 E. 깁슨 교수(Sarah E. Gibson , Mayo Clinic Arizona)와 조준훈 교수(삼성서울병원)가 발표를 맡아, Dual ISH 기술의 임상적 가치와 실제 사례를 중심으로 한 진단적 유용성을 공유했다.병리학 전문가들의 높은 관심 속에 진행된 이번 세션은, 해당 기술이 국내 병리학적 진단 과정에서 임상적으로 신뢰할 수 있는 새로운 옵션으로 자리매김할 수 있음을 확인하는 자리였다.또 이번 행사는 로슈진단의 병리진단 솔루션 브랜드인 벤타나 탄생의 40주년을 기념하는 의미 있는 자리로, 로슈진단은 지난 40년간 축적된 병리 진단 기술력과 혁신의 역사를 돌아보며, 정밀의학 시대를 선도하는 기업으로서의 비전을 다시 한번 강조했다.킷 탕 한국로슈진단 대표이사는 "이번 보험 급여 적용은 환자와 의료기관이 보다 신속하고 정확한 진단 혁신 기술에 접근할 수 있게 하기 위한 노력의 결실이다"며 "이를 통해 진단이 어려웠던 림프종 의심 환자들에게 새로운 희망적 옵션을 제공할 수 있게 되어 있게 되어 매우 뜻깊게 생각한다"고 밝혔다.그는 이어 "앞으로도 대한병리학회와의 긴밀한 학술 파트너십을 기반으로활발한 지식 교류를 이어가며, 림프종을 비롯한 질환을 보다 조기에, 보다 정확하게 진단할 수 있도록 지원함으로써, 임상 의사결정의 질을 높이고, 지역 의료 체계 강화와 환자 치료 결과 개선에 지속적으로 기여하겠다"라고 덧붙였다.2025-11-04 16:19:31황병우
로슈진단, 림프종 진단 기술 '벤타나 카파람다' 급여 등재대한병리학회 부스에서 로슈진단 병리진단 40주년을 축하하고 있다 [데일리팜=황병우 기자] 한국로슈진단은 혈액병리 진단 신기술인 'VENTANA Kappa and Lambda Dual ISH mRNA Probe Cocktail (이하 벤타나 카파람다)'이 최근 보험 급여 적용 대상으로 등재됐다고 4일 밝혔다.이번 급여 결정은 기존 SISH(Silver In Situ Hybridization) 기술을 준용해 신속하게 급여가 적용됐다는 점에서 의미가 크다.회사는 제품의 임상적 혁신성과 기술적 우수성이 공식적으로 인정받은 결과인 만큼 혁신 기술의 조기 의료기관 도입 및 신뢰성 확보하는 중요한 계기가 됐다는 평가다.벤타나 카파람다는 이중 염색 기반 혈액 병리 제품으로 하나의 슬라이드에서 Kappa와 Lambda 경쇄를 동시에 분석할 수 있는 초민감 ISH 기술로, B세포 림프종 환자 또는 의심 환자에서 높은 민감도의 클론성(clonality) 분석을 구현한다. 이를 통해 기존 진단법의 한계를 보완하고, 림프종 진단의 정확성과 효율성을 향상시킬 수 있다.지난 10월 30일부터 31일에 열린 2025 대한병리학회 가을학술대회에서는 해당 기술을 주제로 한 런천 심포지엄을 개최하기도 했다.개최된 런천 심포지엄에서는 ‘림프종 진단에서 클론성 분석의 역할: VENTANA Kappa and Lambda Dual ISH 검사 소개’라는 주제로 미국 메이요 클리닉의 사라 E. 깁슨 교수(Sarah E. Gibson , Mayo Clinic Arizona)와 조준훈 교수(삼성서울병원)가 발표를 맡아, Dual ISH 기술의 임상적 가치와 실제 사례를 중심으로 한 진단적 유용성을 공유했다.병리학 전문가들의 높은 관심 속에 진행된 이번 세션은, 해당 기술이 국내 병리학적 진단 과정에서 임상적으로 신뢰할 수 있는 새로운 옵션으로 자리매김할 수 있음을 확인하는 자리였다.또 이번 행사는 로슈진단의 병리진단 솔루션 브랜드인 벤타나 탄생의 40주년을 기념하는 의미 있는 자리로, 로슈진단은 지난 40년간 축적된 병리 진단 기술력과 혁신의 역사를 돌아보며, 정밀의학 시대를 선도하는 기업으로서의 비전을 다시 한번 강조했다.킷 탕 한국로슈진단 대표이사는 "이번 보험 급여 적용은 환자와 의료기관이 보다 신속하고 정확한 진단 혁신 기술에 접근할 수 있게 하기 위한 노력의 결실이다"며 "이를 통해 진단이 어려웠던 림프종 의심 환자들에게 새로운 희망적 옵션을 제공할 수 있게 되어 있게 되어 매우 뜻깊게 생각한다"고 밝혔다.그는 이어 "앞으로도 대한병리학회와의 긴밀한 학술 파트너십을 기반으로활발한 지식 교류를 이어가며, 림프종을 비롯한 질환을 보다 조기에, 보다 정확하게 진단할 수 있도록 지원함으로써, 임상 의사결정의 질을 높이고, 지역 의료 체계 강화와 환자 치료 결과 개선에 지속적으로 기여하겠다"라고 덧붙였다.2025-11-04 16:19:31황병우 -
 "펜타칸설하정, 암 환자 돌발통 관리에 효과적"[데일리팜=이석준 기자] 한국팜비오(회장 남봉길)는 최근 그랜드조선부산호텔에서 ‘혈액종양학(HEMATO-ONCOLOGY) 분야에서의 최적 치료 전략과 암 환자의 삶의 질(QoL) 향상’을 주제로 제2회 힐링 심포지엄(Healing Symposium)을 개최했다고 4일 밝혔다.이번 심포지엄은 암성 통증 관리, 항암화학요법, 지지요법 등 암 환자 치료의 주요 임상 영역을 중심으로 최신 치료 근거와 실제 임상 경험을 공유하기 위해 마련됐다.첫날 세션은 장대영 교수(한림대학교성심병원)와 강정훈 교수(진주경상대병원)가 좌장을 맡아 진행했다. 두 교수는 종양내과 분야의 전문가로, 암 환자의 통증 관리와 항암치료 전략을 통합적으로 다뤘다.이날 프랑스 님 대학병원(University Hospital of N& 238;mes)의 에릭 비엘(Eric J. Viel) 교수는 ‘빠르게 작용하는 오피오이드의 약리학적 특성(Pharmacology of Rapid-Onset Opioids)’을 주제로 강연을 진행했다.에릭 비엘 교수는 돌발성 암성 통증(Breakthrough Cancer Pain, 돌발통)의 임상적 특성과 함께, 설하 투여 경로를 통한 속효성 아편유사제(Rapid-Onset Opioid)의 치료적 가치를 제시했다.에릭 비엘 교수는 “암 환자의 약 30%가 통증을 주요 증상으로 병원을 찾으며, 그 중 다수가 기저 통증이 조절된 상태에서도 갑작스럽고 일시적인 통증 악화를 경험한다. 돌발통은 발현이 빠르고 지속 시간이 짧기 때문에, 통증 발현 속도에 신속히 대응하는 것이 치료의 핵심”이라고 강조했다.이어 설하 펜타닐 제제(펜타칸® 설하정)의 임상 연구 결과를 소개했다.그는 “이 제제는 투여 후 6분 이내에 작용이 시작되고 약 60분간 효과가 유지되는 속효성 제형으로, 환자가 스스로 통증을 조절할 수 있는 유연한 치료 옵션이다. 돌발통 치료는 점막을 통해 흡수되는 경로가 가장 효과적”이라고 밝혔다.이 경로는 간 대사과정을 거치지 않으면서 생체이용률을 높이고, 정맥주사에 준할 정도로 효과가 빠르다. 펜타닐은 높은 지질 용해도로 혈액-뇌 장벽을 신속히 통과해 수 분 내 진통 효과를 발현시킨다.좌장을 맡은 장대영 교수는 “펜타닐 설하정은 다층 구조로 설계되어 있는데, 효과가 이미 나타났음에도 불구하고 코어층을 계속 물고 있는 환자들이 많다”며 “이러한 오해를 줄이기 위해 정확한 복용 교육이 중요하다”고 강조했다.같은 세션에서 서울성모병원 박송이 교수는 ‘암성 통증 관리에서 펜타닐 패치의 최신 글로벌 가이드라인과 임상적 유용성’을 발표했다.박 교수는 펜타닐 패치가 일정한 약물 농도를 유지해 기저 통증을 효과적으로 조절하고, 환자의 복약 순응도 및 삶의 질 향상에 기여한다고 설명했다.이후 영남대병원 고성애 교수와 창원한마음병원 오소연 교수가 각각 대장암과 췌장암 치료의 최신 항암화학요법 동향을 공유했다.항암치료 세션은 이명아 교수(서울성모병원)와 심선진 교수(가천대길병원)가 좌장으로 참여해, 고령 환자 및 고위험군에서의 맞춤형 치료 전략을 중심으로 논의를 이끌었다.둘째 날에는 신성훈 교수(고신대병원)와 손상균 교수(경북대병원)가 좌장으로 참여해, 암 환자의 삶의 질(QoL) 향상을 위한 지지요법 중심의 세션을 진행했다.용인세브란스병원 홍문기 교수는 항암화학요법 유발 빈혈 치료에서 모노퍼(Monofer)의 역할을 발표했다. 홍 교수는 “철분 결핍성 빈혈은 환자의 피로감, 치료 순응도, 생존율에 영향을 미치는 만큼 IV 철분 치료의 임상적 중요성이 커지고 있다”고 설명했다.이어 한양대병원 원영웅 교수는 엘트롬보팍 올라민(Eltrombopag Olamine)의 임상적 유용성을 발표하며, 화학요법 유발 혈소판감소증(CIT) 환자에서 항암제 용량 유지율 개선과 삶의 질 향상에 기여할 수 있음을 제시했다.남봉길 한국팜비오 회장은 “이번 힐링 심포지엄은 암성 통증, 항암치료, 지지요법 등 다양한 임상 분야의 전문가들이 최신 치료 지견을 공유하며, 암 환자의 삶의 질 향상을 위해 함께 고민한 뜻깊은 자리였다. 한국팜비오는 앞으로도 의료진과 긴밀히 협력해 암 환자의 치료 환경 개선과 임상 지원에 지속적으로 힘쓸 것”이라고 밝혔다.2025-11-04 09:58:34이석준
"펜타칸설하정, 암 환자 돌발통 관리에 효과적"[데일리팜=이석준 기자] 한국팜비오(회장 남봉길)는 최근 그랜드조선부산호텔에서 ‘혈액종양학(HEMATO-ONCOLOGY) 분야에서의 최적 치료 전략과 암 환자의 삶의 질(QoL) 향상’을 주제로 제2회 힐링 심포지엄(Healing Symposium)을 개최했다고 4일 밝혔다.이번 심포지엄은 암성 통증 관리, 항암화학요법, 지지요법 등 암 환자 치료의 주요 임상 영역을 중심으로 최신 치료 근거와 실제 임상 경험을 공유하기 위해 마련됐다.첫날 세션은 장대영 교수(한림대학교성심병원)와 강정훈 교수(진주경상대병원)가 좌장을 맡아 진행했다. 두 교수는 종양내과 분야의 전문가로, 암 환자의 통증 관리와 항암치료 전략을 통합적으로 다뤘다.이날 프랑스 님 대학병원(University Hospital of N& 238;mes)의 에릭 비엘(Eric J. Viel) 교수는 ‘빠르게 작용하는 오피오이드의 약리학적 특성(Pharmacology of Rapid-Onset Opioids)’을 주제로 강연을 진행했다.에릭 비엘 교수는 돌발성 암성 통증(Breakthrough Cancer Pain, 돌발통)의 임상적 특성과 함께, 설하 투여 경로를 통한 속효성 아편유사제(Rapid-Onset Opioid)의 치료적 가치를 제시했다.에릭 비엘 교수는 “암 환자의 약 30%가 통증을 주요 증상으로 병원을 찾으며, 그 중 다수가 기저 통증이 조절된 상태에서도 갑작스럽고 일시적인 통증 악화를 경험한다. 돌발통은 발현이 빠르고 지속 시간이 짧기 때문에, 통증 발현 속도에 신속히 대응하는 것이 치료의 핵심”이라고 강조했다.이어 설하 펜타닐 제제(펜타칸® 설하정)의 임상 연구 결과를 소개했다.그는 “이 제제는 투여 후 6분 이내에 작용이 시작되고 약 60분간 효과가 유지되는 속효성 제형으로, 환자가 스스로 통증을 조절할 수 있는 유연한 치료 옵션이다. 돌발통 치료는 점막을 통해 흡수되는 경로가 가장 효과적”이라고 밝혔다.이 경로는 간 대사과정을 거치지 않으면서 생체이용률을 높이고, 정맥주사에 준할 정도로 효과가 빠르다. 펜타닐은 높은 지질 용해도로 혈액-뇌 장벽을 신속히 통과해 수 분 내 진통 효과를 발현시킨다.좌장을 맡은 장대영 교수는 “펜타닐 설하정은 다층 구조로 설계되어 있는데, 효과가 이미 나타났음에도 불구하고 코어층을 계속 물고 있는 환자들이 많다”며 “이러한 오해를 줄이기 위해 정확한 복용 교육이 중요하다”고 강조했다.같은 세션에서 서울성모병원 박송이 교수는 ‘암성 통증 관리에서 펜타닐 패치의 최신 글로벌 가이드라인과 임상적 유용성’을 발표했다.박 교수는 펜타닐 패치가 일정한 약물 농도를 유지해 기저 통증을 효과적으로 조절하고, 환자의 복약 순응도 및 삶의 질 향상에 기여한다고 설명했다.이후 영남대병원 고성애 교수와 창원한마음병원 오소연 교수가 각각 대장암과 췌장암 치료의 최신 항암화학요법 동향을 공유했다.항암치료 세션은 이명아 교수(서울성모병원)와 심선진 교수(가천대길병원)가 좌장으로 참여해, 고령 환자 및 고위험군에서의 맞춤형 치료 전략을 중심으로 논의를 이끌었다.둘째 날에는 신성훈 교수(고신대병원)와 손상균 교수(경북대병원)가 좌장으로 참여해, 암 환자의 삶의 질(QoL) 향상을 위한 지지요법 중심의 세션을 진행했다.용인세브란스병원 홍문기 교수는 항암화학요법 유발 빈혈 치료에서 모노퍼(Monofer)의 역할을 발표했다. 홍 교수는 “철분 결핍성 빈혈은 환자의 피로감, 치료 순응도, 생존율에 영향을 미치는 만큼 IV 철분 치료의 임상적 중요성이 커지고 있다”고 설명했다.이어 한양대병원 원영웅 교수는 엘트롬보팍 올라민(Eltrombopag Olamine)의 임상적 유용성을 발표하며, 화학요법 유발 혈소판감소증(CIT) 환자에서 항암제 용량 유지율 개선과 삶의 질 향상에 기여할 수 있음을 제시했다.남봉길 한국팜비오 회장은 “이번 힐링 심포지엄은 암성 통증, 항암치료, 지지요법 등 다양한 임상 분야의 전문가들이 최신 치료 지견을 공유하며, 암 환자의 삶의 질 향상을 위해 함께 고민한 뜻깊은 자리였다. 한국팜비오는 앞으로도 의료진과 긴밀히 협력해 암 환자의 치료 환경 개선과 임상 지원에 지속적으로 힘쓸 것”이라고 밝혔다.2025-11-04 09:58:34이석준 -
 약국, 외국인 고객 택스리펀 관심…핫플 중심 속속 가입[데일리팜=김지은 기자] K-뷰티에 힘입어 외국인 관광객의 약국 방문이 늘면서 부가가치세 사후 환급(택스리펀)에 대한 지역 약국들의 관심도 늘고 있다.약국의 경우 외국인 관광객이 일반약이나 건기식, 의약외품 등을 구매하면 택스리펀을 받을 수 있다.수년 전에도 중국인 관광객 등의 약국 방문이 늘면서 서울 명동, 강남구 내 일부 약국에서 택스리펀을 도입하기도 했었지만 크게 확대되지는 않았었다.하지만 최근 K-뷰티 속 약국 화장품에 대한 외국인의 관심이 늘면서 소위 ‘핫플’ 지역 약국을 중심으로 택스리펀에 대한 관심이 또 다시 높아지고 있는 것. 서울 명동, 강남, 송파, 성동 지역의 약국이 주요 대상이다.이에 지역 약사회가 나서서 회원 약사들의 약국 경영 활성화 차원에서 관련 업체와 협약을 맺는 곳들도 있다.서울 송파구약사회는 지난 8월 텍스리펀 업체인 KTP와 업무협약을 맺었다. 분회가 협약을 맺은 업체는 중부지방 국세청 1호 환급 창구 운영사다.송파구는 월드타워, 롯데월드, 올림픽공원 공연장 등 외국인 관광객의 방문이 많은 지역이 위치해 있는 만큼, 협약을 통해 약국의 개별 비용 부담 없이 휴대폰 앱으로 실시간 부가세 할인을 적용하는 서비스를 제공하겠다는 취지다.구약사회는 내달 진행되는 회원 약사 대상 연수교육 중에도 텍스리펀 제도에 대해 소개하는 시간을 마련했다. 구약사회 관계자는 “우리 지역의 경우 잠실을 중심으로 외국인 관광객이 많이 몰리고 있다. 이 지역 약국 20여곳에서 이번 시스템을 도입했다”며 “약국에서 물품 구입 시 간단한 확인 후 부가세를 환급 받을 수 있는 제도를 도입하기로 한 것“이라고 말했다.서울시약사회도 크레소티와 외국인 방문객의 약국 면세 즉시환급 서비스 제공을 위한 업무협약을 체결했다.약국에서 크레소티 POS 시스템 캣포스와 팜페이 단말기를 활용해 외국인 고객 대상 즉시 환급 택스리펀 서비스를 제공할 수 있게 하는 방식이다.즉시환급은 외국인 관광객이 물품 구매 시점에 환급액을 차감한 가격으로 결제하는 방식으로, 약국은 고객 유입을 위한 홍보 효과와 할인된 금액으로 인한 추가 구매 유도 효과를 기대할 수 있다는게 지부와 업체 측 설명이다.김위학 회장은 “최근 K-팝, K-드라마, K-뷰티, K-헬스 제품 등에 대한 글로벌 관심이 높아지면서 한국을 찾는 외국인 관광객과 환자가 증가하고 있다”며 “약국에서 늘어나는 외국인 수요에 발맞춰 보다 편리하고 신뢰도 높은 서비스가 필요하다는 판단에서 협약을 진행했다”고 말했다.김 회장은 “회원 약국의 경영 환경 개선은 물론 외국인 고객에도 신뢰 받는 약국 서비스를 제공하는데 좋은 기회가 될 것으로 기대한다”고 했다.2025-10-31 11:10:48김지은
약국, 외국인 고객 택스리펀 관심…핫플 중심 속속 가입[데일리팜=김지은 기자] K-뷰티에 힘입어 외국인 관광객의 약국 방문이 늘면서 부가가치세 사후 환급(택스리펀)에 대한 지역 약국들의 관심도 늘고 있다.약국의 경우 외국인 관광객이 일반약이나 건기식, 의약외품 등을 구매하면 택스리펀을 받을 수 있다.수년 전에도 중국인 관광객 등의 약국 방문이 늘면서 서울 명동, 강남구 내 일부 약국에서 택스리펀을 도입하기도 했었지만 크게 확대되지는 않았었다.하지만 최근 K-뷰티 속 약국 화장품에 대한 외국인의 관심이 늘면서 소위 ‘핫플’ 지역 약국을 중심으로 택스리펀에 대한 관심이 또 다시 높아지고 있는 것. 서울 명동, 강남, 송파, 성동 지역의 약국이 주요 대상이다.이에 지역 약사회가 나서서 회원 약사들의 약국 경영 활성화 차원에서 관련 업체와 협약을 맺는 곳들도 있다.서울 송파구약사회는 지난 8월 텍스리펀 업체인 KTP와 업무협약을 맺었다. 분회가 협약을 맺은 업체는 중부지방 국세청 1호 환급 창구 운영사다.송파구는 월드타워, 롯데월드, 올림픽공원 공연장 등 외국인 관광객의 방문이 많은 지역이 위치해 있는 만큼, 협약을 통해 약국의 개별 비용 부담 없이 휴대폰 앱으로 실시간 부가세 할인을 적용하는 서비스를 제공하겠다는 취지다.구약사회는 내달 진행되는 회원 약사 대상 연수교육 중에도 텍스리펀 제도에 대해 소개하는 시간을 마련했다. 구약사회 관계자는 “우리 지역의 경우 잠실을 중심으로 외국인 관광객이 많이 몰리고 있다. 이 지역 약국 20여곳에서 이번 시스템을 도입했다”며 “약국에서 물품 구입 시 간단한 확인 후 부가세를 환급 받을 수 있는 제도를 도입하기로 한 것“이라고 말했다.서울시약사회도 크레소티와 외국인 방문객의 약국 면세 즉시환급 서비스 제공을 위한 업무협약을 체결했다.약국에서 크레소티 POS 시스템 캣포스와 팜페이 단말기를 활용해 외국인 고객 대상 즉시 환급 택스리펀 서비스를 제공할 수 있게 하는 방식이다.즉시환급은 외국인 관광객이 물품 구매 시점에 환급액을 차감한 가격으로 결제하는 방식으로, 약국은 고객 유입을 위한 홍보 효과와 할인된 금액으로 인한 추가 구매 유도 효과를 기대할 수 있다는게 지부와 업체 측 설명이다.김위학 회장은 “최근 K-팝, K-드라마, K-뷰티, K-헬스 제품 등에 대한 글로벌 관심이 높아지면서 한국을 찾는 외국인 관광객과 환자가 증가하고 있다”며 “약국에서 늘어나는 외국인 수요에 발맞춰 보다 편리하고 신뢰도 높은 서비스가 필요하다는 판단에서 협약을 진행했다”고 말했다.김 회장은 “회원 약국의 경영 환경 개선은 물론 외국인 고객에도 신뢰 받는 약국 서비스를 제공하는데 좋은 기회가 될 것으로 기대한다”고 했다.2025-10-31 11:10:48김지은 -
 용산 700평 초대형약국 내년 1월 오픈…내·외국인 타깃[데일리팜=강혜경 기자] 서울 용산 소재 700평 규모 창고형 약국이 내년 1월 오픈을 목표로 본격적인 개설 준비에 돌입했다.지난달 불거졌던 소문이 마침내 구체화되고 있는 것이다. 위치는 전자랜드 내부로, 오픈 예정일은 내년 1월 26일이 유력하다.내년 1월 오픈을 목표로 전자랜드 내 약국 개설이 준비 중이다. 타깃은 내외국인을 모두 대상으로 하고 있다. 기존 창고형 약국이 내국인을 주 타깃으로 하는 것과는 다른 행보다.용산의 지역적 특성상 외국인이 많고 호텔과 카지노 등이 위치해 있고, 맞은 편 별관 역시 호텔로 재건립될 예정이라는 것이다. K-뷰티로 인해 K-약국에 대한 관심 역시 높아지면서 최근 명동, 홍대 등 상권에 들어서고 있는 외국인 대상 약국의 형태를 목표로 한다는 분석이 나오고 있다.여기에 서울의 중심이라는 점과 KTX 용산역이 인접해 있어 전국구가 될 수 있다는 가능성도 나오고 있다.약국가는 700평이라는 규모 자체가 지니는 파급력이 상당할 것으로 내다보고 있다. 기존 국내 최대 규모 창고형 약국인 전북 전주 메디플러스약국이 370평이라는 점을 감안할 때 구비하는 의약품·의약외품 등이 상당할 것이라는 전망이다. 다만 실평수는 350평 규모로 전해졌다.개설자는 아직까지 구체화되지 않았다. 다만 현재까지 취재를 종합해 보면 서울 남대문 지역에서 약국을 운영하는 약사 등이 법인을 출자해 전자랜드 측과 계약을 진행, 전대 방식으로 임대차를 주는 방식이 될 것이라는 데 무게가 쏠리고 있다.제1호 창고형 약국인 메가팩토리약국이 종로5가에서 약국을 운영하던 약사였던 것 처럼, 이를 착안했을 가능성이 농후하다는 것.약국이 들어올 자리 입점해 있는 업체들이 이달과 내달 순차적으로 이전한다. 약국이 들어설 부지 내 매장들도 이전을 시작했다. 용산캐논서비스센터는 10월 13일부터 신관 광장층으로 매장을 이전했으며 시그마·리코 용산서비스센터 역시 신관으로 이전했다.타건샵 역시 11월부로 확장 이전 오픈한다고 안내에 나섰다.700평 약국이 개설되면 전자랜드 내 유일한 약국 역시 경영에 직접적인 타격을 입게 될 전망이다.700평 창고형 약국이 들어올 자리. 주변 약사는 "지역 내 약국은 물론 인접해 있는 지역까지도 영향이 불가피해 보인다"며 "더욱이 기존에 남대문 시장 내에서 약국을 운영하고 있는 약사가 관여해 있는 만큼 판매가격을 놓고도 고심이 커질 수밖에 없을 것"이라고 전망했다.지역 약사회 등도 상황을 주시하며 대책을 마련하고 있는 것으로 알려졌다.지역 약사회 관계자 역시 "주차 등이 용이하고 KTX역 등이 인접해 있다는 점이 장점으로 작용하면서 서울 지역 내 랜드마크가 될 것이라는 의견과 기대만큼의 성과를 보기는 어려울 것이라는 의견이 나뉘고 있다"면서 "창고형 약국이 주변 약국 생태계에도 직접적인 영향을 끼칠 수 있는 만큼 대응책 등을 논의하고 있다"고 전했다.복지부는 지난 국감에서 창고형 약국과 관련해 '미래형 약국으로 보기에는 한계가 있다'며 연내 관련 규제 강화를 추진하겠다고 밝혀 첫 번째 영향권에 드는 게 아니냐는 가능성도 제기되고 있다.복지부는 "현행 약사법상 창고형 약국에 대한 별도 정의가 없어 현황 파악에 한계가 있다. 언론에서 보도되는 창고형 약국의 특징 중 약국의 규모·면적이 클 뿐만 아니라 처방전 조제 여부, 의약품 진열 및 판매 방식 등에 대해서도 종합적으로 고려해 창고형 약국에 대한 정의가 선행될 필요가 있다"는 입장을 밝힌 바 있다.창고형 약국은 법적으로 적법하게 개설된 약국이지만, 약사의 핵심 업무 중 하나인 처방 약 조제를 담당하지 않는 경우가 많아 미래형 약국으로 보기엔 한계가 있다는 해석이다.대량 구매와 오남용 우려에 대해서도 "모든 소비자가 창고형 약국 방문으로 의약품 대량 구입, 오남용 한다고 단정하기는 어려우나 일부 소비자는 필요 이상으로 의약품을 구입해 오남용할 수 있는 개연성이 있다고 생각한다"며 "약국의 표시·광고, 명칭 제한을 추진하고 추가적인 제도개선 방안에 대해 약사회 등과 적극 소통할 계획"이라고 강조했다.한편 지난 달 전자랜드는 창고형 약국 개설에 대해 "관련 문의들만 있는 상황"이라며 "현재로서는 창고형 약국을 개설할 물리적 공간이 나와 있지는 않다"고 답변한 바 있다.2025-10-27 14:32:44강혜경
용산 700평 초대형약국 내년 1월 오픈…내·외국인 타깃[데일리팜=강혜경 기자] 서울 용산 소재 700평 규모 창고형 약국이 내년 1월 오픈을 목표로 본격적인 개설 준비에 돌입했다.지난달 불거졌던 소문이 마침내 구체화되고 있는 것이다. 위치는 전자랜드 내부로, 오픈 예정일은 내년 1월 26일이 유력하다.내년 1월 오픈을 목표로 전자랜드 내 약국 개설이 준비 중이다. 타깃은 내외국인을 모두 대상으로 하고 있다. 기존 창고형 약국이 내국인을 주 타깃으로 하는 것과는 다른 행보다.용산의 지역적 특성상 외국인이 많고 호텔과 카지노 등이 위치해 있고, 맞은 편 별관 역시 호텔로 재건립될 예정이라는 것이다. K-뷰티로 인해 K-약국에 대한 관심 역시 높아지면서 최근 명동, 홍대 등 상권에 들어서고 있는 외국인 대상 약국의 형태를 목표로 한다는 분석이 나오고 있다.여기에 서울의 중심이라는 점과 KTX 용산역이 인접해 있어 전국구가 될 수 있다는 가능성도 나오고 있다.약국가는 700평이라는 규모 자체가 지니는 파급력이 상당할 것으로 내다보고 있다. 기존 국내 최대 규모 창고형 약국인 전북 전주 메디플러스약국이 370평이라는 점을 감안할 때 구비하는 의약품·의약외품 등이 상당할 것이라는 전망이다. 다만 실평수는 350평 규모로 전해졌다.개설자는 아직까지 구체화되지 않았다. 다만 현재까지 취재를 종합해 보면 서울 남대문 지역에서 약국을 운영하는 약사 등이 법인을 출자해 전자랜드 측과 계약을 진행, 전대 방식으로 임대차를 주는 방식이 될 것이라는 데 무게가 쏠리고 있다.제1호 창고형 약국인 메가팩토리약국이 종로5가에서 약국을 운영하던 약사였던 것 처럼, 이를 착안했을 가능성이 농후하다는 것.약국이 들어올 자리 입점해 있는 업체들이 이달과 내달 순차적으로 이전한다. 약국이 들어설 부지 내 매장들도 이전을 시작했다. 용산캐논서비스센터는 10월 13일부터 신관 광장층으로 매장을 이전했으며 시그마·리코 용산서비스센터 역시 신관으로 이전했다.타건샵 역시 11월부로 확장 이전 오픈한다고 안내에 나섰다.700평 약국이 개설되면 전자랜드 내 유일한 약국 역시 경영에 직접적인 타격을 입게 될 전망이다.700평 창고형 약국이 들어올 자리. 주변 약사는 "지역 내 약국은 물론 인접해 있는 지역까지도 영향이 불가피해 보인다"며 "더욱이 기존에 남대문 시장 내에서 약국을 운영하고 있는 약사가 관여해 있는 만큼 판매가격을 놓고도 고심이 커질 수밖에 없을 것"이라고 전망했다.지역 약사회 등도 상황을 주시하며 대책을 마련하고 있는 것으로 알려졌다.지역 약사회 관계자 역시 "주차 등이 용이하고 KTX역 등이 인접해 있다는 점이 장점으로 작용하면서 서울 지역 내 랜드마크가 될 것이라는 의견과 기대만큼의 성과를 보기는 어려울 것이라는 의견이 나뉘고 있다"면서 "창고형 약국이 주변 약국 생태계에도 직접적인 영향을 끼칠 수 있는 만큼 대응책 등을 논의하고 있다"고 전했다.복지부는 지난 국감에서 창고형 약국과 관련해 '미래형 약국으로 보기에는 한계가 있다'며 연내 관련 규제 강화를 추진하겠다고 밝혀 첫 번째 영향권에 드는 게 아니냐는 가능성도 제기되고 있다.복지부는 "현행 약사법상 창고형 약국에 대한 별도 정의가 없어 현황 파악에 한계가 있다. 언론에서 보도되는 창고형 약국의 특징 중 약국의 규모·면적이 클 뿐만 아니라 처방전 조제 여부, 의약품 진열 및 판매 방식 등에 대해서도 종합적으로 고려해 창고형 약국에 대한 정의가 선행될 필요가 있다"는 입장을 밝힌 바 있다.창고형 약국은 법적으로 적법하게 개설된 약국이지만, 약사의 핵심 업무 중 하나인 처방 약 조제를 담당하지 않는 경우가 많아 미래형 약국으로 보기엔 한계가 있다는 해석이다.대량 구매와 오남용 우려에 대해서도 "모든 소비자가 창고형 약국 방문으로 의약품 대량 구입, 오남용 한다고 단정하기는 어려우나 일부 소비자는 필요 이상으로 의약품을 구입해 오남용할 수 있는 개연성이 있다고 생각한다"며 "약국의 표시·광고, 명칭 제한을 추진하고 추가적인 제도개선 방안에 대해 약사회 등과 적극 소통할 계획"이라고 강조했다.한편 지난 달 전자랜드는 창고형 약국 개설에 대해 "관련 문의들만 있는 상황"이라며 "현재로서는 창고형 약국을 개설할 물리적 공간이 나와 있지는 않다"고 답변한 바 있다.2025-10-27 14:32:44강혜경 -
 세계 첫 항체 무관 혈우병 A·B 치료제 '피투시란'큐피틀리아(Qfitlia, 성분명 피투시란, Fitusiran, 사노피)는 GalXC 기술 플랫폼을 기반으로 개발된 항트롬빈(antithrombin)을 표적으로 하는 소간섭 리보핵산(small interfering RNA, siRNA) 치료제다.이 약제는 2024년 유럽의약청(EMA) 에서, 이어 올해 3월 미국 식품의약국(FDA) 에서 제VIII인자 또는 제IX인자 억제인자(inhibitor)의 유무와 관계없이, 12세 이상 성인 및 소아 혈우병 A 또는 B 환자에서 출혈 에피소드의 발생을 예방하거나 빈도를 감소시키기 위한 정기적 예방요법(routine prophylaxis)에 ‘두 달에 한번 피하주사’로 승인되었다. 국내에서는 올해 5월 희귀의약품(Orphan drug) 으로 지정되었다.혈우병(hemophilia)은 X염색체 연관 열성 유전질환으로, 제Ⅷ인자(FVIII) 또는 제Ⅸ인자(FIX) 의 결핍으로 인해 혈액응고 연쇄반응(coagulation cascade) 이 정상적으로 진행되지 못하며, 그 결과 트롬빈(thrombin) 생성 부족으로 지혈(hemostasis) 이 저하된다. 이러한 병태생리적 이상은 반복적인 출혈, 특히 관절 출혈을 초래하여 만성 관절병증(chronic arthropathy) 및 삶의 질 저하로 이어진다.기존의 표준 치료는 응고인자제제(clotting factor concentrate, CFC) 의 정맥 내 투여를 통한 인자 보충요법(replacement therapy) 이었다. 그러나 이 방식은 정맥 투여의 불편성, 반복적 투여 부담, 그리고 항체(억제인자, inhibitor) 형성으로 인한 치료 저항성이라는 한계를 지닌다.이에 따라 최근에는 비(非)응고인자 기반 치료(non-factor therapy) 의 개발이 활발히 이루어지고 있으며, 그중에서도 RNA 간섭(RNA interference, RNAi) 기술을 이용한 피투시란(Fitusiran) 은 새로운 치료 옵션으로 주목 받고 있다.피투시란은 간세포 내에서 항트롬빈(antithrombin, AT) 합성을 억제하도록 설계된 siRNA 기반 치료제로, 내인성 응고 조절 인자의 발현을 조절함으로써 응고 균형(hemostatic balance) 을 회복시키는 새로운 접근법을 제시한다.피투시란의 승인은 다국가, 무작위배정, 대조, 3상 임상시험들로 구성된 ATLAS 임상 프로그램의 결과를 근거로 하였다.이 프로그램에는 ATLAS-A/B, ATLAS-INH, 그리고 ATLAS-PPX 연구가 포함되며, 각각 혈우병 A 또는 B 환자 중 인자 억제인자의 유무, 그리고 기존 예방요법(prophylaxis) 사용 여부에 따라 구분되었다.ATLAS-A/B 연구는 억제인자가 없는(non-inhibitor) 혈우병 A 또는 B 환자를 대상으로, ATLAS-INH 연구는 억제인자가 존재하는(inhibitor-positive) 환자를 대상으로 수행되었다. ATLAS-PPX 연구는 기존 예방요법을 받고 있던 환자에서 피투시란으로 전환했을 때의 출혈률 변화를 평가하였다.이들 연구에서 피투시란은 월 1회 피하주사(subcutaneous injection) 투여만으로도 연간 출혈률(annualized bleeding rate, ABR)을 기존 치료 대비 약 90% 이상 유의하게 감소시켰으며, 절반 이상의 환자에서 무출혈(ABR = 0)이 관찰되었다. 또한 억제인자 유무와 관계없이 일관된 출혈 억제 효과가 확인되었다.혈우병이란 무엇인가?혈우병(hemophilia)은 그리스어 ‘hemo(피)’와 ‘philia(사랑하다)’에서 유래한 용어로, 1828년 Sch& 246;nlein에 의해 H& 228;mophilie라 명명됐다. 19세기 말 유럽 왕실 내 근친혼으로 인해 영국, 스페인, 독일, 러시아 등 여러 나라에서 다수의 환자가 발생하면서 ‘왕실병(The Royal Disease)’이라는 별칭을 얻었다.혈우병은 혈액응고인자의 결핍으로 인해 발생하는 대표적인 선천성 출혈성 질환이다. 제VIII응고인자(FVIII)의 결핍은 혈우병 A로, 전체 환자의 약 80~85%를 차지하며 ‘고전적 혈우병(classic hemophilia)’이라 불린다. 제IX응고인자(FIX)의 결핍은 혈우병 B로 약 15%를 차지하며, 최초 환자의 이름을 따 ‘크리스마스병(Christmas disease)’으로도 알려져 있다. 제XI응고인자(FXI)의 결핍은 혈우병 C로 상대적으로 드물게 발생한다.혈우병 A와 B는 X 염색체 열성 유전 양식을 가지므로 주로 남성에서 발병하며, 여성은 보인자로 존재하거나 드물게 태아기에 사망하기도 한다. 반면 혈우병 C는 4번 염색체 이상에 기인하므로 성별에 관계없이 발생할 수 있으며, 일부 환자에서는 가족력 없이 자연 발생적 유전자 변이에 의해 발현되기도 한다.혈우병과 유사한 질환으로는 폰빌레브란트병(von Willebrand disease, vWD)이 있다. 이는 응고인자 VIII과 결합하는 폰빌레브란트인자(vWF)의 결핍으로 인해 혈우병과 유사한 임상 양상을 보인다.이외에도 프로트롬빈(II), 피브리노겐(I), V, VII, X, XII, XIII 응고인자의 결핍으로 인한 선천성 응고장애가 보고되어 있으나, 이러한 질환들은 혈우병의 범주에는 포함되지 않는다.혈액응고 과정은 어떻게 일어나는가?혈액응고는 인체의 항상성을 유지하기 위한 필수적인 생리적 방어기전으로, 외상이나 혈관 손상 시 과도한 출혈을 방지하는 역할을 한다. 이 과정은 혈관수축, 혈소판 기능, 그리고 혈액응고인자의 연속적인 활성화로 이루어지는 응고 연쇄(cascade)로 설명되며, 궁극적으로 안정적인 피브린 혈전(fibrin clot)을 형성한다.혈액응고인자(Coagulation factors)는 주로 간에서 합성되는 단백질로, 로마 숫자로 표기된 I번부터 XIII번까지의 인자가 알려져 있다. 이들은 각각 특정 효소 활성 또는 보조인자로 작용하면서 정교하고 단계적인 반응을 매개한다. 주요 응고인자로는 피브리노겐(Factor I), 프로트롬빈(Factor II), 그리고 프로트롬빈 복합체를 구성하는 V, VII, IX, X, XI, XII 인자, 마지막으로 XIII 인자 등이 있다. 응고 연쇄는 크게 내인성 경로(intrinsic pathway), 외인성 경로(extrinsic pathway), 그리고 두 경로가 합류하는 공통 경로(common pathway)로 구성된다.내인성 경로는 Factor XII의 활성화를 시작으로 XI, IX, VIII 인자가 순차적으로 활성화되며, 외인성 경로는 조직인자(tissue factor, TF)와 Factor VII의 상호작용을 통해 개시된다.두 경로는 Factor X의 활성화 단계에서 공통 경로로 수렴하며, 활성화된 Factor X는 Factor V와 결합하여 프로트롬비나제(prothrombinase) 복합체를 형성한다. 이 복합체는 프로트롬빈(Factor II)을 트롬빈(thrombin)으로 전환시키고, 생성된 트롬빈은 피브리노겐(Factor I)을 불용성 피브린(fibrin)으로 전환시켜 최종적으로 혈전을 완성한다.또한 트롬빈은 Factor V, VIII, XI 등을 다시 활성화시키는 양성 되먹임(positive feedback) 작용을 통해 응고 반응을 증폭시키며, Factor XIII을 활성화시켜 피브린 가교결합(fibrin cross-linking)을 형성함으로써 혈전의 안정성을 더욱 높인다.이러한 정교한 연쇄 반응은 항응고 단백질(antithrombin, protein C/S system 등)과 섬유소 용해(fibrinolysis) 기전 간의 정밀한 균형 속에서 조절된다. 이 균형이 깨질 경우 출혈성 질환이나 혈전성 질환으로 이어질 수 있다.항트롬빈(Antithrombin, AT, heparin cofactor I)은 어떤 물질인가?항트롬빈(AT)은 혈액응고 조절에서 가장 중요한 내인성 항응고인자로, 전체 생리적 응고 억제 작용의 약 70~80%를 담당하는 핵심 단백질이다. AT는 혈장에 존재하는 세린 단백질분해효소 억제제(serpin) 계열의 당단백질로, 주된 표적은 트롬빈(thrombin)이지만, Factor Xa, IXa, XIa, XIIa 및 칼리크레인(kallikrein) 등 다양한 혈액응고인자를 동시에 억제함으로써 응고 연쇄(cascade) 전반의 균형 유지에 기여한다.The Coagulation Cascade(출처: Ann Pharmacother . 2016 Sep;50(9):758-67). AT는 트롬빈의 활성 중심부에 위치한 세린(serine) 잔기와 1:1 비율로 결합하여 불활성 복합체를 형성함으로써 트롬빈 활성을 차단한다. 이를 통해 소규모 응고 반응이나 불필요한 혈전 형성을 신속히 억제하며, 정상적인 생리 상태에서 과도한 혈액응고를 방지하는 핵심 역할을 수행한다.그러나 대규모 혈관 손상이나 파종성 혈관내응고(Disseminated intravascular coagulation, DIC)와 같이 트롬빈 생성이 폭발적으로 증가하는 상황에서는 AT의 억제 능력이 상대적으로 부족해져, 생리적 항응고 메커니즘만으로는 병적 혈전 형성을 완전히 제어하기 어렵다.AT의 항응고 활성이 가장 강력하게 발휘되는 조건은 헤파린(heparin)의 존재 하에서이다. 헤파린은 AT에 결합하여 구조적 변화를 유도하고, AT와 트롬빈 및 Factor Xa 간의 결합 친화도를 수백 배 이상 증폭시킨다.이로 인해 헤파린은 AT의 촉매제(cofactor) 역할을 하며, 임상적으로 항응고 효과를 발휘하는 주요 기전이 바로 AT 매개 억제 반응이다. 이러한 이유로 AT 결핍 환자에서는 헤파린의 항응고 효과가 현저히 감소하며, 이는 선천성 또는 후천성 AT 결핍에서 혈전성 질환 발생 위험이 증가하는 중요한 근거가 된다.AT는 간에서 합성되며 혈중 농도는 약 0.15mg/mL로 유지되고, 정상 활성도는 80~120% 범위 내에 있다. 선천성 AT 결핍은 드문 질환이지만 정맥혈전증과 폐색전증 발생의 중요한 위험 요인으로 알려져 있으며, 후천성 결핍은 간질환, 신증후군, DIC, 항응고제 치료 등 다양한 상황에서 관찰된다. AT 농도의 감소는 항응고 균형을 무너뜨려 과도한 혈전 형성을 유발하므로, 임상적으로 AT 농축제제 보충 또는 헤파린·직접 트롬빈 억제제와 같은 항응고 요법을 병행하는 치료 전략이 고려된다.이처럼 AT는 단순한 혈액응고인자 억제 단백질을 넘어, 혈액응고와 항응고, 그리고 섬유소 용해(fibrinolysis) 시스템 사이의 미세한 균형을 유지하는 핵심 조절인자로서, 혈전성 질환의 병태생리 이해와 새로운 항응고 치료제 개발에 있어 중요한 연구 대상이 되고 있다.혈우병 A 치료제에는 어떤 약제가 있는가?1. 응고인자 보충요법(Factor Replacement Therapy) 혈우병 A의 전통적인 치료는 부족한 제Ⅷ인자(FVIII)를 직접 보충하는 방식이다. 초기에는 혈액 유래 FVIII 제제가 사용되었으나, 감염 위험 등 안전성 문제가 제기되면서 현재는 재조합 FVIII(rFVIII)이 표준으로 자리잡았다. 또한 최근에는 반감기를 연장한 FVIII 제제들이 개발되어 투여 빈도를 줄이고 환자 순응도를 높이는 데 기여하고 있다.1) 표준 반감기(Standard half-life, SHL) FVIII 제제 표준 반감기 제제는 혈액 유래 FVIII와 재조합 FVIII로 나눌 수 있다. 혈액 유래 제제는 감염 위험 관리가 필요하지만 여전히 일부에서 사용되고 있으며, 재조합 FVIII로 애드베이트(Advate& 9415;, 코지네이트 에프에스(Kogenate FS& 9415;) 등은 안전성 측면에서 더 선호된다.2) 반감기 연장형(Extended half-life, EHL) FVIII 제제 반감기 연장형 제제는 투여 간격을 늘리기 위해 Fc-fusion(엘록테이트, Eloctate& 9415;), PEGylation(애디노베이트, Adynovate& 9415;, 지비, Jivi& 9415;) 등 다양한 기술이 적용되었다. 이러한 약제들은 환자의 주사 횟수를 줄여 장기적인 치료 순응도를 개선하는 장점이 있다.3) VWF-independent EHL(VWF 비의존성 반감기 연장형) FVIII 제제 VWF 비의존성 반감기 연장형 제제인 알투비오(Altuviiio& 9415;)는 주 1회 주사로 FVIII 활성을 더 오래 유지할 수 있도록 설계된 최신형 지속형 치료제(high sustained factor, HSF)로 2023년 미 FDA에서 승인되었고 국내에서는 진행중이다,2. 억제인자 환자 치료(Treatment for Patients with Inhibitors) 혈우병 A 환자의 약 20~30%는 치료 과정에서 FVIII에 대한 억제항체를 형성하게 되며, 이 경우 기존의 FVIII 보충요법은 효과가 제한적이다. 억제인자 환자의 치료에는 크게 두 가지 접근법이 있다.첫째, 우회제제(bypassing agents, BPA)를 사용하는 방법이다. 활성화 프로트롬빈 복합체(aPCC, 훼이바, FEIBA& 9415;)와 재조합 활성 VIIa(rFVIIa, 노보세븐, NovoSeven& 9415;)는 응고경로를 우회적으로 활성화하여 지혈 효과를 발휘하지만, 지혈 반응의 변동성과 혈전 위험이라는 한계가 존재한다.둘째, 에미시주맙(Emicizumab, Hemlibra& 9415;)는 FIXa와 FX를 연결하여 FVIII의 기능을 모방하는 이중특이성 항체로, 억제인자 환자뿐 아니라 비(非)억제인자 환자에서도 예방요법으로 사용 가능하다. 피하 주사로 1주~4주 간격 투여가 가능하여 투여 편의성이 획기적으로 개선되었다.3. 대체 인자제제(Replacement therapy) 재조합 돼지 유래 FVIII(r-pFVIII)인 오비주르(Obizur®, Susoctocog alfa)는 2014년 미 FDA, 2015년 EMA 그리고 2023년 국내에서 ‘성인 후천성 혈우병 A(Acquired Haemophilia A, AHA) 환자의 출혈 에피소드 치료’에 승인되었다. 후천성 혈우병 A는 선천성 혈우병과 다르게, 정상 혈액응고인자 VIII(FVIII) 수준을 가지고 있지만, 이에 대해 자가면역 항체(중화 항체)가 생겨 혈액 응고 기능이 저해되어 출혈 위험이 커지는 인구 100만 명당 약 1명꼴로 발생하는 초희귀 자가면역 응고질환이다.4. 비응고인자 기반 치료(Non-factor Therapy) 최근 혈우병 A 치료에서 가장 주목받는 변화는 FVIII를 직접 보충하지 않고, 다른 경로를 통해 응고 균형을 회복하는 비응고인자 기반 치료이다. 대표적인 약제가 에미시주맙(Emicizumab, Hemlibra& 9415;)으로, FIXa와 FX을 연결하여 FVIII의 보조인자 기능을 모방하는 이중특이성 항체이다. 피하 주사로 주 1회, 격주, 또는 4주 간격 투여가 가능해 환자의 치료 편의성이 획기적으로 개선되었다.이외에도 피투시란(Fitusiran)과 콘시주맙(Concizumab, Alhemo®)가 있다. 피투시란은 RNA 간섭(RNAi) 기술을 이용하여 간세포에서 항트롬빈 합성을 억제함으로써 응고 활성을 높인다. 월 1회 피하 주사가 가능하지만, 혈전 및 간독성 발생 위험으로 인해 항트롬빈 활성(15& 8211;35%)을 유지하는 개별화 용량조절(AT-DR)이 필요하다. 콘시주맙은 조직인자경로억제인자(TFPI)를 차단하여 내인성 응고를 촉진하는 약제이다.5. 유전자 치료(Gene Therapy) 혈우병 A에서 유전자 치료는 단회 정맥투여를 통해 간세포에 FVIII 유전자를 도입하여 장기간 발현을 유도하는 새로운 전략이다. 대표적인 약제가 록타비안(Roctavian& 9415;, Valoctocogene roxaparvovec)으로, AAV5 벡터를 이용해 개발되었으며 2022년 유럽, 2023년 미국 FDA의 승인을 받았다.단일 투여로 FVIII 발현을 장기간 유지할 수 있어 치료 패러다임의 변화를 예고했으나, 발현 지속 기간의 불확실성, 간효소 상승, 재투여 불가 등의 문제점이 여전히 남아 있다.혈우병 B 치료제에는 어떤 약제가 있는가?1. 응고인자 보충요법(Factor IX Replacement Therapy) 혈우병 B의 가장 기본적인 치료는 부족한 제Ⅸ인자(FIX)를 직접 보충하는 방식이다. 과거에는 혈액 유래 제제가 널리 사용되었으나, 감염 위험 문제로 현재는 재조합 FIX(rFIX) 제제가 주로 사용된다. 여기에 더해 반감기를 연장한 제제들이 개발되면서 투여 간격이 길어지고 환자의 치료 순응도가 크게 향상되었다.1) 표준 반감기(Standard half-life, SHL) FIX 제제 표준 반감기 FIX 제제는 투여 후 약 18~24시간의 반감기를 가지며, 주 2~3회 정맥 주사가 필요하다. 혈액 유래 FIX 제제는 여전히 일부에서 사용되지만, 바이러스 감염에 대한 안전성 우려가 있었다. 이를 보완하기 위해 개발된 재조합 FIX 제제인 베네픽스(BeneFIX& 9415;, Nonacog alfa)는 안전성이 확보되어 현재 임상에서 가장 널리 사용되고 있다.2) 반감기 연장(Extended half-life, EHL) FIX 제제 반감기 연장 제제는 기존 표준 제제보다 3~5배 긴 반감기를 가지며, 1~2주 간격으로 투여가 가능하다. 이들 약제에는 Fc-fusion 단백을 이용한 알프로릭스(Alprolix(& 9415;, Eftrenonacog alfa), albumin-fusion 기술이 적용된 아이델비온(Idelvion& 9415; Albutrepenonacog alfa) 등이 포함된다. 이러한 제제들은 주사 횟수를 줄여 환자의 삶의 질과 치료 순응도를 높이는 중요한 진보로 평가된다.2. 억제인자 환자 치료(Treatment for Patients with Inhibitors) 혈우병 B 환자에서 억제인자 발생은 상대적으로 드물지만, 일단 형성되면 치료가 매우 어렵다. 억제인자가 형성된 경우 기존 FIX 제제의 효과가 소실되므로 우회제제(bypassing agents)가 사용된다.활성화 프로트롬빈 복합체(aPCC, 훼이바, FEIBA& 9415;)와 재조합 활성 VIIa(rFVIIa, 노보세븐, NovoSeven& 9415;)가 대표적이다. 그러나 혈우병 A와 달리 에미시주맙은 FVIII 기능을 모방하는 기전이기 때문에 혈우병 B 환자에게는 효과가 없다. 따라서 억제인자 환자의 치료는 여전히 제한적이며, 새로운 치료 전략이 필요한 영역이다.3. 비응고인자 기반 치료(Non-factor Therapy) 혈우병 B에서도 비응고인자 기반 치료가 적용될 수 있다. 이들 약제는 특정 응고인자를 보충하지 않고 응고 균형 자체를 조절하는 기전을 갖는다. 대표적으로 RNA 간섭 기반의 피투시란(Fitusiran)은 간세포에서 항트롬빈 합성을 억제하여 응고 활성을 증가시키며, 혈우병 A와 B 모두에 승인되었다.또한 항 TFPI 항체인 콘시주맙(Concizumab, Alhemo®) 역시 혈우병 A와 B 모두에 적용 가능하며, 내인성 응고경로를 촉진하여 출혈을 억제한다. 이처럼 비응고인자 기반 치료는 억제인자 보유 여부와 관계없이 사용할 수 있는 장점이 있어, 혈우병 B 환자에서도 중요한 치료 대안으로 부상하고 있다.4. 유전자 치료(Gene Therapy) 혈우병 B는 유전자 치료 분야에서 가장 먼저 성과를 낸 질환 중 하나이다. FIX 유전자의 크기가 FVIII보다 작아 AAV 벡터 전달이 용이하기 때문에, 임상개발이 상대적으로 앞서 진행되었다.대표적인 약제는 헴제닉스(Hemgenix& 9415;, Etranacogene dezaparvovec)으로, 2022년 미국 FDA와 2023년 유럽 EMA에서 세계 최초로 혈우병 유전자 치료제로 승인되었다. 단회 정맥투여만으로 간세포에서 FIX 발현이 장기간 유지될 수 있으며, 환자의 치료 부담을 획기적으로 줄일 수 있다. 그러나 여전히 발현 지속 기간의 변동성, 간효소 상승, 재투여 불가 등의 문제점이 존재하며, 고가의 치료비용 역시 중요한 사회적 논의 대상이 되고 있다.피투시란은 어떤 약제인가?피투시란은 안티트롬빈(AT) mRNA를 절단·분해하여 AT 발현을 억제함으로써 혈중 AT 농도를 감소시키는 기전을 가진다. siRNA 치료제는 RNAi 과정을 활용하는 대표적인 플랫폼으로, 표적 mRNA를 인식하고 분해하도록 설계된 합성 RNA 이중가닥 구조를 기반으로 한다. 이 과정은 특정 단백질의 번역을 저해하여 표적 단백질의 합성을 효과적으로 억제한다.피투시란은 화학적으로 안정화된 이중가닥 siRNA로 설계되어 뉴클레아제에 의한 분해나 Toll-like receptor(TLR)3, TLR7 등 선천면역 수용체의 인식을 회피한다. 특히 리보뉴클레오티드의 2′-데옥시-2′-플루오로 치환, 2′-O-메틸 치환, 인산 골격의 선택적 변형이 적용되어 높은 안정성과 생체 내 지속성을 확보하였다.이 siRNA는 삼중 안테나(tri-antenna) 형태의 N-아세틸갈락토사민(GalNAc) 잔기와 결합되어 있으며, 간세포 표면의 아실글리코프로테인 수용체(asialoglycoprotein receptor, ASGPR)를 통해 효율적으로 간세포 내로 전달된다. 세포 내로 흡수된 후 산성 환경에서 siRNA는 ASGPR로부터 해리되고, 엔도솜을 탈출하여 세포질 내 RNA 유도 침묵 복합체(RNA-induced silencing complex, RISC)에 탑재된다.RISC는 siRNA의 안티센스(antisense) 가닥을 선택적으로 유지하고, 이를 이용해 표적 유전자인 SERPINC1 mRNA를 서열 특이적으로 절단·분해함으로써 AT 발현을 억제한다. 이 과정의 결과로 혈중 AT 농도가 감소하며, 그에 따라 트롬빈 생성이 증가하여 혈우병 환자의 응고능이 향상된다.RISC 내 안티센스 가닥은 세포 내에서 수 주간 안정적으로 존재하면서 반복적으로 전사체 절단을 매개하므로, 세포당 수백 개 수준의 siRNA 분자만으로도 강력하고 지속적인 knockdown 효과를 낸다. 이러한 특성 덕분에 피투시란은 임상시험에서 한 달에 한 번의 피하 투여만으로도 충분한 약효를 유지할 수 있는 장점을 보인다.Antithrombin Knockdown by Fitusiran(출처: Molecular Therapy Vol. 28 No 3 April 2020).피투시란의 약리 기전은?피투시란은 간에서 합성되는 AT(antithrombin) mRNA를 표적하는 siRNA로 개발된 약제로, 항트롬빈 발현을 효율적으로 억제함으로써 체내의 친응고 상태를 강화하는 새로운 치료 전략이다.즉, AT 억제 작용을 통해 내인성 및 외인성 경로 모두에서 Factor Xa와 트롬빈의 활성을 증가시켜 응고 연쇄의 효율성을 회복시키며, 그 결과 FVIII 또는 FIX 결핍이 있는 혈우병 환자에서도 출혈 위험을 효과적으로 감소시킨다.The Role of Thrombin and Antithrombin in Hemostasis, and the Mechanism of Action of Fitusiran(출처: Res Pract Thromb Haemost. 2023;7:e100179).피투시란은 혈우병 A 또는 B 환자의 출혈 예방을 위해 2개월에 한 번 피하 주사로 투여된다. 초기 권장 용량은 50mg이며, 이후 항트롬빈 활성도를 모니터링하여 용량과 투여 간격을 조정한다. 목표 AT 활성도는 15~35% 사이로 유지하는 것이 바람직하다.AT 활성도가 15% 미만으로 떨어질 경우 용량을 줄이고, 35% 이상으로 증가하면 용량을 늘릴 수 있다. 예를 들어, 50mg을 2개월 간격으로 투여하던 환자의 AT 활성도가 35%를 초과할 경우, 동일 용량을 매월 투여하도록 변경할 수 있다.약동학 연구에서 피투시란은 혈장에서 비교적 짧은 반감기(약 3~5시간)를 보였으나, 모든 임상시험 용량군에서 투여 중단 후에도 수개월간 AT 감소 효과가 지속되었다. 평균 AT 회복 속도는 한 달에 약 10~15% 수준이었으며, 이 기간 동안 트롬빈 생성은 억제되고 출혈 사건 발생 위험은 증가하는 경향을 보였다.투여 중단 후 약 5개월 시점에서 중앙값 AT 수치는 약 60% 이상으로 회복되었다. 약력학적 분석 결과, AT 억제 효과는 첫 투여 후 약 15~28일 사이에 나타났으며, 개인 간 AT 감소 정도에는 차이가 있으나 개인 내에서는 일정하게 유지되어 지속적인 지혈 보호 효과를 제공하는 것으로 확인되었다.피투시란은 또한 비인자(non-factor) 치료제 중 유일하게 특정 역전제(reversal agent)를 보유한 약제로, 이는 재조합 또는 혈장 유래 항트롬빈 제제 형태로 제공된다. 이러한 역전제는 돌파성 출혈 시 다른 지혈제와 병용할 경우 혈전증 위험을 조절할 수 있다는 점에서 임상적으로 중요한 의미를 갖는다.한편, 혈중 AT 감소가 표준 응고 검사에 직접적인 영향을 미치지 않는다는 점은, CFC(concentrated factor concentrate) 또는 BPA(bypassing agent)를 사용하는 상황이나 수술 시 지혈 상태 및 인자 수치를 보다 용이하게 모니터링할 수 있음을 시사한다.피투시란(QFITLIA)의 허가임상은 어떠한가?성인 및 12세 이상의 소아 환자에서 억제인자(inhibitors)의 존재 여부와 관계없이 혈우병 A 또는 B를 가진 환자에서 QFITLIA의 유효성과 안전성은 두 건의 임상시험에서 입증되었다.-억제인자가 있는 혈우병 A 또는 B: ATLAS-INH -억제인자가 없는 혈우병 A 또는 B: ATLAS-A/B위의 본 임상시험에 참여한 환자들은 장기 연장 연구인 ATLAS-OLE로 이월되었다.임상시험 ATLAS-INH 및 ATLAS-A/B에서는 QFITLIA 80mg 고정 월 1회 용량을 시험하였다. 그러나 이 용량에서 혈전성 사건(thrombotic events)이 발생하여, ATLAS-OLE에서는 항트롬빈(AT) 활성 15& 8211;35%를 목표로 하는 QFITLIA AT-DR 용법이 도입되었다.AT-DR 용법은 ATLAS-INH 및 ATLAS-A/B 연구가 거의 완료될 시점에 도입되었으므로, QFITLIA AT-DR 치료의 유효성은 장기 연장 연구 ATLAS-OLE에서 얻어진 AT-DR 치료 데이터를 ATLAS-INH 및 ATLAS-A/B 연구의 대조(control) 데이터와 비교하여 평가되었다.유효성 분석은 본 임상시험들의 무작위 배정(randomization)을 보존하면서, 부모 연구(parent studies)에서의 의도한 치료(intent-to-treat, ITT) 원칙에 따라 수행되었다.[ATLAS-INH] ATLAS-INH은 혈우병 A 또는 B 환자 중 FVIII(제8인자) 또는 FIX(제9인자)에 대한 억제항체를 가진 성인 및 소아 남성 환자(≥12세) 57명을 대상으로 실시된 다기관, 무작위배정, 공개(open-label) 임상시험이었다. 이들은 모두 과거에 출혈 시 우회제제(BPAs)를 필요에 따라(episodic, on-demand) 투여받은 병력이 있었다.대상 환자들은 2:1 비율로 무작위 배정되어, 월 1회 80mg 고정 용량의 QFITLIA 피하 주사(SC)를 예방요법(prophylaxis)으로 투여받은 군(N=38)과, 돌발 출혈(breakthrough bleeding) 발생 시 BPA를 필요에 따라 투여받은 군(N=19)으로 나뉘어 9개월간 치료를 받았다.그러나 QFITLIA 80mg 용량은 심각한 혈전성 사건(thrombotic events), 담낭 질환(담낭절제술 필요 포함), 간독성(hepatotoxicity) 위험 증가로 인해 승인되지 않았다. 현재 50mg과 20mg이 허가되어 있다.[ATLAS A/B] ATLAS A/B는 FVIII(제8인자) 또는 FIX(제9인자)에 대한 억제항체가 없는 혈우병 A 또는 B 환자를 대상으로 한 다기관, 무작위배정, 공개(open-label) 임상시험이었다. 대상자는 모두 성인 및 소아 남성(≥12세)으로, 과거에 출혈 시 응고인자제제(CFC)를 필요에 따라(on-demand, episodic) 투여받은 병력이 있었다.대상 환자 120명은 2:1 비율로 무작위 배정되어, 월 1회 80 mg 고정 용량의 QFITLIA 피하 주사(SC)를 예방요법(prophylaxis)으로 투여받은 군(N=80)과, 돌발 출혈 발생 시 CFC를 필요에 따라 투여받은 군(N=40)으로 나뉘어 9개월간 치료를 받았다.그러나 QFITLIA 80mg용량은 심각한 혈전성 사건(thrombotic events), 담낭 질환(담낭절제술 필요 포함), 간독성(hepatotoxicity) 위험 증가로 인해 승인되지 않았다.[ATLAS-OLE] 총 227명의 환자가 두 임상시험(ATLAS-INH 및 ATLAS-A/B)과, CFC 또는 BPA 예방요법을 받던 환자를 대상으로 한 교차 임상시험 ATLAS-PPX에서 이월되어 ATLAS-OLE 연구에서 QFITLIA 치료를 받았다. 이 다기관 공개 연장 임상시험은 FVIII 또는 FIX 억제항체 유무와 관계없이, 12세 이상의 성인 및 소아 남성 혈우병 A 또는 B 환자에서 QFITLIA의 장기적인 안전성과 유효성을 평가하였다.대상자는 초기에는 월 1회 80mg QFITLIA 피하 주사를 투여받았으나, 연구가 개정되어 AT-DR(항트롬빈 활성 15& 8211;35% 목표) 용법의 유효성과 안전성을 평가하도록 설계가 변경되었다. 이후 총 213명의 환자가 AT-DR로 전환되었다.AT-DR에서는 시작 용량이 50mg 격월(2개월 간격) 투여였으며, INNOVANCE Antithrombin 분석법을 이용해 측정한 AT 활성 수치에 따라 개별적으로 용량을 조정하였다. 용량은 50mg 월 1회 또는 80mg 월 1회로 증량하거나, 20mg 격월 또는 20mg 월 1회로 감량할 수 있었다.AT 활성 수치가 최저 용량에서도2025-10-23 23:25:17최병철 박사
세계 첫 항체 무관 혈우병 A·B 치료제 '피투시란'큐피틀리아(Qfitlia, 성분명 피투시란, Fitusiran, 사노피)는 GalXC 기술 플랫폼을 기반으로 개발된 항트롬빈(antithrombin)을 표적으로 하는 소간섭 리보핵산(small interfering RNA, siRNA) 치료제다.이 약제는 2024년 유럽의약청(EMA) 에서, 이어 올해 3월 미국 식품의약국(FDA) 에서 제VIII인자 또는 제IX인자 억제인자(inhibitor)의 유무와 관계없이, 12세 이상 성인 및 소아 혈우병 A 또는 B 환자에서 출혈 에피소드의 발생을 예방하거나 빈도를 감소시키기 위한 정기적 예방요법(routine prophylaxis)에 ‘두 달에 한번 피하주사’로 승인되었다. 국내에서는 올해 5월 희귀의약품(Orphan drug) 으로 지정되었다.혈우병(hemophilia)은 X염색체 연관 열성 유전질환으로, 제Ⅷ인자(FVIII) 또는 제Ⅸ인자(FIX) 의 결핍으로 인해 혈액응고 연쇄반응(coagulation cascade) 이 정상적으로 진행되지 못하며, 그 결과 트롬빈(thrombin) 생성 부족으로 지혈(hemostasis) 이 저하된다. 이러한 병태생리적 이상은 반복적인 출혈, 특히 관절 출혈을 초래하여 만성 관절병증(chronic arthropathy) 및 삶의 질 저하로 이어진다.기존의 표준 치료는 응고인자제제(clotting factor concentrate, CFC) 의 정맥 내 투여를 통한 인자 보충요법(replacement therapy) 이었다. 그러나 이 방식은 정맥 투여의 불편성, 반복적 투여 부담, 그리고 항체(억제인자, inhibitor) 형성으로 인한 치료 저항성이라는 한계를 지닌다.이에 따라 최근에는 비(非)응고인자 기반 치료(non-factor therapy) 의 개발이 활발히 이루어지고 있으며, 그중에서도 RNA 간섭(RNA interference, RNAi) 기술을 이용한 피투시란(Fitusiran) 은 새로운 치료 옵션으로 주목 받고 있다.피투시란은 간세포 내에서 항트롬빈(antithrombin, AT) 합성을 억제하도록 설계된 siRNA 기반 치료제로, 내인성 응고 조절 인자의 발현을 조절함으로써 응고 균형(hemostatic balance) 을 회복시키는 새로운 접근법을 제시한다.피투시란의 승인은 다국가, 무작위배정, 대조, 3상 임상시험들로 구성된 ATLAS 임상 프로그램의 결과를 근거로 하였다.이 프로그램에는 ATLAS-A/B, ATLAS-INH, 그리고 ATLAS-PPX 연구가 포함되며, 각각 혈우병 A 또는 B 환자 중 인자 억제인자의 유무, 그리고 기존 예방요법(prophylaxis) 사용 여부에 따라 구분되었다.ATLAS-A/B 연구는 억제인자가 없는(non-inhibitor) 혈우병 A 또는 B 환자를 대상으로, ATLAS-INH 연구는 억제인자가 존재하는(inhibitor-positive) 환자를 대상으로 수행되었다. ATLAS-PPX 연구는 기존 예방요법을 받고 있던 환자에서 피투시란으로 전환했을 때의 출혈률 변화를 평가하였다.이들 연구에서 피투시란은 월 1회 피하주사(subcutaneous injection) 투여만으로도 연간 출혈률(annualized bleeding rate, ABR)을 기존 치료 대비 약 90% 이상 유의하게 감소시켰으며, 절반 이상의 환자에서 무출혈(ABR = 0)이 관찰되었다. 또한 억제인자 유무와 관계없이 일관된 출혈 억제 효과가 확인되었다.혈우병이란 무엇인가?혈우병(hemophilia)은 그리스어 ‘hemo(피)’와 ‘philia(사랑하다)’에서 유래한 용어로, 1828년 Sch& 246;nlein에 의해 H& 228;mophilie라 명명됐다. 19세기 말 유럽 왕실 내 근친혼으로 인해 영국, 스페인, 독일, 러시아 등 여러 나라에서 다수의 환자가 발생하면서 ‘왕실병(The Royal Disease)’이라는 별칭을 얻었다.혈우병은 혈액응고인자의 결핍으로 인해 발생하는 대표적인 선천성 출혈성 질환이다. 제VIII응고인자(FVIII)의 결핍은 혈우병 A로, 전체 환자의 약 80~85%를 차지하며 ‘고전적 혈우병(classic hemophilia)’이라 불린다. 제IX응고인자(FIX)의 결핍은 혈우병 B로 약 15%를 차지하며, 최초 환자의 이름을 따 ‘크리스마스병(Christmas disease)’으로도 알려져 있다. 제XI응고인자(FXI)의 결핍은 혈우병 C로 상대적으로 드물게 발생한다.혈우병 A와 B는 X 염색체 열성 유전 양식을 가지므로 주로 남성에서 발병하며, 여성은 보인자로 존재하거나 드물게 태아기에 사망하기도 한다. 반면 혈우병 C는 4번 염색체 이상에 기인하므로 성별에 관계없이 발생할 수 있으며, 일부 환자에서는 가족력 없이 자연 발생적 유전자 변이에 의해 발현되기도 한다.혈우병과 유사한 질환으로는 폰빌레브란트병(von Willebrand disease, vWD)이 있다. 이는 응고인자 VIII과 결합하는 폰빌레브란트인자(vWF)의 결핍으로 인해 혈우병과 유사한 임상 양상을 보인다.이외에도 프로트롬빈(II), 피브리노겐(I), V, VII, X, XII, XIII 응고인자의 결핍으로 인한 선천성 응고장애가 보고되어 있으나, 이러한 질환들은 혈우병의 범주에는 포함되지 않는다.혈액응고 과정은 어떻게 일어나는가?혈액응고는 인체의 항상성을 유지하기 위한 필수적인 생리적 방어기전으로, 외상이나 혈관 손상 시 과도한 출혈을 방지하는 역할을 한다. 이 과정은 혈관수축, 혈소판 기능, 그리고 혈액응고인자의 연속적인 활성화로 이루어지는 응고 연쇄(cascade)로 설명되며, 궁극적으로 안정적인 피브린 혈전(fibrin clot)을 형성한다.혈액응고인자(Coagulation factors)는 주로 간에서 합성되는 단백질로, 로마 숫자로 표기된 I번부터 XIII번까지의 인자가 알려져 있다. 이들은 각각 특정 효소 활성 또는 보조인자로 작용하면서 정교하고 단계적인 반응을 매개한다. 주요 응고인자로는 피브리노겐(Factor I), 프로트롬빈(Factor II), 그리고 프로트롬빈 복합체를 구성하는 V, VII, IX, X, XI, XII 인자, 마지막으로 XIII 인자 등이 있다. 응고 연쇄는 크게 내인성 경로(intrinsic pathway), 외인성 경로(extrinsic pathway), 그리고 두 경로가 합류하는 공통 경로(common pathway)로 구성된다.내인성 경로는 Factor XII의 활성화를 시작으로 XI, IX, VIII 인자가 순차적으로 활성화되며, 외인성 경로는 조직인자(tissue factor, TF)와 Factor VII의 상호작용을 통해 개시된다.두 경로는 Factor X의 활성화 단계에서 공통 경로로 수렴하며, 활성화된 Factor X는 Factor V와 결합하여 프로트롬비나제(prothrombinase) 복합체를 형성한다. 이 복합체는 프로트롬빈(Factor II)을 트롬빈(thrombin)으로 전환시키고, 생성된 트롬빈은 피브리노겐(Factor I)을 불용성 피브린(fibrin)으로 전환시켜 최종적으로 혈전을 완성한다.또한 트롬빈은 Factor V, VIII, XI 등을 다시 활성화시키는 양성 되먹임(positive feedback) 작용을 통해 응고 반응을 증폭시키며, Factor XIII을 활성화시켜 피브린 가교결합(fibrin cross-linking)을 형성함으로써 혈전의 안정성을 더욱 높인다.이러한 정교한 연쇄 반응은 항응고 단백질(antithrombin, protein C/S system 등)과 섬유소 용해(fibrinolysis) 기전 간의 정밀한 균형 속에서 조절된다. 이 균형이 깨질 경우 출혈성 질환이나 혈전성 질환으로 이어질 수 있다.항트롬빈(Antithrombin, AT, heparin cofactor I)은 어떤 물질인가?항트롬빈(AT)은 혈액응고 조절에서 가장 중요한 내인성 항응고인자로, 전체 생리적 응고 억제 작용의 약 70~80%를 담당하는 핵심 단백질이다. AT는 혈장에 존재하는 세린 단백질분해효소 억제제(serpin) 계열의 당단백질로, 주된 표적은 트롬빈(thrombin)이지만, Factor Xa, IXa, XIa, XIIa 및 칼리크레인(kallikrein) 등 다양한 혈액응고인자를 동시에 억제함으로써 응고 연쇄(cascade) 전반의 균형 유지에 기여한다.The Coagulation Cascade(출처: Ann Pharmacother . 2016 Sep;50(9):758-67). AT는 트롬빈의 활성 중심부에 위치한 세린(serine) 잔기와 1:1 비율로 결합하여 불활성 복합체를 형성함으로써 트롬빈 활성을 차단한다. 이를 통해 소규모 응고 반응이나 불필요한 혈전 형성을 신속히 억제하며, 정상적인 생리 상태에서 과도한 혈액응고를 방지하는 핵심 역할을 수행한다.그러나 대규모 혈관 손상이나 파종성 혈관내응고(Disseminated intravascular coagulation, DIC)와 같이 트롬빈 생성이 폭발적으로 증가하는 상황에서는 AT의 억제 능력이 상대적으로 부족해져, 생리적 항응고 메커니즘만으로는 병적 혈전 형성을 완전히 제어하기 어렵다.AT의 항응고 활성이 가장 강력하게 발휘되는 조건은 헤파린(heparin)의 존재 하에서이다. 헤파린은 AT에 결합하여 구조적 변화를 유도하고, AT와 트롬빈 및 Factor Xa 간의 결합 친화도를 수백 배 이상 증폭시킨다.이로 인해 헤파린은 AT의 촉매제(cofactor) 역할을 하며, 임상적으로 항응고 효과를 발휘하는 주요 기전이 바로 AT 매개 억제 반응이다. 이러한 이유로 AT 결핍 환자에서는 헤파린의 항응고 효과가 현저히 감소하며, 이는 선천성 또는 후천성 AT 결핍에서 혈전성 질환 발생 위험이 증가하는 중요한 근거가 된다.AT는 간에서 합성되며 혈중 농도는 약 0.15mg/mL로 유지되고, 정상 활성도는 80~120% 범위 내에 있다. 선천성 AT 결핍은 드문 질환이지만 정맥혈전증과 폐색전증 발생의 중요한 위험 요인으로 알려져 있으며, 후천성 결핍은 간질환, 신증후군, DIC, 항응고제 치료 등 다양한 상황에서 관찰된다. AT 농도의 감소는 항응고 균형을 무너뜨려 과도한 혈전 형성을 유발하므로, 임상적으로 AT 농축제제 보충 또는 헤파린·직접 트롬빈 억제제와 같은 항응고 요법을 병행하는 치료 전략이 고려된다.이처럼 AT는 단순한 혈액응고인자 억제 단백질을 넘어, 혈액응고와 항응고, 그리고 섬유소 용해(fibrinolysis) 시스템 사이의 미세한 균형을 유지하는 핵심 조절인자로서, 혈전성 질환의 병태생리 이해와 새로운 항응고 치료제 개발에 있어 중요한 연구 대상이 되고 있다.혈우병 A 치료제에는 어떤 약제가 있는가?1. 응고인자 보충요법(Factor Replacement Therapy) 혈우병 A의 전통적인 치료는 부족한 제Ⅷ인자(FVIII)를 직접 보충하는 방식이다. 초기에는 혈액 유래 FVIII 제제가 사용되었으나, 감염 위험 등 안전성 문제가 제기되면서 현재는 재조합 FVIII(rFVIII)이 표준으로 자리잡았다. 또한 최근에는 반감기를 연장한 FVIII 제제들이 개발되어 투여 빈도를 줄이고 환자 순응도를 높이는 데 기여하고 있다.1) 표준 반감기(Standard half-life, SHL) FVIII 제제 표준 반감기 제제는 혈액 유래 FVIII와 재조합 FVIII로 나눌 수 있다. 혈액 유래 제제는 감염 위험 관리가 필요하지만 여전히 일부에서 사용되고 있으며, 재조합 FVIII로 애드베이트(Advate& 9415;, 코지네이트 에프에스(Kogenate FS& 9415;) 등은 안전성 측면에서 더 선호된다.2) 반감기 연장형(Extended half-life, EHL) FVIII 제제 반감기 연장형 제제는 투여 간격을 늘리기 위해 Fc-fusion(엘록테이트, Eloctate& 9415;), PEGylation(애디노베이트, Adynovate& 9415;, 지비, Jivi& 9415;) 등 다양한 기술이 적용되었다. 이러한 약제들은 환자의 주사 횟수를 줄여 장기적인 치료 순응도를 개선하는 장점이 있다.3) VWF-independent EHL(VWF 비의존성 반감기 연장형) FVIII 제제 VWF 비의존성 반감기 연장형 제제인 알투비오(Altuviiio& 9415;)는 주 1회 주사로 FVIII 활성을 더 오래 유지할 수 있도록 설계된 최신형 지속형 치료제(high sustained factor, HSF)로 2023년 미 FDA에서 승인되었고 국내에서는 진행중이다,2. 억제인자 환자 치료(Treatment for Patients with Inhibitors) 혈우병 A 환자의 약 20~30%는 치료 과정에서 FVIII에 대한 억제항체를 형성하게 되며, 이 경우 기존의 FVIII 보충요법은 효과가 제한적이다. 억제인자 환자의 치료에는 크게 두 가지 접근법이 있다.첫째, 우회제제(bypassing agents, BPA)를 사용하는 방법이다. 활성화 프로트롬빈 복합체(aPCC, 훼이바, FEIBA& 9415;)와 재조합 활성 VIIa(rFVIIa, 노보세븐, NovoSeven& 9415;)는 응고경로를 우회적으로 활성화하여 지혈 효과를 발휘하지만, 지혈 반응의 변동성과 혈전 위험이라는 한계가 존재한다.둘째, 에미시주맙(Emicizumab, Hemlibra& 9415;)는 FIXa와 FX를 연결하여 FVIII의 기능을 모방하는 이중특이성 항체로, 억제인자 환자뿐 아니라 비(非)억제인자 환자에서도 예방요법으로 사용 가능하다. 피하 주사로 1주~4주 간격 투여가 가능하여 투여 편의성이 획기적으로 개선되었다.3. 대체 인자제제(Replacement therapy) 재조합 돼지 유래 FVIII(r-pFVIII)인 오비주르(Obizur®, Susoctocog alfa)는 2014년 미 FDA, 2015년 EMA 그리고 2023년 국내에서 ‘성인 후천성 혈우병 A(Acquired Haemophilia A, AHA) 환자의 출혈 에피소드 치료’에 승인되었다. 후천성 혈우병 A는 선천성 혈우병과 다르게, 정상 혈액응고인자 VIII(FVIII) 수준을 가지고 있지만, 이에 대해 자가면역 항체(중화 항체)가 생겨 혈액 응고 기능이 저해되어 출혈 위험이 커지는 인구 100만 명당 약 1명꼴로 발생하는 초희귀 자가면역 응고질환이다.4. 비응고인자 기반 치료(Non-factor Therapy) 최근 혈우병 A 치료에서 가장 주목받는 변화는 FVIII를 직접 보충하지 않고, 다른 경로를 통해 응고 균형을 회복하는 비응고인자 기반 치료이다. 대표적인 약제가 에미시주맙(Emicizumab, Hemlibra& 9415;)으로, FIXa와 FX을 연결하여 FVIII의 보조인자 기능을 모방하는 이중특이성 항체이다. 피하 주사로 주 1회, 격주, 또는 4주 간격 투여가 가능해 환자의 치료 편의성이 획기적으로 개선되었다.이외에도 피투시란(Fitusiran)과 콘시주맙(Concizumab, Alhemo®)가 있다. 피투시란은 RNA 간섭(RNAi) 기술을 이용하여 간세포에서 항트롬빈 합성을 억제함으로써 응고 활성을 높인다. 월 1회 피하 주사가 가능하지만, 혈전 및 간독성 발생 위험으로 인해 항트롬빈 활성(15& 8211;35%)을 유지하는 개별화 용량조절(AT-DR)이 필요하다. 콘시주맙은 조직인자경로억제인자(TFPI)를 차단하여 내인성 응고를 촉진하는 약제이다.5. 유전자 치료(Gene Therapy) 혈우병 A에서 유전자 치료는 단회 정맥투여를 통해 간세포에 FVIII 유전자를 도입하여 장기간 발현을 유도하는 새로운 전략이다. 대표적인 약제가 록타비안(Roctavian& 9415;, Valoctocogene roxaparvovec)으로, AAV5 벡터를 이용해 개발되었으며 2022년 유럽, 2023년 미국 FDA의 승인을 받았다.단일 투여로 FVIII 발현을 장기간 유지할 수 있어 치료 패러다임의 변화를 예고했으나, 발현 지속 기간의 불확실성, 간효소 상승, 재투여 불가 등의 문제점이 여전히 남아 있다.혈우병 B 치료제에는 어떤 약제가 있는가?1. 응고인자 보충요법(Factor IX Replacement Therapy) 혈우병 B의 가장 기본적인 치료는 부족한 제Ⅸ인자(FIX)를 직접 보충하는 방식이다. 과거에는 혈액 유래 제제가 널리 사용되었으나, 감염 위험 문제로 현재는 재조합 FIX(rFIX) 제제가 주로 사용된다. 여기에 더해 반감기를 연장한 제제들이 개발되면서 투여 간격이 길어지고 환자의 치료 순응도가 크게 향상되었다.1) 표준 반감기(Standard half-life, SHL) FIX 제제 표준 반감기 FIX 제제는 투여 후 약 18~24시간의 반감기를 가지며, 주 2~3회 정맥 주사가 필요하다. 혈액 유래 FIX 제제는 여전히 일부에서 사용되지만, 바이러스 감염에 대한 안전성 우려가 있었다. 이를 보완하기 위해 개발된 재조합 FIX 제제인 베네픽스(BeneFIX& 9415;, Nonacog alfa)는 안전성이 확보되어 현재 임상에서 가장 널리 사용되고 있다.2) 반감기 연장(Extended half-life, EHL) FIX 제제 반감기 연장 제제는 기존 표준 제제보다 3~5배 긴 반감기를 가지며, 1~2주 간격으로 투여가 가능하다. 이들 약제에는 Fc-fusion 단백을 이용한 알프로릭스(Alprolix(& 9415;, Eftrenonacog alfa), albumin-fusion 기술이 적용된 아이델비온(Idelvion& 9415; Albutrepenonacog alfa) 등이 포함된다. 이러한 제제들은 주사 횟수를 줄여 환자의 삶의 질과 치료 순응도를 높이는 중요한 진보로 평가된다.2. 억제인자 환자 치료(Treatment for Patients with Inhibitors) 혈우병 B 환자에서 억제인자 발생은 상대적으로 드물지만, 일단 형성되면 치료가 매우 어렵다. 억제인자가 형성된 경우 기존 FIX 제제의 효과가 소실되므로 우회제제(bypassing agents)가 사용된다.활성화 프로트롬빈 복합체(aPCC, 훼이바, FEIBA& 9415;)와 재조합 활성 VIIa(rFVIIa, 노보세븐, NovoSeven& 9415;)가 대표적이다. 그러나 혈우병 A와 달리 에미시주맙은 FVIII 기능을 모방하는 기전이기 때문에 혈우병 B 환자에게는 효과가 없다. 따라서 억제인자 환자의 치료는 여전히 제한적이며, 새로운 치료 전략이 필요한 영역이다.3. 비응고인자 기반 치료(Non-factor Therapy) 혈우병 B에서도 비응고인자 기반 치료가 적용될 수 있다. 이들 약제는 특정 응고인자를 보충하지 않고 응고 균형 자체를 조절하는 기전을 갖는다. 대표적으로 RNA 간섭 기반의 피투시란(Fitusiran)은 간세포에서 항트롬빈 합성을 억제하여 응고 활성을 증가시키며, 혈우병 A와 B 모두에 승인되었다.또한 항 TFPI 항체인 콘시주맙(Concizumab, Alhemo®) 역시 혈우병 A와 B 모두에 적용 가능하며, 내인성 응고경로를 촉진하여 출혈을 억제한다. 이처럼 비응고인자 기반 치료는 억제인자 보유 여부와 관계없이 사용할 수 있는 장점이 있어, 혈우병 B 환자에서도 중요한 치료 대안으로 부상하고 있다.4. 유전자 치료(Gene Therapy) 혈우병 B는 유전자 치료 분야에서 가장 먼저 성과를 낸 질환 중 하나이다. FIX 유전자의 크기가 FVIII보다 작아 AAV 벡터 전달이 용이하기 때문에, 임상개발이 상대적으로 앞서 진행되었다.대표적인 약제는 헴제닉스(Hemgenix& 9415;, Etranacogene dezaparvovec)으로, 2022년 미국 FDA와 2023년 유럽 EMA에서 세계 최초로 혈우병 유전자 치료제로 승인되었다. 단회 정맥투여만으로 간세포에서 FIX 발현이 장기간 유지될 수 있으며, 환자의 치료 부담을 획기적으로 줄일 수 있다. 그러나 여전히 발현 지속 기간의 변동성, 간효소 상승, 재투여 불가 등의 문제점이 존재하며, 고가의 치료비용 역시 중요한 사회적 논의 대상이 되고 있다.피투시란은 어떤 약제인가?피투시란은 안티트롬빈(AT) mRNA를 절단·분해하여 AT 발현을 억제함으로써 혈중 AT 농도를 감소시키는 기전을 가진다. siRNA 치료제는 RNAi 과정을 활용하는 대표적인 플랫폼으로, 표적 mRNA를 인식하고 분해하도록 설계된 합성 RNA 이중가닥 구조를 기반으로 한다. 이 과정은 특정 단백질의 번역을 저해하여 표적 단백질의 합성을 효과적으로 억제한다.피투시란은 화학적으로 안정화된 이중가닥 siRNA로 설계되어 뉴클레아제에 의한 분해나 Toll-like receptor(TLR)3, TLR7 등 선천면역 수용체의 인식을 회피한다. 특히 리보뉴클레오티드의 2′-데옥시-2′-플루오로 치환, 2′-O-메틸 치환, 인산 골격의 선택적 변형이 적용되어 높은 안정성과 생체 내 지속성을 확보하였다.이 siRNA는 삼중 안테나(tri-antenna) 형태의 N-아세틸갈락토사민(GalNAc) 잔기와 결합되어 있으며, 간세포 표면의 아실글리코프로테인 수용체(asialoglycoprotein receptor, ASGPR)를 통해 효율적으로 간세포 내로 전달된다. 세포 내로 흡수된 후 산성 환경에서 siRNA는 ASGPR로부터 해리되고, 엔도솜을 탈출하여 세포질 내 RNA 유도 침묵 복합체(RNA-induced silencing complex, RISC)에 탑재된다.RISC는 siRNA의 안티센스(antisense) 가닥을 선택적으로 유지하고, 이를 이용해 표적 유전자인 SERPINC1 mRNA를 서열 특이적으로 절단·분해함으로써 AT 발현을 억제한다. 이 과정의 결과로 혈중 AT 농도가 감소하며, 그에 따라 트롬빈 생성이 증가하여 혈우병 환자의 응고능이 향상된다.RISC 내 안티센스 가닥은 세포 내에서 수 주간 안정적으로 존재하면서 반복적으로 전사체 절단을 매개하므로, 세포당 수백 개 수준의 siRNA 분자만으로도 강력하고 지속적인 knockdown 효과를 낸다. 이러한 특성 덕분에 피투시란은 임상시험에서 한 달에 한 번의 피하 투여만으로도 충분한 약효를 유지할 수 있는 장점을 보인다.Antithrombin Knockdown by Fitusiran(출처: Molecular Therapy Vol. 28 No 3 April 2020).피투시란의 약리 기전은?피투시란은 간에서 합성되는 AT(antithrombin) mRNA를 표적하는 siRNA로 개발된 약제로, 항트롬빈 발현을 효율적으로 억제함으로써 체내의 친응고 상태를 강화하는 새로운 치료 전략이다.즉, AT 억제 작용을 통해 내인성 및 외인성 경로 모두에서 Factor Xa와 트롬빈의 활성을 증가시켜 응고 연쇄의 효율성을 회복시키며, 그 결과 FVIII 또는 FIX 결핍이 있는 혈우병 환자에서도 출혈 위험을 효과적으로 감소시킨다.The Role of Thrombin and Antithrombin in Hemostasis, and the Mechanism of Action of Fitusiran(출처: Res Pract Thromb Haemost. 2023;7:e100179).피투시란은 혈우병 A 또는 B 환자의 출혈 예방을 위해 2개월에 한 번 피하 주사로 투여된다. 초기 권장 용량은 50mg이며, 이후 항트롬빈 활성도를 모니터링하여 용량과 투여 간격을 조정한다. 목표 AT 활성도는 15~35% 사이로 유지하는 것이 바람직하다.AT 활성도가 15% 미만으로 떨어질 경우 용량을 줄이고, 35% 이상으로 증가하면 용량을 늘릴 수 있다. 예를 들어, 50mg을 2개월 간격으로 투여하던 환자의 AT 활성도가 35%를 초과할 경우, 동일 용량을 매월 투여하도록 변경할 수 있다.약동학 연구에서 피투시란은 혈장에서 비교적 짧은 반감기(약 3~5시간)를 보였으나, 모든 임상시험 용량군에서 투여 중단 후에도 수개월간 AT 감소 효과가 지속되었다. 평균 AT 회복 속도는 한 달에 약 10~15% 수준이었으며, 이 기간 동안 트롬빈 생성은 억제되고 출혈 사건 발생 위험은 증가하는 경향을 보였다.투여 중단 후 약 5개월 시점에서 중앙값 AT 수치는 약 60% 이상으로 회복되었다. 약력학적 분석 결과, AT 억제 효과는 첫 투여 후 약 15~28일 사이에 나타났으며, 개인 간 AT 감소 정도에는 차이가 있으나 개인 내에서는 일정하게 유지되어 지속적인 지혈 보호 효과를 제공하는 것으로 확인되었다.피투시란은 또한 비인자(non-factor) 치료제 중 유일하게 특정 역전제(reversal agent)를 보유한 약제로, 이는 재조합 또는 혈장 유래 항트롬빈 제제 형태로 제공된다. 이러한 역전제는 돌파성 출혈 시 다른 지혈제와 병용할 경우 혈전증 위험을 조절할 수 있다는 점에서 임상적으로 중요한 의미를 갖는다.한편, 혈중 AT 감소가 표준 응고 검사에 직접적인 영향을 미치지 않는다는 점은, CFC(concentrated factor concentrate) 또는 BPA(bypassing agent)를 사용하는 상황이나 수술 시 지혈 상태 및 인자 수치를 보다 용이하게 모니터링할 수 있음을 시사한다.피투시란(QFITLIA)의 허가임상은 어떠한가?성인 및 12세 이상의 소아 환자에서 억제인자(inhibitors)의 존재 여부와 관계없이 혈우병 A 또는 B를 가진 환자에서 QFITLIA의 유효성과 안전성은 두 건의 임상시험에서 입증되었다.-억제인자가 있는 혈우병 A 또는 B: ATLAS-INH -억제인자가 없는 혈우병 A 또는 B: ATLAS-A/B위의 본 임상시험에 참여한 환자들은 장기 연장 연구인 ATLAS-OLE로 이월되었다.임상시험 ATLAS-INH 및 ATLAS-A/B에서는 QFITLIA 80mg 고정 월 1회 용량을 시험하였다. 그러나 이 용량에서 혈전성 사건(thrombotic events)이 발생하여, ATLAS-OLE에서는 항트롬빈(AT) 활성 15& 8211;35%를 목표로 하는 QFITLIA AT-DR 용법이 도입되었다.AT-DR 용법은 ATLAS-INH 및 ATLAS-A/B 연구가 거의 완료될 시점에 도입되었으므로, QFITLIA AT-DR 치료의 유효성은 장기 연장 연구 ATLAS-OLE에서 얻어진 AT-DR 치료 데이터를 ATLAS-INH 및 ATLAS-A/B 연구의 대조(control) 데이터와 비교하여 평가되었다.유효성 분석은 본 임상시험들의 무작위 배정(randomization)을 보존하면서, 부모 연구(parent studies)에서의 의도한 치료(intent-to-treat, ITT) 원칙에 따라 수행되었다.[ATLAS-INH] ATLAS-INH은 혈우병 A 또는 B 환자 중 FVIII(제8인자) 또는 FIX(제9인자)에 대한 억제항체를 가진 성인 및 소아 남성 환자(≥12세) 57명을 대상으로 실시된 다기관, 무작위배정, 공개(open-label) 임상시험이었다. 이들은 모두 과거에 출혈 시 우회제제(BPAs)를 필요에 따라(episodic, on-demand) 투여받은 병력이 있었다.대상 환자들은 2:1 비율로 무작위 배정되어, 월 1회 80mg 고정 용량의 QFITLIA 피하 주사(SC)를 예방요법(prophylaxis)으로 투여받은 군(N=38)과, 돌발 출혈(breakthrough bleeding) 발생 시 BPA를 필요에 따라 투여받은 군(N=19)으로 나뉘어 9개월간 치료를 받았다.그러나 QFITLIA 80mg 용량은 심각한 혈전성 사건(thrombotic events), 담낭 질환(담낭절제술 필요 포함), 간독성(hepatotoxicity) 위험 증가로 인해 승인되지 않았다. 현재 50mg과 20mg이 허가되어 있다.[ATLAS A/B] ATLAS A/B는 FVIII(제8인자) 또는 FIX(제9인자)에 대한 억제항체가 없는 혈우병 A 또는 B 환자를 대상으로 한 다기관, 무작위배정, 공개(open-label) 임상시험이었다. 대상자는 모두 성인 및 소아 남성(≥12세)으로, 과거에 출혈 시 응고인자제제(CFC)를 필요에 따라(on-demand, episodic) 투여받은 병력이 있었다.대상 환자 120명은 2:1 비율로 무작위 배정되어, 월 1회 80 mg 고정 용량의 QFITLIA 피하 주사(SC)를 예방요법(prophylaxis)으로 투여받은 군(N=80)과, 돌발 출혈 발생 시 CFC를 필요에 따라 투여받은 군(N=40)으로 나뉘어 9개월간 치료를 받았다.그러나 QFITLIA 80mg용량은 심각한 혈전성 사건(thrombotic events), 담낭 질환(담낭절제술 필요 포함), 간독성(hepatotoxicity) 위험 증가로 인해 승인되지 않았다.[ATLAS-OLE] 총 227명의 환자가 두 임상시험(ATLAS-INH 및 ATLAS-A/B)과, CFC 또는 BPA 예방요법을 받던 환자를 대상으로 한 교차 임상시험 ATLAS-PPX에서 이월되어 ATLAS-OLE 연구에서 QFITLIA 치료를 받았다. 이 다기관 공개 연장 임상시험은 FVIII 또는 FIX 억제항체 유무와 관계없이, 12세 이상의 성인 및 소아 남성 혈우병 A 또는 B 환자에서 QFITLIA의 장기적인 안전성과 유효성을 평가하였다.대상자는 초기에는 월 1회 80mg QFITLIA 피하 주사를 투여받았으나, 연구가 개정되어 AT-DR(항트롬빈 활성 15& 8211;35% 목표) 용법의 유효성과 안전성을 평가하도록 설계가 변경되었다. 이후 총 213명의 환자가 AT-DR로 전환되었다.AT-DR에서는 시작 용량이 50mg 격월(2개월 간격) 투여였으며, INNOVANCE Antithrombin 분석법을 이용해 측정한 AT 활성 수치에 따라 개별적으로 용량을 조정하였다. 용량은 50mg 월 1회 또는 80mg 월 1회로 증량하거나, 20mg 격월 또는 20mg 월 1회로 감량할 수 있었다.AT 활성 수치가 최저 용량에서도2025-10-23 23:25:17최병철 박사 -
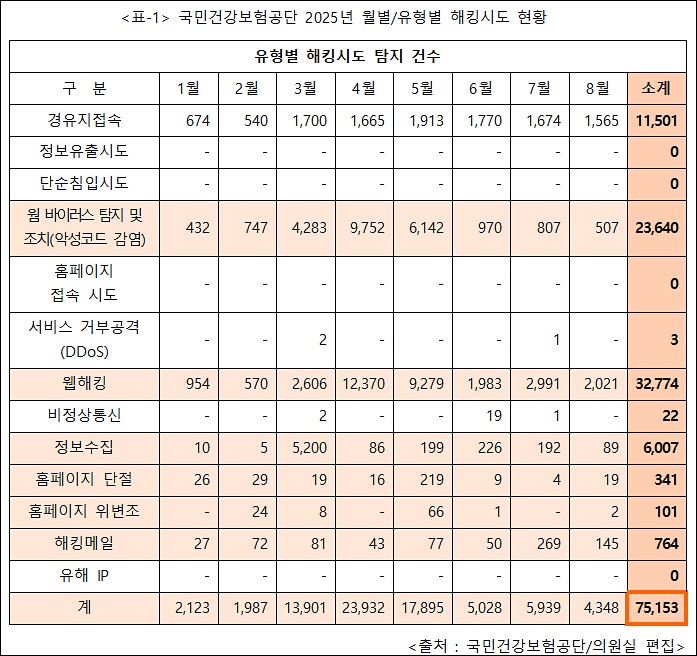 "건보공단 사이버 공격 시도, 올해만 7만5천건 초과"[데일리팜=이정환 기자] 국민건강보험공단을 타깃으로 한 사이버 공격 시도가 올해 들어서만 무려 7만5153건 발생한 것으로 집계됐다. 이 가운데 웹 해킹 시도가 3만2774건으로 가장 많았다17일 이주영 개혁신당 의원이 국민건강보험공단으로부터 제출받은 '건보공단 2025년 월별/유형별 해킹시도 현황'자료를 분석한 결과다.웹 해킹 등 13개 유형별 해킹시도 건은 1월에 2123건, 2월 1987건, 3월 1만3901건, 4월 2만3932건, 5월 1만7895건, 6월 5028건, 7월 5939건 그리고 8월에 4348건 등 총 7만5153건이 발생했다.특히 웹사이트 취약점을 악용해 권한 없이 시스템에 접근하거나, 데이터 유출·파괴 등 피해를 유발하는 기술적 위협인 웹 해킹 시도가 3만2774건으로 가장 많았다. 네트워크를 통해 스스로 복제하며 확산되는 웜 바이러스 등 악성코드 감염건은 2만 3640건으로 뒤를 이었다.또한 공단 정보수집을 위한 해킹시도는 6007건, 해킹메일 764건, 공단 홈페이지 단절·위변조 해킹시도 건도 642건 발생했다.이주영 의원은 "최근 SK텔레콤 고객 정보 유출 해킹 사고, KT 불법 펨토셀 소액결제 해킹 사고 등 잇따라 발생하고 있는 해킹 사고에 공공부문도 예외일 수 없다는 우려가 있다"며 "공단이 보유하고 있는 데이터는 국민의 안전 및 생명과 직결되는 것인 만큼 사이버공격으로부터 빈틈이 없도록 보안 대책을 강화해 나가야 할 것이라고 강조했다.2025-10-17 15:05:52이정환
"건보공단 사이버 공격 시도, 올해만 7만5천건 초과"[데일리팜=이정환 기자] 국민건강보험공단을 타깃으로 한 사이버 공격 시도가 올해 들어서만 무려 7만5153건 발생한 것으로 집계됐다. 이 가운데 웹 해킹 시도가 3만2774건으로 가장 많았다17일 이주영 개혁신당 의원이 국민건강보험공단으로부터 제출받은 '건보공단 2025년 월별/유형별 해킹시도 현황'자료를 분석한 결과다.웹 해킹 등 13개 유형별 해킹시도 건은 1월에 2123건, 2월 1987건, 3월 1만3901건, 4월 2만3932건, 5월 1만7895건, 6월 5028건, 7월 5939건 그리고 8월에 4348건 등 총 7만5153건이 발생했다.특히 웹사이트 취약점을 악용해 권한 없이 시스템에 접근하거나, 데이터 유출·파괴 등 피해를 유발하는 기술적 위협인 웹 해킹 시도가 3만2774건으로 가장 많았다. 네트워크를 통해 스스로 복제하며 확산되는 웜 바이러스 등 악성코드 감염건은 2만 3640건으로 뒤를 이었다.또한 공단 정보수집을 위한 해킹시도는 6007건, 해킹메일 764건, 공단 홈페이지 단절·위변조 해킹시도 건도 642건 발생했다.이주영 의원은 "최근 SK텔레콤 고객 정보 유출 해킹 사고, KT 불법 펨토셀 소액결제 해킹 사고 등 잇따라 발생하고 있는 해킹 사고에 공공부문도 예외일 수 없다는 우려가 있다"며 "공단이 보유하고 있는 데이터는 국민의 안전 및 생명과 직결되는 것인 만큼 사이버공격으로부터 빈틈이 없도록 보안 대책을 강화해 나가야 할 것이라고 강조했다.2025-10-17 15:05:52이정환 -
 SKT 특허 '생체인증 전자처방 서비스' 무상 이전한다[데일리팜=강신국 기자] SK텔레콤이 보유한 생체인증 기반 전자처방전 서비스 특허를 무상으로 사용할 수 있게 됐다.이는 대기업·공공기관 등이 보유한 미활용 우수 기술을 중소·중견기업에 무상으로 이전하고, 관련 기술의 사업화 지원하는 기숨나눔 사업의 일환이다.산업통상부(장관 김정관)는 14일 서울 양재 엘타워(오르체홀)에서 SK그룹 50여 개 기술나눔 수혜기업 대표 등이 참석한 가운데 2025년 산업부-SK그룹 기술나눔 행사를 개최했다.올해 나눔대상 기술은 SK그룹이 선도하는 기술분야인 통신, 반도체, 화학·소재와, 신기술 분야인 스마트 의료 관련 특허들로 이뤄졌다.이중 '생체인증 기반 전자처방 서비스 인증 시스템'은 의료기관에서 종이처방전이 아닌 전자처방전을 생성한 후 환자의 생체정보 인증을 거쳐 약국으로 전송하는 기술로 가장 많은 기업의 관심을 모았다.즉 종이처방전이 아닌 전자처방전을 사용함으로써 의약품의 처방·조제 오류를 줄이고, 환자 인증 수단을 마련해 처방전 전송 과정의 안정성을 향상시켰다는 것이다.오승철 산업부 산업기반실장은 "이번에 제공된 SK그룹의 우수기술들은 기업들의 기술 경쟁력 확보에 큰 도움이 될 것"이라며 "앞으로도 우리 기업들이 필요로 하는 똑똑한 기술이 이전될 수 있도록 노력하겠다"고 밝혔다.2025-10-16 11:26:15강신국
SKT 특허 '생체인증 전자처방 서비스' 무상 이전한다[데일리팜=강신국 기자] SK텔레콤이 보유한 생체인증 기반 전자처방전 서비스 특허를 무상으로 사용할 수 있게 됐다.이는 대기업·공공기관 등이 보유한 미활용 우수 기술을 중소·중견기업에 무상으로 이전하고, 관련 기술의 사업화 지원하는 기숨나눔 사업의 일환이다.산업통상부(장관 김정관)는 14일 서울 양재 엘타워(오르체홀)에서 SK그룹 50여 개 기술나눔 수혜기업 대표 등이 참석한 가운데 2025년 산업부-SK그룹 기술나눔 행사를 개최했다.올해 나눔대상 기술은 SK그룹이 선도하는 기술분야인 통신, 반도체, 화학·소재와, 신기술 분야인 스마트 의료 관련 특허들로 이뤄졌다.이중 '생체인증 기반 전자처방 서비스 인증 시스템'은 의료기관에서 종이처방전이 아닌 전자처방전을 생성한 후 환자의 생체정보 인증을 거쳐 약국으로 전송하는 기술로 가장 많은 기업의 관심을 모았다.즉 종이처방전이 아닌 전자처방전을 사용함으로써 의약품의 처방·조제 오류를 줄이고, 환자 인증 수단을 마련해 처방전 전송 과정의 안정성을 향상시켰다는 것이다.오승철 산업부 산업기반실장은 "이번에 제공된 SK그룹의 우수기술들은 기업들의 기술 경쟁력 확보에 큰 도움이 될 것"이라며 "앞으로도 우리 기업들이 필요로 하는 똑똑한 기술이 이전될 수 있도록 노력하겠다"고 밝혔다.2025-10-16 11:26:15강신국 -
 이식편대숙주질환 신약 '닉팀보', 국내 상용화 전망[데일리팜=어윤호 기자] 이식편대숙주질환치료제 '닉팀보(Niktimvo)'의 국내 상용화가 예상된다.관련 업계에 따르면 식품의약품안전처는 최근 닉팀보(악사틸리맙)의 허가 심사에 돌입했다.닉팀보는 지난 4월 국내 희귀의약품으로 지정된 바 있다. 구체적인 지정 적응증은 '성인 및 40kg 이상의 소아 환자에서 이전에 두 가지 이상의 전신요법에 실패한 만성 이식편대숙주질환(GvHD, Graft-versus-Host Disease)'이다.GvHD는 동종 조혈모세포 이식(allo-SCT, allogeneic hematopoietic stem cell transplant) 후에 나타날 수 있는 위중한 합병증이다.이식된 공여자의 T세포가 환자의 정상적인 세포를 이물질로 인식/공격해 피부, 위장관, 간, 폐 등 여러 장기에 영향을 미친다. 전신에서 증상이 나타날 수 있는 만큼 GvHD는 동종 조혈모세포 이식 과정을 이겨낸 환자들에게 또 다른 어려움을 안기며 환자 삶의 질에 영향을 준다.1차요법으로 스테로이드가 사용되는데, 이중 약 50% 정도가 치료에 실패하며 이러한 경우 아직 표준 치료법이 정립되지 않아 효과적인 치료 옵션에 대한 미충족 수요가 존재했다.이같은 상황에서 지난해 8월 미국 FDA 승인을 획득한 닉팀보는 이전 치료 후 질병이 진행된 만성 GvHD 환자들의 심각한 합병증을 해결하는데 도움이 되는 새로운 작용 기전의 치료옵션으로 주목받고 있다.국내에서는 한국노바티스의 '자카비(룩소리티닙)'가 2023년 11월 보험급여 목록에 등재됐으며, 사노피코리아의 '레주록(벨루모수딜)'이 급여 절차를 진행중이다.한편 닉팀보는 이전에 두 가지 전신 치료를 받은 불응성 소아 및 성인 만성 이식편대숙주병 환자 241명을 대상으로 진행된 AGAVE-201 연구를 통해 유효성을 입증했다.임상 결과, 닉팀보를 투여받은 모든 코호트에서 1차 평가변수가 충족된 것으로 나타났다. 연구된 모든 장기와 환자 하위그룹에 걸쳐 지속적인 반응이 관찰됐다.닉팀보를 승인된 용량인 0.3mg/kg으로 2주마다 투여받은 환자 중 75%는 치료 첫 6개월 이내에 반응에 도달했고(ORR, 전체반응률) 반응까지의 시간 중앙값은 1.5개월이었다. 환자의 60%는 치료 12개월 시점에 반응이 유지된 것으로 파악됐다.2025-09-30 06:07:55어윤호
이식편대숙주질환 신약 '닉팀보', 국내 상용화 전망[데일리팜=어윤호 기자] 이식편대숙주질환치료제 '닉팀보(Niktimvo)'의 국내 상용화가 예상된다.관련 업계에 따르면 식품의약품안전처는 최근 닉팀보(악사틸리맙)의 허가 심사에 돌입했다.닉팀보는 지난 4월 국내 희귀의약품으로 지정된 바 있다. 구체적인 지정 적응증은 '성인 및 40kg 이상의 소아 환자에서 이전에 두 가지 이상의 전신요법에 실패한 만성 이식편대숙주질환(GvHD, Graft-versus-Host Disease)'이다.GvHD는 동종 조혈모세포 이식(allo-SCT, allogeneic hematopoietic stem cell transplant) 후에 나타날 수 있는 위중한 합병증이다.이식된 공여자의 T세포가 환자의 정상적인 세포를 이물질로 인식/공격해 피부, 위장관, 간, 폐 등 여러 장기에 영향을 미친다. 전신에서 증상이 나타날 수 있는 만큼 GvHD는 동종 조혈모세포 이식 과정을 이겨낸 환자들에게 또 다른 어려움을 안기며 환자 삶의 질에 영향을 준다.1차요법으로 스테로이드가 사용되는데, 이중 약 50% 정도가 치료에 실패하며 이러한 경우 아직 표준 치료법이 정립되지 않아 효과적인 치료 옵션에 대한 미충족 수요가 존재했다.이같은 상황에서 지난해 8월 미국 FDA 승인을 획득한 닉팀보는 이전 치료 후 질병이 진행된 만성 GvHD 환자들의 심각한 합병증을 해결하는데 도움이 되는 새로운 작용 기전의 치료옵션으로 주목받고 있다.국내에서는 한국노바티스의 '자카비(룩소리티닙)'가 2023년 11월 보험급여 목록에 등재됐으며, 사노피코리아의 '레주록(벨루모수딜)'이 급여 절차를 진행중이다.한편 닉팀보는 이전에 두 가지 전신 치료를 받은 불응성 소아 및 성인 만성 이식편대숙주병 환자 241명을 대상으로 진행된 AGAVE-201 연구를 통해 유효성을 입증했다.임상 결과, 닉팀보를 투여받은 모든 코호트에서 1차 평가변수가 충족된 것으로 나타났다. 연구된 모든 장기와 환자 하위그룹에 걸쳐 지속적인 반응이 관찰됐다.닉팀보를 승인된 용량인 0.3mg/kg으로 2주마다 투여받은 환자 중 75%는 치료 첫 6개월 이내에 반응에 도달했고(ORR, 전체반응률) 반응까지의 시간 중앙값은 1.5개월이었다. 환자의 60%는 치료 12개월 시점에 반응이 유지된 것으로 파악됐다.2025-09-30 06:07:55어윤호 -
 보험급여 1보 전진 '레테브모'...RET 항암제 운명은?[데일리팜=어윤호 기자] 그림의 떡이 될 뻔했던 RET 표적항암제 '레테브모'가 어려운 1보 전진을 이뤄냈다. 연내 건강보험심사평가원 평가 절차를 마무리할 수 있을지 지켜 볼 부분이다.얼마전 한국릴리의 RET(REarranged during Transfection) 저해제 레테브모(셀퍼카티닙)의 비소세포폐암과 갑상선수질암 적응증이 동시에 심평원 암질환심의위원회를 통과했다.세번째 도전에서의 첫 결실이다. 지난 2022년 3월 국내 허가된 레테브모는 같은해 5월 건강보험심사평가원 암질환심의위원회를 통과하지 못했지만 11월 암질심의 벽을 넘고 2023년 5월 약제급여평가위원회를 최종 통과했다.약평위 통과 후 6월, 국민건강보험공단과 약가협상에 돌입하면서 급여 등재 기대감이 커졌지만, 결국 합의를 이뤄내지 못했다. 이는 당해년도 유일한 약가협상 불발 소식이었다.이에 따라 우리나라에서 RET 항암제 옵션은 유명무실해 질 것으로 예상됐다. 국내 허가된 RET 항암제는 2종이다. 레테브모 이외 한국로슈가 블루프린트로부터 도입한 '가브레토(프랄세티닙)'가 있다. 그러나 로슈가 판권을 내려 놓으면서 가브레토의 등재는 기대하기 어려운 상황이다.하지만 릴리 한국법인이 꺼져가는 불씨를 살렸다. 끝까지 등재 절차를 마무리할 수 있을지 관심이 모아진다.반전의 여지는 있다. 지금의 레테브모는 전체생존기간(OS) 데이터를 비롯해 제대로 된 3상 연구 결과가 확보된 상태다. 이제 릴리와 정부의 RET 항암제 도입에 대한 의지가 중요하다.한편 레테브모는 2020년 미국에서 신속 심사(Accelerated Approval), 우선 심사(Priority Review), 혁신의약품 및 희귀의약품 지정(Breakthrough Therapy & Orphan Drug Designation)을 적용 받아 RET 유전자 변이 암 환자를 위한 최초의 치료옵션으로 승인됐다.레테브모 허가 이전에 RET 변이 비소세포폐암 및 갑상선암 환자들에게 사용할 수 있는 표적치료 옵션은 없었다.그렇기 때문에 식품의약품안전처는 레테브모를 신속심사 제도를 통해 ▲전이성 RET 융합-양성 비소세포폐암 성인 환자 ▲전신요법을 요하는 진행성 또는 전이성 RET-변이 갑상선 수질암이 있는 성인 및 만 12세 이상 소아 환자 ▲방사선 요오드에 불응하고 이전 소라페닙 또는 렌바티닙의 치료 경험이 있으며 전신요법을 요하는 진행성 또는 전이성 RET 융합-양성 갑상선암 성인 환자를 위한 치료제로 승인했다.현재 약가참조국인 A7 국가 중 프랑스를 제외한 6개국(미국, 독일, 이탈리아 영국, 스위스, 일본)에서 레테브모는 임상현장에서 급여 약제로 사용되고 있다.2025-09-23 06:12:08어윤호
보험급여 1보 전진 '레테브모'...RET 항암제 운명은?[데일리팜=어윤호 기자] 그림의 떡이 될 뻔했던 RET 표적항암제 '레테브모'가 어려운 1보 전진을 이뤄냈다. 연내 건강보험심사평가원 평가 절차를 마무리할 수 있을지 지켜 볼 부분이다.얼마전 한국릴리의 RET(REarranged during Transfection) 저해제 레테브모(셀퍼카티닙)의 비소세포폐암과 갑상선수질암 적응증이 동시에 심평원 암질환심의위원회를 통과했다.세번째 도전에서의 첫 결실이다. 지난 2022년 3월 국내 허가된 레테브모는 같은해 5월 건강보험심사평가원 암질환심의위원회를 통과하지 못했지만 11월 암질심의 벽을 넘고 2023년 5월 약제급여평가위원회를 최종 통과했다.약평위 통과 후 6월, 국민건강보험공단과 약가협상에 돌입하면서 급여 등재 기대감이 커졌지만, 결국 합의를 이뤄내지 못했다. 이는 당해년도 유일한 약가협상 불발 소식이었다.이에 따라 우리나라에서 RET 항암제 옵션은 유명무실해 질 것으로 예상됐다. 국내 허가된 RET 항암제는 2종이다. 레테브모 이외 한국로슈가 블루프린트로부터 도입한 '가브레토(프랄세티닙)'가 있다. 그러나 로슈가 판권을 내려 놓으면서 가브레토의 등재는 기대하기 어려운 상황이다.하지만 릴리 한국법인이 꺼져가는 불씨를 살렸다. 끝까지 등재 절차를 마무리할 수 있을지 관심이 모아진다.반전의 여지는 있다. 지금의 레테브모는 전체생존기간(OS) 데이터를 비롯해 제대로 된 3상 연구 결과가 확보된 상태다. 이제 릴리와 정부의 RET 항암제 도입에 대한 의지가 중요하다.한편 레테브모는 2020년 미국에서 신속 심사(Accelerated Approval), 우선 심사(Priority Review), 혁신의약품 및 희귀의약품 지정(Breakthrough Therapy & Orphan Drug Designation)을 적용 받아 RET 유전자 변이 암 환자를 위한 최초의 치료옵션으로 승인됐다.레테브모 허가 이전에 RET 변이 비소세포폐암 및 갑상선암 환자들에게 사용할 수 있는 표적치료 옵션은 없었다.그렇기 때문에 식품의약품안전처는 레테브모를 신속심사 제도를 통해 ▲전이성 RET 융합-양성 비소세포폐암 성인 환자 ▲전신요법을 요하는 진행성 또는 전이성 RET-변이 갑상선 수질암이 있는 성인 및 만 12세 이상 소아 환자 ▲방사선 요오드에 불응하고 이전 소라페닙 또는 렌바티닙의 치료 경험이 있으며 전신요법을 요하는 진행성 또는 전이성 RET 융합-양성 갑상선암 성인 환자를 위한 치료제로 승인했다.현재 약가참조국인 A7 국가 중 프랑스를 제외한 6개국(미국, 독일, 이탈리아 영국, 스위스, 일본)에서 레테브모는 임상현장에서 급여 약제로 사용되고 있다.2025-09-23 06:12:08어윤호 -
 지노믹트리 '얼리텍 BCD' 미국비뇨기과학회 지침 등재[데일리팜=이석준 기자] 지노믹트리(대표이사 안성환)는 ‘얼리텍(EarlyTect) BCD’가 미국비뇨기과학회(AUA)의 최신 임상 가이드라인 ‘무증상 미세혈뇨 환자 평가 기준’에 공식 포함됐다고 17일 밝혔다.회사에 따르면 AUA는 비뇨기 질환의 진단과 치료 지침을 제정하는 세계적으로 가장 권위 있는 학술·임상 기관 중 하나다. 이들 가이드라인은 국제적으로 진료 표준으로 활용된다.이번 2025년 개정판에서 미국비뇨기과학회는 임상적으로 검증된 소변 기반 ‘PENK 메틸화’ 바이오마커 검사법 ‘얼리텍(EarlyTect) BCD’를 저위험군과 중등도 위험군에 속하는 미세혈뇨 환자의 방광암 위험 평가에 활용할 수 있음을 명시했다. ‘얼리텍(EarlyTect) BCD’가 표준 진료 지침 내에서 임상적 활용 근거를 공식적으로 인정받은 것이다.안성환 지노믹트리 대표는 “혈뇨는 비뇨기과에서 가장 흔히 접하면서도 임상적으로 복잡한 증상이다. ‘얼리텍(EarlyTect) BCD’는 근거 기반의 실용적인 도구로 임상의가 어떤 환자가 보다 집중적인 검사가 필요한지를 판단할 수 있도록 돕고, 동시에 불필요한 침습적 시술을 줄이는 데 기여한다. 이번 미국비뇨기과학회 가이드라인 등재는 환자와 의료진 모두에게 실질적인 가치를 제공한다는 점을 보여주는 중요한 성과”라고 강조했다.이번 성과는 지노믹트리의 미국 자회사 ‘프로미스 다이애그노스틱스(Promis Diagnostics)’의 주도 아래 이뤄졌다. ‘얼리텍(EarlyTect) BCD’의 성능평가는 한국과 미국에서 동시에 진행해 관련 저널에 보고된 바 있다.특히 이번 등재와 직접적으로 연관된 주요 확증임상 시험은 대규모 전향적 다기관 연구로 수행 돼 진단성능에 대한 유효성이 통계적으로 유의하게 입증됐다. 해당 연구 결과는 세계적 권위를 지닌 학술지 ‘자마 온콜로지(JAMA Oncology)’ 게재로 신뢰성을 인정받았다.또한 ‘얼리텍(EarlyTect) BCD’는 미국 식품의약국(FDA)과 한국 식품의약품안전처(MFDS)로부터 각각 ‘혁신의료기기(Breakthrough Medical Device)’로 지정되며, 기술적 우수성과 임상적 가치를 동시에 인정받았다.현재 한국 식약처의 의료기기 제조허가 심사가 진행 중이다. 이번 미국비뇨기과학회 가이드라인 공식 등재는 글로벌 임상 도입과 제도권 내 보상 확대를 앞당기는 중요한 전환점이 될 것으로 평가된다.지노믹트리는 독창적인 DNA 메틸화 기반 바이오마커 발굴과 진단 플랫폼 기술을 통해 암 조기 진단과 정밀의료를 선도하는 헬스케어 기업이다. 환자에게는 비침습적이고 정확한 진단 솔루션을, 의료진에게는 임상적 의사결정을 지원하는 혁신적 도구를 제공하고 있다.2025-09-17 09:46:14이석준
지노믹트리 '얼리텍 BCD' 미국비뇨기과학회 지침 등재[데일리팜=이석준 기자] 지노믹트리(대표이사 안성환)는 ‘얼리텍(EarlyTect) BCD’가 미국비뇨기과학회(AUA)의 최신 임상 가이드라인 ‘무증상 미세혈뇨 환자 평가 기준’에 공식 포함됐다고 17일 밝혔다.회사에 따르면 AUA는 비뇨기 질환의 진단과 치료 지침을 제정하는 세계적으로 가장 권위 있는 학술·임상 기관 중 하나다. 이들 가이드라인은 국제적으로 진료 표준으로 활용된다.이번 2025년 개정판에서 미국비뇨기과학회는 임상적으로 검증된 소변 기반 ‘PENK 메틸화’ 바이오마커 검사법 ‘얼리텍(EarlyTect) BCD’를 저위험군과 중등도 위험군에 속하는 미세혈뇨 환자의 방광암 위험 평가에 활용할 수 있음을 명시했다. ‘얼리텍(EarlyTect) BCD’가 표준 진료 지침 내에서 임상적 활용 근거를 공식적으로 인정받은 것이다.안성환 지노믹트리 대표는 “혈뇨는 비뇨기과에서 가장 흔히 접하면서도 임상적으로 복잡한 증상이다. ‘얼리텍(EarlyTect) BCD’는 근거 기반의 실용적인 도구로 임상의가 어떤 환자가 보다 집중적인 검사가 필요한지를 판단할 수 있도록 돕고, 동시에 불필요한 침습적 시술을 줄이는 데 기여한다. 이번 미국비뇨기과학회 가이드라인 등재는 환자와 의료진 모두에게 실질적인 가치를 제공한다는 점을 보여주는 중요한 성과”라고 강조했다.이번 성과는 지노믹트리의 미국 자회사 ‘프로미스 다이애그노스틱스(Promis Diagnostics)’의 주도 아래 이뤄졌다. ‘얼리텍(EarlyTect) BCD’의 성능평가는 한국과 미국에서 동시에 진행해 관련 저널에 보고된 바 있다.특히 이번 등재와 직접적으로 연관된 주요 확증임상 시험은 대규모 전향적 다기관 연구로 수행 돼 진단성능에 대한 유효성이 통계적으로 유의하게 입증됐다. 해당 연구 결과는 세계적 권위를 지닌 학술지 ‘자마 온콜로지(JAMA Oncology)’ 게재로 신뢰성을 인정받았다.또한 ‘얼리텍(EarlyTect) BCD’는 미국 식품의약국(FDA)과 한국 식품의약품안전처(MFDS)로부터 각각 ‘혁신의료기기(Breakthrough Medical Device)’로 지정되며, 기술적 우수성과 임상적 가치를 동시에 인정받았다.현재 한국 식약처의 의료기기 제조허가 심사가 진행 중이다. 이번 미국비뇨기과학회 가이드라인 공식 등재는 글로벌 임상 도입과 제도권 내 보상 확대를 앞당기는 중요한 전환점이 될 것으로 평가된다.지노믹트리는 독창적인 DNA 메틸화 기반 바이오마커 발굴과 진단 플랫폼 기술을 통해 암 조기 진단과 정밀의료를 선도하는 헬스케어 기업이다. 환자에게는 비침습적이고 정확한 진단 솔루션을, 의료진에게는 임상적 의사결정을 지원하는 혁신적 도구를 제공하고 있다.2025-09-17 09:46:14이석준 -
 서울시약, 약대생 인플루언서 선발해 '건강서울' 홍보[데일리팜=정흥준 기자] 서울시약사회(회장 김위학)는 오는 10월 26일 개최하는 ‘2025 건강서울 페스티벌’을 앞두고 행사 홍보를 함께할 약대생 인플루언서를 모집한다.이번 모집은 SNS 활동에 관심이 있고 건강 관련 콘텐츠 제작이 가능한 전국 약대생을 대상으로 심사를 통해 15명을 선발한다.선발된 약학대학 재학생 인플루언서는 9월부터 약 4주간 활동한다. 건강상식, 약 이야기, 약대생 일상 브이로그, 행사 즐기는 법 등 다양한 주제를 담은 콘텐츠를 제작해 매주 1~2편 업로드하게 된다.참가자는 개인 SNS 계정(인스타그램·틱톡·유튜브 등)에 콘텐츠를 직접 게재해야 한다. 필수 해시태그( 건강서울페스티벌 건강서울 약대생인플루언서)와 공식 로고를 사용해야 한다.인스타그램 업로드 시 시약사회 공식 인스타그램(@spa__official2) 계정을 반드시 멘션해야 하며, 기타 채널에서는 해시태그와 공식 홈페이지 주소를 포함해야 한다.선발된 약학대학 재학생 인플루언서에게는 ▲건강서울 페스티벌 공식 약대생 인플루언서 인증서 ▲소정의 활동비(10만원)와 기념품 ▲행사 공식 SNS 및 홈페이지(Health Spot 카테고리) 소개 혜택이 주어진다. 또한 활동 종료 후 행사 당일 시상식에서 우수 인플루언서 1명에게 상패가 수여된다.모집 기간은 9월 3일부터 14일까지다. 참가 신청은 서울시약사회 홈페이지(www.spa.or.kr) 또는 구글품(https://forms.gle/aTcktHKqiWLo1bb76) 을 통해 접수할 수 있다.김영진 공동준비위원장은 “젊은 약대생들의 시각으로 건강과 약 이야기를 시민들에게 보다 쉽고 친근하게 전달하는 것이 이번 프로그램의 목적”이라며 “약학대학 재학생 인플루언서들이 자연스럽게 건강한 생활 문화를 알리고, 시민과 소통하는 가교 역할을 해주길 기대한다”며 많은 참여를 요청했다.2025-09-03 17:00:32정흥준
서울시약, 약대생 인플루언서 선발해 '건강서울' 홍보[데일리팜=정흥준 기자] 서울시약사회(회장 김위학)는 오는 10월 26일 개최하는 ‘2025 건강서울 페스티벌’을 앞두고 행사 홍보를 함께할 약대생 인플루언서를 모집한다.이번 모집은 SNS 활동에 관심이 있고 건강 관련 콘텐츠 제작이 가능한 전국 약대생을 대상으로 심사를 통해 15명을 선발한다.선발된 약학대학 재학생 인플루언서는 9월부터 약 4주간 활동한다. 건강상식, 약 이야기, 약대생 일상 브이로그, 행사 즐기는 법 등 다양한 주제를 담은 콘텐츠를 제작해 매주 1~2편 업로드하게 된다.참가자는 개인 SNS 계정(인스타그램·틱톡·유튜브 등)에 콘텐츠를 직접 게재해야 한다. 필수 해시태그( 건강서울페스티벌 건강서울 약대생인플루언서)와 공식 로고를 사용해야 한다.인스타그램 업로드 시 시약사회 공식 인스타그램(@spa__official2) 계정을 반드시 멘션해야 하며, 기타 채널에서는 해시태그와 공식 홈페이지 주소를 포함해야 한다.선발된 약학대학 재학생 인플루언서에게는 ▲건강서울 페스티벌 공식 약대생 인플루언서 인증서 ▲소정의 활동비(10만원)와 기념품 ▲행사 공식 SNS 및 홈페이지(Health Spot 카테고리) 소개 혜택이 주어진다. 또한 활동 종료 후 행사 당일 시상식에서 우수 인플루언서 1명에게 상패가 수여된다.모집 기간은 9월 3일부터 14일까지다. 참가 신청은 서울시약사회 홈페이지(www.spa.or.kr) 또는 구글품(https://forms.gle/aTcktHKqiWLo1bb76) 을 통해 접수할 수 있다.김영진 공동준비위원장은 “젊은 약대생들의 시각으로 건강과 약 이야기를 시민들에게 보다 쉽고 친근하게 전달하는 것이 이번 프로그램의 목적”이라며 “약학대학 재학생 인플루언서들이 자연스럽게 건강한 생활 문화를 알리고, 시민과 소통하는 가교 역할을 해주길 기대한다”며 많은 참여를 요청했다.2025-09-03 17:00:32정흥준 -
 송파구약, 약국 관광객 편의 위해 환급업체 'KTP'와 협약[데일리팜=정흥준 기자] 송파구약사회(회장 최명수) 총무위원회(부회장 박경아, 이사 추형석)는 약국 경영 활성화를 위해 텍스리펀 업체인 KTP(대표 주병천)와 업무협약을 했다.KTP는 지난 2018년 설립해 중부지방 국세청 1호 환급창구 운영사다. 구약사회는 외국인 관광객이 약국에서 물품 구입 시 간단한 확인 후 부가세를 환급 받을 수 있는 제도(텍스리펀)를 도입하기로 했다.송파구는 월드타워, 롯데월드, 올림픽공원 공연장 등 외국인 방문이 증가하는 곳이다. 구약사회는 이번 협력을 통해 비용부담 없이 휴대폰 앱으로 실시간 부가세 할인을 적용하는 약국 서비스 향상 프로그램을 회원 안내할 방침이다.2025-08-29 18:09:45정흥준
송파구약, 약국 관광객 편의 위해 환급업체 'KTP'와 협약[데일리팜=정흥준 기자] 송파구약사회(회장 최명수) 총무위원회(부회장 박경아, 이사 추형석)는 약국 경영 활성화를 위해 텍스리펀 업체인 KTP(대표 주병천)와 업무협약을 했다.KTP는 지난 2018년 설립해 중부지방 국세청 1호 환급창구 운영사다. 구약사회는 외국인 관광객이 약국에서 물품 구입 시 간단한 확인 후 부가세를 환급 받을 수 있는 제도(텍스리펀)를 도입하기로 했다.송파구는 월드타워, 롯데월드, 올림픽공원 공연장 등 외국인 방문이 증가하는 곳이다. 구약사회는 이번 협력을 통해 비용부담 없이 휴대폰 앱으로 실시간 부가세 할인을 적용하는 약국 서비스 향상 프로그램을 회원 안내할 방침이다.2025-08-29 18:09:45정흥준 -
 "산업약사 꿈꾼다면 소통·네트워킹이 자산"[데일리팜=정흥준 기자] 약학대학 졸업 후 산업약사를 진로로 꿈꾸고 있는 후배들에게 제약사 전·현직 실무자들이 기본기와 전문성, 소통과 네트워킹을 강조했다.산업에 대한 이해도로 기본기를 다지고, 전문성을 활용해 다양한 사람들과 소통하며 인적 네트워킹을 만들 필요가 있다는 조언이다.이연정 한국다케다제약 의학부 총괄.24일 오후 수도권 약대생 제약마케팅전략학회(이하 PPL)가 주최한 제약설명회에서 한국다케다제약, 한국다이이찌산쿄, 네오심플릭스 등 산업계 선배들이 새로운 진로를 꿈꾸는 약대생들에게 당부의 말을 전했다.이연정 한국다케다제약 의학부 총괄은 약사로서의 전문성을 활용한 학술적 커뮤니케이션 능력을 강조했다. 또 의학부에 관심이 있다면 문제 해결 능력을 보여줄 만한 구체적인 포트폴리오 준비를 추천했다.이 총괄도 분당차병원 가정의학과 조교수로 있다가 한국엘러간, 바이엘코리아, 한국노바티스, 한국세르비에 의학부 등을 거쳐 현재는 한국다케다제약 의학부를 이끌고 있다.이연정 총괄은 “KSPM(한국제약의학회)에서 의학부 관련 조사를 한 적이 있다. 당시 의학부에 전문면허를 보유한 인력은 72%였다. 면허 중에는 약사가 50%, 전문의 40%로 많은 비중을 차지했다. 전문성을 가진 약사는 환영을 받는다”고 설명했다.회사가 의학부에 기대하는 역할로는 ‘고객과의 학술 커뮤니케이션’이었다. 가장 중요 역량도 학술적 전문성을 가지고, 사람들의 눈높이에 맞는 커뮤니케이션을 하는 능력이다.또 의학부는 배우고 성장하려는 전문가들이 모이는 곳이고, 그 역할도 확대되고 있기 때문에 도전성과 내재적 보상을 중요 가치로 두고 있는지가 중요하다고 했다.이 총괄은 “의학부 직무만족, 이직의도에 영향을 미치는 요인을 조사한 결과에서 ‘내재적 보상’이 공통적으로 나타났다”면서 “약사는 약과 임상에 대해 잘 알고, 환자에게 투여됐을 때 벌어지는 일을 충분히 이해하고 문제 해결을 할 수 있다는 점에서 강점이 있다”고 강조했다.이어 “의학부에서 만났던 약사들은 성장하고 싶어 하는 분들이 많았다. 시작은 분명히 타전공자와 다르고, 이를 어떻게 활용해나갈 것이냐를 준비한다면 분명한 차별점이 있다”고 덧붙였다."인적 네크워킹으로 창업아이템 얻어...마케팅 절반은 책상 밖에서"정준호 네오심플릭스 대표.약사 출신 창업자로 관심을 받고 있는 정준호 네오심플릭스 대표는 인적네트워킹을 위한 기회를 많이 만들어보라고 조언했다.정준호 대표는 글로벌 경영컨설팅 회사인 베인앤컴퍼니에서 일을 하다가, 지금은 약국 화장품업체인 네오심플릭스와 병의원 마케팅 업체인 네오커스를 운영하고 있다.정 대표는 “경영컨설팅 업계는 회사들이 해결하지 못한 문제의 해결책을 제시하는 업무이기 때문에 업무 강도와 요구되는 역량이 높았다”면서 “하지만 논리적인 사고와 문제해결 능력, 산업을 이해하는 능력과 산업과 사람을 만나는 기회를 얻었다”고 설명했다.이어 “컨설텅 회사에서 얻은 분석력과 전략수립 능력을 가지고 직접 운영을 하고 싶어 창업을 하게 됐다”고 했다.그 과정에서 얻게 된 인적네트워킹의 중요성을 강조했다. 정 대표는 “이 자리까지 오게 되기까지 혼자 힘으로는 어려웠을 것이다. 컨설팅 회사를 비롯 그동안 쌓아놨던 인적네트워킹이 많은 도움이 됐다. 창업아이템도 네트워킹에서 얻었다”고 말했다.정 대표는 “대학생으로 만약 돌아간다면 인턴십, 케이스스터디와 경진대회 참가, 창업멘토링과 동아리를 할 거 같다. 거기서 생기는 네트워킹이 정말 중요하다”고 조언했다.김대중 한국다이찌샨쿄 전 대표.SNU제약바이오인력양성센터 자문위원을 맡고 있는 김대중 다이찌샨쿄 전 대표는 기본에 충실하라고 당부했다.김 전 대표는 “신약이란 단순한 제약사의 상품이 아니라는 점을 이해해야 한다. 제약사는 연구와 생산뿐만 아니라 MKT, MA, MIS, PV까지 모두 중요하다”고 했다.이어 “환자를 중심으로 모든 사이클에서 함께 하는 것이라는 인식을 가져야 한다. 정보를 만들어 현장에 제공하고 환자에게 사용해본 정보를 다시 수집해서 내부에 전달하고, 다시 분석과 평가를 거쳐 정보 제공 단계로 순환하는 단계를 거친다. 물건이 움직이지만 사실 정보가 움직이는 것”이라고 설명했다.달라진 환경에도 적응하고 성장해야 한다고 덧붙였다. 김 전 대표는 “디지털화가 됐기 때문에 지금까지의 정보 제공 방법과는 달라져야 한다. 또 환자도 스마트해져서 자신의 의견을 내는 정도까지 왔다. 이런 상황에서 의약품 마케팅은 어떻게 변화해야 할지 질문해야 한다”고 말했다.마케터를 꿈꾼다면 책상에서의 업무도 중요하지만, 다양한 사람들을 만나 소통하고 설득하는 능력을 키워야 한다고 강조했다.김 전 대표는 “마케팅은 책상에서 하는 멋지고 폼나는 직업이라고 생각할 수 있는데, 50%는 사람들을 만나 설득해야 하는 일이다. 화려함 보다는 기본기에 충실하려는 자세를 갖춰야 한다”고 조언했다.2025-08-24 18:36:09정흥준
"산업약사 꿈꾼다면 소통·네트워킹이 자산"[데일리팜=정흥준 기자] 약학대학 졸업 후 산업약사를 진로로 꿈꾸고 있는 후배들에게 제약사 전·현직 실무자들이 기본기와 전문성, 소통과 네트워킹을 강조했다.산업에 대한 이해도로 기본기를 다지고, 전문성을 활용해 다양한 사람들과 소통하며 인적 네트워킹을 만들 필요가 있다는 조언이다.이연정 한국다케다제약 의학부 총괄.24일 오후 수도권 약대생 제약마케팅전략학회(이하 PPL)가 주최한 제약설명회에서 한국다케다제약, 한국다이이찌산쿄, 네오심플릭스 등 산업계 선배들이 새로운 진로를 꿈꾸는 약대생들에게 당부의 말을 전했다.이연정 한국다케다제약 의학부 총괄은 약사로서의 전문성을 활용한 학술적 커뮤니케이션 능력을 강조했다. 또 의학부에 관심이 있다면 문제 해결 능력을 보여줄 만한 구체적인 포트폴리오 준비를 추천했다.이 총괄도 분당차병원 가정의학과 조교수로 있다가 한국엘러간, 바이엘코리아, 한국노바티스, 한국세르비에 의학부 등을 거쳐 현재는 한국다케다제약 의학부를 이끌고 있다.이연정 총괄은 “KSPM(한국제약의학회)에서 의학부 관련 조사를 한 적이 있다. 당시 의학부에 전문면허를 보유한 인력은 72%였다. 면허 중에는 약사가 50%, 전문의 40%로 많은 비중을 차지했다. 전문성을 가진 약사는 환영을 받는다”고 설명했다.회사가 의학부에 기대하는 역할로는 ‘고객과의 학술 커뮤니케이션’이었다. 가장 중요 역량도 학술적 전문성을 가지고, 사람들의 눈높이에 맞는 커뮤니케이션을 하는 능력이다.또 의학부는 배우고 성장하려는 전문가들이 모이는 곳이고, 그 역할도 확대되고 있기 때문에 도전성과 내재적 보상을 중요 가치로 두고 있는지가 중요하다고 했다.이 총괄은 “의학부 직무만족, 이직의도에 영향을 미치는 요인을 조사한 결과에서 ‘내재적 보상’이 공통적으로 나타났다”면서 “약사는 약과 임상에 대해 잘 알고, 환자에게 투여됐을 때 벌어지는 일을 충분히 이해하고 문제 해결을 할 수 있다는 점에서 강점이 있다”고 강조했다.이어 “의학부에서 만났던 약사들은 성장하고 싶어 하는 분들이 많았다. 시작은 분명히 타전공자와 다르고, 이를 어떻게 활용해나갈 것이냐를 준비한다면 분명한 차별점이 있다”고 덧붙였다."인적 네크워킹으로 창업아이템 얻어...마케팅 절반은 책상 밖에서"정준호 네오심플릭스 대표.약사 출신 창업자로 관심을 받고 있는 정준호 네오심플릭스 대표는 인적네트워킹을 위한 기회를 많이 만들어보라고 조언했다.정준호 대표는 글로벌 경영컨설팅 회사인 베인앤컴퍼니에서 일을 하다가, 지금은 약국 화장품업체인 네오심플릭스와 병의원 마케팅 업체인 네오커스를 운영하고 있다.정 대표는 “경영컨설팅 업계는 회사들이 해결하지 못한 문제의 해결책을 제시하는 업무이기 때문에 업무 강도와 요구되는 역량이 높았다”면서 “하지만 논리적인 사고와 문제해결 능력, 산업을 이해하는 능력과 산업과 사람을 만나는 기회를 얻었다”고 설명했다.이어 “컨설텅 회사에서 얻은 분석력과 전략수립 능력을 가지고 직접 운영을 하고 싶어 창업을 하게 됐다”고 했다.그 과정에서 얻게 된 인적네트워킹의 중요성을 강조했다. 정 대표는 “이 자리까지 오게 되기까지 혼자 힘으로는 어려웠을 것이다. 컨설팅 회사를 비롯 그동안 쌓아놨던 인적네트워킹이 많은 도움이 됐다. 창업아이템도 네트워킹에서 얻었다”고 말했다.정 대표는 “대학생으로 만약 돌아간다면 인턴십, 케이스스터디와 경진대회 참가, 창업멘토링과 동아리를 할 거 같다. 거기서 생기는 네트워킹이 정말 중요하다”고 조언했다.김대중 한국다이찌샨쿄 전 대표.SNU제약바이오인력양성센터 자문위원을 맡고 있는 김대중 다이찌샨쿄 전 대표는 기본에 충실하라고 당부했다.김 전 대표는 “신약이란 단순한 제약사의 상품이 아니라는 점을 이해해야 한다. 제약사는 연구와 생산뿐만 아니라 MKT, MA, MIS, PV까지 모두 중요하다”고 했다.이어 “환자를 중심으로 모든 사이클에서 함께 하는 것이라는 인식을 가져야 한다. 정보를 만들어 현장에 제공하고 환자에게 사용해본 정보를 다시 수집해서 내부에 전달하고, 다시 분석과 평가를 거쳐 정보 제공 단계로 순환하는 단계를 거친다. 물건이 움직이지만 사실 정보가 움직이는 것”이라고 설명했다.달라진 환경에도 적응하고 성장해야 한다고 덧붙였다. 김 전 대표는 “디지털화가 됐기 때문에 지금까지의 정보 제공 방법과는 달라져야 한다. 또 환자도 스마트해져서 자신의 의견을 내는 정도까지 왔다. 이런 상황에서 의약품 마케팅은 어떻게 변화해야 할지 질문해야 한다”고 말했다.마케터를 꿈꾼다면 책상에서의 업무도 중요하지만, 다양한 사람들을 만나 소통하고 설득하는 능력을 키워야 한다고 강조했다.김 전 대표는 “마케팅은 책상에서 하는 멋지고 폼나는 직업이라고 생각할 수 있는데, 50%는 사람들을 만나 설득해야 하는 일이다. 화려함 보다는 기본기에 충실하려는 자세를 갖춰야 한다”고 조언했다.2025-08-24 18:36:09정흥준
오늘의 TOP 10
- 1의료급여 지급 지연 현실화…월말 결제 앞둔 약국들 '한숨'
- 2여명808·컨디션환 등 25개 품목 숙취해소 효과 확인
- 35층약국, 6층약국 개설 저지 소송 나섰지만 결국 기각
- 4비보존, 비마약성 진통제 '어나프라주' 시장 확대 속도
- 5제약사들 "약가 개편시 영업익 반토막...생산중단 우려 1순위"
- 6혈액제제, 내수 감소에도 수출 50%↑...'알리글로 효과'
- 7AI 생성 의약사, 의약품·화장품 광고 규제법안 추진
- 8간호사 1인당 환자 수 제한, 국회서 공론화
- 9펄스장절제술 국내 도입 가속…글로벌 기업 각축 본격화
- 10병원약사회, 회원 약사들 마음 모아 사회봉사기금 전달 이어가
-
상품명최고최저평균
-
케토톱플라스타(34매)13,00013,00013,000
-
게보린(10정)4,0003,0003,620
-
노스카나겔(20g)22,00018,00020,703
-
베나치오에프액(75ml)1,0008001,000
-
비코그린에스(20정)5,0004,0004,417














![[유한양행] 콘택콜드 걸렸구나 생각되면](https://cdn.platpharm.co.kr/2025/10/2510282252420008436.webp)
![[SK케미칼] 속편한정 복합소화제](https://cdn.platpharm.co.kr/2025/12/2512040916400005920.webp)
![[신신] 아렉스 두번효과로 강력한](https://cdn.platpharm.co.kr/2025/10/2510230254510000664.webp)
![[종근당] 벤포벨에스 어른들의 피로회복제](https://cdn.platpharm.co.kr/2025/07/2507290841210004645.webp)
![[위고비] 직거래 최저가](https://cdn.platpharm.co.kr/2025/12/2512020211090000013.webp)
![[더본메디칼] ATC인쇄리본 특가](https://cdn.platpharm.co.kr/2025/04/2504100527360001454.jpg)
![[유한양행] 미녹펜겔 탈모스팟 집중케어](https://cdn.platpharm.co.kr/2025/09/2509220824180004563.webp)
![[셀로맥스] 베베락스 온가족 안심 관장약](https://cdn.platpharm.co.kr/2025/09/2509171131320018843.webp)
![[신신] 새사래 상처연고 습윤밴드](https://cdn.platpharm.co.kr/2025/10/2510210339570001784.webp)
![[리쥬올]레티노 멜라세럼 저자극 레티놀](https://cdn.platpharm.co.kr/2025/09/2509260219360000145.webp)
![[SK케미칼] 트라스트패취 피록시캄 성분](https://cdn.platpharm.co.kr/2025/10/2510020656150002375.webp)
![[리쥬올]리쥬올 PDRN 약국 1위 PDRN](https://cdn.platpharm.co.kr/2025/09/2509260220180000170.webp)
