총 937건
-
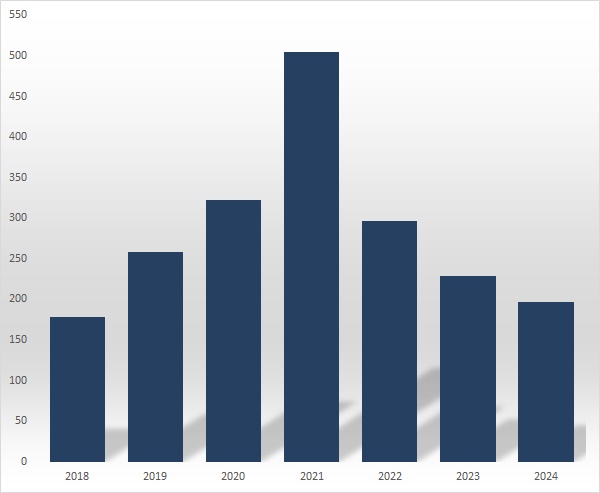
 '비주력사업 새 먹거리의 힘'...경보제약, 매출 신기록[데일리팜=천승현 기자] 종근당그룹의 원료의약품 계열사 경보제약이 역대 최대 매출 기록을 경신했다. 비주력 분야 완제의약품 영역에서 발굴한 진통제 신제품이 실적 상승세를 이끌었다.24일 금융감독원에 따르면 경보제약은 지난해 영업이익이 105억원으로 전년대비 88.5% 늘었고 매출액은 2386억원으로 10.3% 증가했다. 이 회사의 작년 영업이익은 2018년 173억원을 기록한 이후 6년 만에 최대 규모다. 경보제약은 지난 2021년 66억원의 영업손실을 기록한 후 3년 연속 영업이익이 상승세를 나타냈고 지난해 8년 만에 100억원을 넘어섰다.경보제약의 지난해 매출은 역대 최대 규모다. 지난 2023년 2164억원의 매출로 3년 만에 종전 기록을 갈아치웠고 지난해 2년 연속 신기록을 경신했다. 경보제약의 작년 매출은 2021년 1707억원과 비교하면 3년 새 39.8% 확대됐다.연도별 경보제약 매출(왼쪽)과 영업이익(오른쪽) 추이(단위: 백만원, 자료: 금융감독원) 회사 측은 “맥시제식 등 완제의약품 매출이 증가했다”라고 실적 호조의 배경을 설명했다.맥시제식은 이부프로펜과 아세트아미노펜 성분이 결합된 주사제다. 염증성 통증을 차단하는 비스테이로이드성 소염진통제(NSAIDs) 이부프로펜 300mg과 중추성 통증을 차단하는 아세트아미노펜 1000mg으로 구성됐다.맥시제식은 뉴질랜드의 AFT 파마슈티컬스(AFT Pharmaceuticals)가 정제로 개발해 미국, 유럽, 오세아니아, 아시아, 중동 등 다수의 국가에서 사용되고 있다. 수술 후 통증 관리와 비경구적 투여가 필요한 환자들을 위해 주사제로 제형을 확대했다.경보제약은 2018년 11월 AFT와 계약을 통해 맥시제식의 국내 독점 개발과 판매권을 확보했다. 국내에서는 2021년 8월 성인의 중등도에서 중증의 통증, 수술 후 통증 치료를 위해 신속하게 투여할 필요가 있거나 다른 경로로 투여할 수 없는 단기간 치료제로 허가 받았다.2022년 하반기 발매된 맥시제식은 출시 첫해 13억원의 매출을 올렸고 2023년 137억원으로 확대됐다. 지난해에는 3분기 누적 매출 154억원으로 전년대비 2배 증가하며 흥행 행진을 이어갔다.국내에서 아세트아미노펜과 이부프로펜 성분을 모두 함유한 의약품은 맥시제식이 처음이다. 새로운 조합의 주사제가 처방 현장에서 호평을 받으며 선호도가 높아지는 추세다. 맥시제식은 작용기전이 다른 두 가지 성분이 이중으로 작용해 단일 성분 주사제 대비 2배 이상 뛰어난 통증 완화 효과를 나타낸다.맥시제식이 시장에서 호평을 받으면서 이례적으로 국내 출시 직후 국내제약사들의 특허 도전에 직면했다.국내제약사 20여곳은 지난해 말 맥시제식의 용도특허에 대해 무효심판을 청구했다. 국내에 등재된 맥시제식주 특허는 1개다. 이 용도특허는 2031년 10월 만료된다. 특허 도전 업체들은 맥시제식의 특허 무효화에 성공하면 제네릭 진입 시기를 앞당길 수 있다.경보제약은 주력 사업 영역이 원료의약품이다. 지난 2023년 원료의약품 매출은 1393억원으로 전체 매출의 64.4%를 차지했다. 완제의약품 매출은 33.8%로 원료의약품의 절반 수준이다.회사 입장에선 비주력 분야에서 새 먹거리를 발굴하면서 실적 개선의 새로운 동력을 확보한 셈이다.지난해 3분기 누적 경보제약의 완제의약품 매출은 704억원으로 회사 매출의 39.3%를 차지했다. 9개월만에 완제의약품 비중이 5.5%포인트 올랐다. 지난 2021년 말 기준 경보제약의 완제의약품 매출 비중은 26.7%에 불과했는데 3년 만에 12.6%포인트 상승했다.2025-01-24 12:00:33천승현
'비주력사업 새 먹거리의 힘'...경보제약, 매출 신기록[데일리팜=천승현 기자] 종근당그룹의 원료의약품 계열사 경보제약이 역대 최대 매출 기록을 경신했다. 비주력 분야 완제의약품 영역에서 발굴한 진통제 신제품이 실적 상승세를 이끌었다.24일 금융감독원에 따르면 경보제약은 지난해 영업이익이 105억원으로 전년대비 88.5% 늘었고 매출액은 2386억원으로 10.3% 증가했다. 이 회사의 작년 영업이익은 2018년 173억원을 기록한 이후 6년 만에 최대 규모다. 경보제약은 지난 2021년 66억원의 영업손실을 기록한 후 3년 연속 영업이익이 상승세를 나타냈고 지난해 8년 만에 100억원을 넘어섰다.경보제약의 지난해 매출은 역대 최대 규모다. 지난 2023년 2164억원의 매출로 3년 만에 종전 기록을 갈아치웠고 지난해 2년 연속 신기록을 경신했다. 경보제약의 작년 매출은 2021년 1707억원과 비교하면 3년 새 39.8% 확대됐다.연도별 경보제약 매출(왼쪽)과 영업이익(오른쪽) 추이(단위: 백만원, 자료: 금융감독원) 회사 측은 “맥시제식 등 완제의약품 매출이 증가했다”라고 실적 호조의 배경을 설명했다.맥시제식은 이부프로펜과 아세트아미노펜 성분이 결합된 주사제다. 염증성 통증을 차단하는 비스테이로이드성 소염진통제(NSAIDs) 이부프로펜 300mg과 중추성 통증을 차단하는 아세트아미노펜 1000mg으로 구성됐다.맥시제식은 뉴질랜드의 AFT 파마슈티컬스(AFT Pharmaceuticals)가 정제로 개발해 미국, 유럽, 오세아니아, 아시아, 중동 등 다수의 국가에서 사용되고 있다. 수술 후 통증 관리와 비경구적 투여가 필요한 환자들을 위해 주사제로 제형을 확대했다.경보제약은 2018년 11월 AFT와 계약을 통해 맥시제식의 국내 독점 개발과 판매권을 확보했다. 국내에서는 2021년 8월 성인의 중등도에서 중증의 통증, 수술 후 통증 치료를 위해 신속하게 투여할 필요가 있거나 다른 경로로 투여할 수 없는 단기간 치료제로 허가 받았다.2022년 하반기 발매된 맥시제식은 출시 첫해 13억원의 매출을 올렸고 2023년 137억원으로 확대됐다. 지난해에는 3분기 누적 매출 154억원으로 전년대비 2배 증가하며 흥행 행진을 이어갔다.국내에서 아세트아미노펜과 이부프로펜 성분을 모두 함유한 의약품은 맥시제식이 처음이다. 새로운 조합의 주사제가 처방 현장에서 호평을 받으며 선호도가 높아지는 추세다. 맥시제식은 작용기전이 다른 두 가지 성분이 이중으로 작용해 단일 성분 주사제 대비 2배 이상 뛰어난 통증 완화 효과를 나타낸다.맥시제식이 시장에서 호평을 받으면서 이례적으로 국내 출시 직후 국내제약사들의 특허 도전에 직면했다.국내제약사 20여곳은 지난해 말 맥시제식의 용도특허에 대해 무효심판을 청구했다. 국내에 등재된 맥시제식주 특허는 1개다. 이 용도특허는 2031년 10월 만료된다. 특허 도전 업체들은 맥시제식의 특허 무효화에 성공하면 제네릭 진입 시기를 앞당길 수 있다.경보제약은 주력 사업 영역이 원료의약품이다. 지난 2023년 원료의약품 매출은 1393억원으로 전체 매출의 64.4%를 차지했다. 완제의약품 매출은 33.8%로 원료의약품의 절반 수준이다.회사 입장에선 비주력 분야에서 새 먹거리를 발굴하면서 실적 개선의 새로운 동력을 확보한 셈이다.지난해 3분기 누적 경보제약의 완제의약품 매출은 704억원으로 회사 매출의 39.3%를 차지했다. 9개월만에 완제의약품 비중이 5.5%포인트 올랐다. 지난 2021년 말 기준 경보제약의 완제의약품 매출 비중은 26.7%에 불과했는데 3년 만에 12.6%포인트 상승했다.2025-01-24 12:00:33천승현 -
 유한양행, 바이엘과 카네스텐·비판텐 공동 판매바이엘코리아 오영경 대표(왼쪽)와 유한양행 조욱제 대표 [데일리팜=천승현 기자] 유한양행은 최근 서울 동작구 본사에서 바이엘코리아와 일반의약품 2종의 국내 공급계약을 체결했다고 24일 밝혔다.이 계약을 통해 오는 2월부터 양 사는 비판텐연고와 카네스텐 제품의 코프로모션을 진행한다.비판텐연고는 최초의 덱스판테놀 성분의 비스테로이드성 피부염 치료제다. 민감한 피부를 진정시키고 손상된 피부 장벽을 회복시킬 수 있어 영유아의 기저귀 발진, 급∙만성 피부염, 상처, 습진 등 다양한 피부 질환 치료에 쓰인다.클로트리마졸 성분의 카네스텐은 피부 표면의 진균 감염, 칸디다성 질염 등에 사용되는 항진균성 치료제다. 크림, 질정, 파우더 등 다양한 제형으로 구성됐다. 카네스텐은 칸디다성 질염 및 외음염 치료제로 일상생활에서 여성 건강을 관리할 수 있는 대표 제품으로 평가받는다.조욱제 유한양행 대표는 “비판텐연고와 카네스텐은 세계적으로 우수한 품질을 입증한 제품들로 전 세계인들의 질환치료에 크게 기여한 제품들이다” 며 “이번 협약으로 두 회사가 가진 강점이 시너지를 일으켜 국내 소비자들이 세계적으로 우수한 품질의 제품들을 더욱 손쉽게 접할 수 있게 되길 바란다”고 말했다.오영경 바이엘코리아 컨슈머헬스 사업부 대표는 “우수한 영업 역량과 탄탄한 유통망을 보유한 유한양행과 협력하게 되어 기쁘게 생각한다”며 “일상 생활에서 흔히 겪는 다양한 피부질환과 여성 관련 질환을 보다 간편하고 효과적으로 관리할 수 있는 제품에 대한 접근성을 높여, 국내 소비자들의 더 건강한 일상에 기여할 수 있을 것으로 기대한다”고 전했다.2025-01-24 08:26:56천승현
유한양행, 바이엘과 카네스텐·비판텐 공동 판매바이엘코리아 오영경 대표(왼쪽)와 유한양행 조욱제 대표 [데일리팜=천승현 기자] 유한양행은 최근 서울 동작구 본사에서 바이엘코리아와 일반의약품 2종의 국내 공급계약을 체결했다고 24일 밝혔다.이 계약을 통해 오는 2월부터 양 사는 비판텐연고와 카네스텐 제품의 코프로모션을 진행한다.비판텐연고는 최초의 덱스판테놀 성분의 비스테로이드성 피부염 치료제다. 민감한 피부를 진정시키고 손상된 피부 장벽을 회복시킬 수 있어 영유아의 기저귀 발진, 급∙만성 피부염, 상처, 습진 등 다양한 피부 질환 치료에 쓰인다.클로트리마졸 성분의 카네스텐은 피부 표면의 진균 감염, 칸디다성 질염 등에 사용되는 항진균성 치료제다. 크림, 질정, 파우더 등 다양한 제형으로 구성됐다. 카네스텐은 칸디다성 질염 및 외음염 치료제로 일상생활에서 여성 건강을 관리할 수 있는 대표 제품으로 평가받는다.조욱제 유한양행 대표는 “비판텐연고와 카네스텐은 세계적으로 우수한 품질을 입증한 제품들로 전 세계인들의 질환치료에 크게 기여한 제품들이다” 며 “이번 협약으로 두 회사가 가진 강점이 시너지를 일으켜 국내 소비자들이 세계적으로 우수한 품질의 제품들을 더욱 손쉽게 접할 수 있게 되길 바란다”고 말했다.오영경 바이엘코리아 컨슈머헬스 사업부 대표는 “우수한 영업 역량과 탄탄한 유통망을 보유한 유한양행과 협력하게 되어 기쁘게 생각한다”며 “일상 생활에서 흔히 겪는 다양한 피부질환과 여성 관련 질환을 보다 간편하고 효과적으로 관리할 수 있는 제품에 대한 접근성을 높여, 국내 소비자들의 더 건강한 일상에 기여할 수 있을 것으로 기대한다”고 전했다.2025-01-24 08:26:56천승현 -
 씁쓸한 패소·혹독한 후유증...휴텍스, 처방액 1500억 증발[데일리팜=천승현 기자] 한국휴텍스제약이 제조·품질관리기준(GMP) 적합 판정 취소 처분 행정소송에서 고배를 들었다. 정부의 GMP 취소 처분이 부당하다는 주장을 펼쳤지만 재판부는 받아들이지 않았다. 휴텍스제약은 GMP 처분 통보 이후 1년 동안 처방실적이 1500억원 이상 감소하며 혹독한 처분 후유증을 겪고 있다.24일 업계에 따르면 수원지방법원 제3행정부는 지난 23일 휴텍스제약이 경인지방식품의약품안전청장을 상대로 제기한 의약품 제조 및 품질관리기준 적합판정(내용고형제) 취소처분 취소소송에서 기각 판결을 내렸다. 지난해 1월 소송이 청구된지 1년 만에 휴텍스제약의 패소 판결이 나왔다.GMP 적합판정 취소 처분을 둘러싼 첫 판결이다. 2022년 12월부터 GMP 적합판정을 거짓·부정하게 받거나 반복적으로 의약품 제조·품질관리에 관한 기록을 거짓으로 작성해 판매한 사실이 적발된 경우 GMP 적합판정을 취소하는 일명 'GMP 원스트라이크 아웃'이 도입됐다.식품의약품안전처는 2023년 7월 휴텍스제약이 6개 제품을 제조하는 과정에서 첨가제를 임의로 증량하거나 감량해 허가 사항과 다르게 제조하고, 제조기록서에는 허가사항과 동일하게 제조하는 것처럼 거짓 작성하는 등의 위반 사실을 확인하고 제조·판매중지를 명령했다.식약처는 2023년 12월 휴텍스제약에 해당 처분을 사전통지했고 청문회를 거쳐 최종적으로 처분 방침을 결정했다. 휴텍스제약 처분은 효력이 정지된 상태지만 처분 결정 이후 손실 규모가 커지고 있다. 의약품 조사기관 유비스트에 따르면 지난해 휴텍스제약의 외래 처방금액은 1399억원으로 전년대비 52.3% 감소했다. 1년 동안 처방실적이 1531억원 증발한 셈이다.휴텍스제약은 지난 2019년 처방액 1976억원에서 2022년 2968억원으로 3년간 50.1% 증가하며 실적 고공행진을 지속했다. 하지만 GMP 규정 위반 사실이 공개되자 2023년 처방액이 전년비 1.2% 감소했고 지난해에는 절반 이상 축소됐다.휴텍스제약의 GMP 적합판정 취소 처분이 한 달 가량 효력이 발생하면서 처방실적 이탈이 본격화한 것으로 분석된다.당초 식약처는 휴텍스제약의 GMP 적합판정 취소 처분을 지난 2월부터 시행하기로 공고했다. 휴텍스제약은 행정처분 시행 중단을 위한 집행정지를 청구했는데 재판부의 판결이 지연되면서 작년 2월 1일 처분 효력이 발생했다. 지난해 2월 7일 수원지방법원은 휴텍스제약의 집행정지 청구를 기각하면서 GMP 적합판정 취소 처분의 효력이 유지됐다. 휴텍스제약은 항고했고 지난 3월 4일 2심 재판부의 인용 판결로 해당 처분의 시행이 보류됐다. 대법원이 집행정지 상고심에서 심리불속행 기각 판결을 내리면서 본안소송 선고일부터 30일까지 처분이 시행되지 않는다.휴텍스제약은 처분 시행 기간 동안 직접 생산 뿐만 아니라 다른 업체에 위탁하는 방식의 의약품 제조도 금지됐다. 의약품 제조업자는 1개 이상의 제형군에 대한 GMP 적합판정서가 있는 경우 위탁제조를 할 수 있다. 휴텍스제약은 처분이 결정됐을 때 GMP 적합판정을 받은 제형군은 내용고형제 1개 뿐이다. 당시 보유 중인 제조시설 1개의 GMP 적합판정이 취소되면서 위탁제조의 자격도 상실됐다.휴텍스제약은 GMP 위반 사실이 공개된 2023년 하반기부터 처방실적 하락세가 본격화했다.휴텍스제약은 2023년 1분기와 2분기 처방실적이 전년동기대비 각각 8.5%, 12.2% 증가했다. 하지만 2023년 3분기 처방금액은 710억원으로 전년동기보다 4.3% 줄었고 4분기에는 전년대비 19.3% 감소했다.행정처분이 확정된 지난해 실적 이탈은 더욱 확대됐다. 작년 1분기 휴텍스제약의 외래 처방실적은 457억원으로 전년대비 40.6% 줄었고 2분기에는 305억원으로 전년보다 62.4%로 감소 폭이 더욱 커졌다. 작년 3분기와 4분기에는 처방금액이 전년대비 각각 56.9%, 48.2% 감소했다. 휴텍스제약의 주요 의약품 모두 큰 폭으로 처방실적이 내려앉았다.휴텍스아토르바스타틴은 지난해 처방액이 57억원으로 전년대비 57.6% 줄었다. 휴텍스아토르바스타틴은 고지혈증치료제 리피토의 제네릭 제품이다. 휴텍스아토르바스타틴은 2023년 처방액 143억원을 기록했는데 2년 만에 60.0% 쪼그라들면서 처방액 86억원이 사라졌다.휴텍스제약의 휴로픽스는 작년 처방액이 55억원으로 전년보다 31.8% 감소했다. 휴로픽스는 항혈전제 플라빅스의 제네릭 제품이다. 휴로픽스는 지난 2022년 처방액 77억원에서 2023년 80억원으로 4.0% 증가했지만 처분 통보 이후 급감했다.고지혈증복합제 크레스티브는 지난 2019년 처방액 55억원에서 2022년 158억원으로 급증했지만 2023년 110억원, 지난해 54억원으로 내려앉았다. 작년 처방액은 2년 전보다 3분의 1 수준에 불과했다.로수바스타틴 성분의 고지혈증치료제 크레스바는 2023년 81억원에서 1년 만에 42억원으로 47.7% 축소됐다. 휴텍스파모티딘은 작년 처방액이 31억원으로 전년대비 절반 수준으로 떨어졌다.콜린알포세레이트 성분의 뇌기능개선제 실버레린은 2019년 처방액이 79억원에서 2022년 113억원으로 3년 만에 58.5% 증가했다. 하지만 지난해에는 23억원으로 전년대비 75.5% 축소됐다. 실버세린의 작년 처방금액은 2년 전과 비교하면 80.0% 감소했다.휴텍스제약의 천식치료제 싱귤다운과 항궤양제 넥시메졸은 지난해 처방액이 전년대비 50% 이상 줄었다.휴텍스제약은 위탁방식으로 허가받은 제네릭을 영업대행업체(CSO)를 활용해 판매하는 전략으로 초고속 성장을 지속했다. 휴텍스제약의 GMP 취소 처분 방침이 대대적으로 알려지면서 CSO를 적극 활용하는 업체들이 휴텍스제약의 생산 중단 의약품 시장을 잠식하기 위한 움직임이 활발한 것으로 전해졌다.상대적으로 규모가 큰 대형제약사들이 휴텍스제약의 처방 시장을 적극적으로 잠식했다는 진단도 나온다. 제약사 한 관계자는 “휴텍스제약의 처분 사실이 알려진 이후 대형제약사들이 브랜드 신뢰도와 공급 안정성 등을 내세워 처방 시장을 적극 공략했다”라고 전했다.2025-01-24 06:20:01천승현
씁쓸한 패소·혹독한 후유증...휴텍스, 처방액 1500억 증발[데일리팜=천승현 기자] 한국휴텍스제약이 제조·품질관리기준(GMP) 적합 판정 취소 처분 행정소송에서 고배를 들었다. 정부의 GMP 취소 처분이 부당하다는 주장을 펼쳤지만 재판부는 받아들이지 않았다. 휴텍스제약은 GMP 처분 통보 이후 1년 동안 처방실적이 1500억원 이상 감소하며 혹독한 처분 후유증을 겪고 있다.24일 업계에 따르면 수원지방법원 제3행정부는 지난 23일 휴텍스제약이 경인지방식품의약품안전청장을 상대로 제기한 의약품 제조 및 품질관리기준 적합판정(내용고형제) 취소처분 취소소송에서 기각 판결을 내렸다. 지난해 1월 소송이 청구된지 1년 만에 휴텍스제약의 패소 판결이 나왔다.GMP 적합판정 취소 처분을 둘러싼 첫 판결이다. 2022년 12월부터 GMP 적합판정을 거짓·부정하게 받거나 반복적으로 의약품 제조·품질관리에 관한 기록을 거짓으로 작성해 판매한 사실이 적발된 경우 GMP 적합판정을 취소하는 일명 'GMP 원스트라이크 아웃'이 도입됐다.식품의약품안전처는 2023년 7월 휴텍스제약이 6개 제품을 제조하는 과정에서 첨가제를 임의로 증량하거나 감량해 허가 사항과 다르게 제조하고, 제조기록서에는 허가사항과 동일하게 제조하는 것처럼 거짓 작성하는 등의 위반 사실을 확인하고 제조·판매중지를 명령했다.식약처는 2023년 12월 휴텍스제약에 해당 처분을 사전통지했고 청문회를 거쳐 최종적으로 처분 방침을 결정했다. 휴텍스제약 처분은 효력이 정지된 상태지만 처분 결정 이후 손실 규모가 커지고 있다. 의약품 조사기관 유비스트에 따르면 지난해 휴텍스제약의 외래 처방금액은 1399억원으로 전년대비 52.3% 감소했다. 1년 동안 처방실적이 1531억원 증발한 셈이다.휴텍스제약은 지난 2019년 처방액 1976억원에서 2022년 2968억원으로 3년간 50.1% 증가하며 실적 고공행진을 지속했다. 하지만 GMP 규정 위반 사실이 공개되자 2023년 처방액이 전년비 1.2% 감소했고 지난해에는 절반 이상 축소됐다.휴텍스제약의 GMP 적합판정 취소 처분이 한 달 가량 효력이 발생하면서 처방실적 이탈이 본격화한 것으로 분석된다.당초 식약처는 휴텍스제약의 GMP 적합판정 취소 처분을 지난 2월부터 시행하기로 공고했다. 휴텍스제약은 행정처분 시행 중단을 위한 집행정지를 청구했는데 재판부의 판결이 지연되면서 작년 2월 1일 처분 효력이 발생했다. 지난해 2월 7일 수원지방법원은 휴텍스제약의 집행정지 청구를 기각하면서 GMP 적합판정 취소 처분의 효력이 유지됐다. 휴텍스제약은 항고했고 지난 3월 4일 2심 재판부의 인용 판결로 해당 처분의 시행이 보류됐다. 대법원이 집행정지 상고심에서 심리불속행 기각 판결을 내리면서 본안소송 선고일부터 30일까지 처분이 시행되지 않는다.휴텍스제약은 처분 시행 기간 동안 직접 생산 뿐만 아니라 다른 업체에 위탁하는 방식의 의약품 제조도 금지됐다. 의약품 제조업자는 1개 이상의 제형군에 대한 GMP 적합판정서가 있는 경우 위탁제조를 할 수 있다. 휴텍스제약은 처분이 결정됐을 때 GMP 적합판정을 받은 제형군은 내용고형제 1개 뿐이다. 당시 보유 중인 제조시설 1개의 GMP 적합판정이 취소되면서 위탁제조의 자격도 상실됐다.휴텍스제약은 GMP 위반 사실이 공개된 2023년 하반기부터 처방실적 하락세가 본격화했다.휴텍스제약은 2023년 1분기와 2분기 처방실적이 전년동기대비 각각 8.5%, 12.2% 증가했다. 하지만 2023년 3분기 처방금액은 710억원으로 전년동기보다 4.3% 줄었고 4분기에는 전년대비 19.3% 감소했다.행정처분이 확정된 지난해 실적 이탈은 더욱 확대됐다. 작년 1분기 휴텍스제약의 외래 처방실적은 457억원으로 전년대비 40.6% 줄었고 2분기에는 305억원으로 전년보다 62.4%로 감소 폭이 더욱 커졌다. 작년 3분기와 4분기에는 처방금액이 전년대비 각각 56.9%, 48.2% 감소했다. 휴텍스제약의 주요 의약품 모두 큰 폭으로 처방실적이 내려앉았다.휴텍스아토르바스타틴은 지난해 처방액이 57억원으로 전년대비 57.6% 줄었다. 휴텍스아토르바스타틴은 고지혈증치료제 리피토의 제네릭 제품이다. 휴텍스아토르바스타틴은 2023년 처방액 143억원을 기록했는데 2년 만에 60.0% 쪼그라들면서 처방액 86억원이 사라졌다.휴텍스제약의 휴로픽스는 작년 처방액이 55억원으로 전년보다 31.8% 감소했다. 휴로픽스는 항혈전제 플라빅스의 제네릭 제품이다. 휴로픽스는 지난 2022년 처방액 77억원에서 2023년 80억원으로 4.0% 증가했지만 처분 통보 이후 급감했다.고지혈증복합제 크레스티브는 지난 2019년 처방액 55억원에서 2022년 158억원으로 급증했지만 2023년 110억원, 지난해 54억원으로 내려앉았다. 작년 처방액은 2년 전보다 3분의 1 수준에 불과했다.로수바스타틴 성분의 고지혈증치료제 크레스바는 2023년 81억원에서 1년 만에 42억원으로 47.7% 축소됐다. 휴텍스파모티딘은 작년 처방액이 31억원으로 전년대비 절반 수준으로 떨어졌다.콜린알포세레이트 성분의 뇌기능개선제 실버레린은 2019년 처방액이 79억원에서 2022년 113억원으로 3년 만에 58.5% 증가했다. 하지만 지난해에는 23억원으로 전년대비 75.5% 축소됐다. 실버세린의 작년 처방금액은 2년 전과 비교하면 80.0% 감소했다.휴텍스제약의 천식치료제 싱귤다운과 항궤양제 넥시메졸은 지난해 처방액이 전년대비 50% 이상 줄었다.휴텍스제약은 위탁방식으로 허가받은 제네릭을 영업대행업체(CSO)를 활용해 판매하는 전략으로 초고속 성장을 지속했다. 휴텍스제약의 GMP 취소 처분 방침이 대대적으로 알려지면서 CSO를 적극 활용하는 업체들이 휴텍스제약의 생산 중단 의약품 시장을 잠식하기 위한 움직임이 활발한 것으로 전해졌다.상대적으로 규모가 큰 대형제약사들이 휴텍스제약의 처방 시장을 적극적으로 잠식했다는 진단도 나온다. 제약사 한 관계자는 “휴텍스제약의 처분 사실이 알려진 이후 대형제약사들이 브랜드 신뢰도와 공급 안정성 등을 내세워 처방 시장을 적극 공략했다”라고 전했다.2025-01-24 06:20:01천승현 -
 '스타틴·에제' 처방액 100억 이상 27개...확고한 캐시카우[데일리팜=천승현 기자] 국내 제약업계에서 스타틴과 에제티미브를 결합한 복합제가 견고한 캐시카우로 자리매김했다. 지난해 총 27개 제품이 처방액 100억원을 넘어섰다. 로수바스타틴·에제티미브 복합제 시장에서만 18개 업체가 100억원 이상을 올렸다.아토르바스타틴·에제티미브와 피타바스타틴·에네티미브 복합제 시장에서도 대형 제품들이 속속 등장했다. 한미약품의 로수젯은 2000억원을 넘어섰고 오가논과 유한양행은 스타틴·에제티미브 복합제 시장에서 1000억원 이상을 확보했다.22일 의약품 조사기관 유비스트에 따르면 지난해 스타틴·에제티미브 복합제의 외래 처방시장은 총 1조2116억원으로 집계됐다. 스타틴·에제티미브 복합제 처방 시장은 2022년 7976억원에서 2년새 51.9% 확대되며 흥행행진을 이어가고 있다.현재 스타틴·에제티미브 복합제는 심바스타틴, 로수바스타틴, 아토르바스타틴, 피타바스타틴 등 4종의 스타틴과 에제티미브를 결합한 4개 종류의 복합제가 등장한 상태다. 지난해 로수바스타틴·에제티미브 복합제 처방 시장이 7238억원으로 가장 많았고 로수바스타틴·에제티미브 복합제와 피타바스타틴·에제티미브 복합제가 각각 3270억원, 1290억원으로 뒤를 이었다. 스타틴·에제티미브 복합제는 시장 규모가 급팽창하면서 제약사들의 새로운 캐시카우로 급부상했다.지난해 스타틴·에제티미브 복합제 중 처방금액이 100억원을 넘어선 제품은 총 27개로 집계됐다. 2023년 23개에서 1년 만에 4개 제품이 추가됐다. 지난 2019년 처방액 100억원 이상 올린 스타틴·에제티미브 복합제는 7개에 불과했지만 5년 만에 20개 제품이 합류했다.로수바스타틴·에제티미브 복합제 중 작년 처방액이 100억원을 넘은 제품은 18개 품목에 달했다. 2023년 16개에서 1년 만에 2개 품목이 가세했다.한미약품의 로수젯이 작년 처방액이 전년보다 17.6% 증가한 2103억원을 기록하며 독주를 이어갔다. 로수젯은 지난 2019년 처방액 787억원에서 지난 5년 간 167.2% 확대됐다. 로수젯은 지난 2020년부터 4년 연속 처방액 1000억원 이상을 기록했고 지난해 2000억원을 돌파했다.유한양행의 로수바미브는 작년 처방액이 891억원으로 전년보다 14.6% 증가하며 로수바스타틴·에제티미브 복합제 시장에서 2위에 이름을 올렸다. 로수바미브는 2019년 처방액 448억원에서 매년 신기록 행진을 기록하며 5년 새 2배 가량 확대됐다.HK이노엔의 로바젯은 작년 처방금액이 전년보다 23.0% 증가한 474억원을 기록했다. 로바젯은 2019년 211억원에서 5년 동안 124.5% 증가했다. 대웅제약의 크레젯은 2023년 354억원에서 지난해 404억원으로 14.1% 늘었다. 2019년 137억원과 비교하면 5년 동안 3배 가량 확대됐다.녹십자의 다비듀오는 2019년 처방액 79억원에서 5년 만에 302억원으로 4배 가량 치솟았다. 아주약품의 크레트롤, 휴온스의 에슈바, 제일약품의 로제듀오, 명문제약의 로젯 등이 최근 가파른 상승세로 작년 처방액이 200억원을 넘어섰다.애보트, 에이치엘비제약, 경동제약, 동국제약, 마더스제약, 안국약품, 하나제약, 국제약품, 메디카코리아 등이 지난해 로수바스타틴·에제티미브 복합제 시장에서 100억원대 처방실적을 올렸다. 아토르바스타틴·에제티미브 복합제 시장에서는 지난해 총 5개 제품이 100억원 이상의 처방액을 기록했다. 2023년 4개에서 1개 제품이 추가됐다.오가논의 아토젯이 작년 처방액 1187억원으로 선두를 질주했다. 아토젯은 아토르바스타틴·에제티미브 복합제의 오리지널 제품이다. 아토젯은 지난 2019년 636억원에서 5년 새 86.7% 확대됐다. 지난 2021년부터 국내제약사 100여곳이 앞다퉈 아토르바스타틴·에제티미브 복합제 시장에 진출했는데도 아토젯은 높은 성장세를 이어갔다. 종근당이 아토젯의 판매를 담당한다.제일약품이 생산하는 리피토플러스가 지난해 384억원의 처방액으로 국내 생산 제품 중 처방액 선두에 올랐다. 리피토플러스는 2021년 발매 첫해 25억원의 처방액을 올렸고 2022년과 2023년에 각각 100억원, 200억원을 넘어섰다. 지난해에는 전년보다 45.6% 증가하며 300억원을 돌파했다. 제일약품은 비아트리스와 리피토플러스를 공동으로 판매 중이다.대웅제약의 리토바젯이 작년 처방액 201억원을 올렸다. 리토바젯은 2022년 처방실적 100억원을 넘어섰고 매년 성장세를 이어갔다. 유한양행과 보령이 아토르바스타틴·에제티미브 복합제 시장에서 100억원 이상의 처방액을 형성했다.피타바스타틴·에제티미브 복합제 시장에서는 총 3개 제품이 지난해 100억원 이상의 처방실적을 나타냈다.JW중외제약의 리바로젯은 지난해 처방금액이 933억원으로 전년보다 32.4% 증가했다. 리바로젯은 2021년 10월에 발매됐는데 2022년과 2023년 각각 318억원, 720억원으로 급증했고 지난해에는 1000억원에 육박했다.대원제약의 타바로젯이 작년 처방액 142억원을 올리며 두각을 나타냈고 안국약품의 페바로젯은 113억원을 기록했다.심바스타틴·에제티미브 복합제 시장에서는 오가논의 바이토린 1개 제품만이 지난해 100억원 이상의 처방실적을 나타냈다.업체별로 보면 스타틴·에제티니브 복합제 시장에서 한미약품이 지난해 로수젯 1개 품목으로 가장 많은 2103억원을 올렸다. 오가논과 유한양행이 각각 2개 제품으로 1000억원 이상을 기록했다.이상지질혈증치료제 복합제 시장분석2025-01-22 06:20:59천승현
'스타틴·에제' 처방액 100억 이상 27개...확고한 캐시카우[데일리팜=천승현 기자] 국내 제약업계에서 스타틴과 에제티미브를 결합한 복합제가 견고한 캐시카우로 자리매김했다. 지난해 총 27개 제품이 처방액 100억원을 넘어섰다. 로수바스타틴·에제티미브 복합제 시장에서만 18개 업체가 100억원 이상을 올렸다.아토르바스타틴·에제티미브와 피타바스타틴·에네티미브 복합제 시장에서도 대형 제품들이 속속 등장했다. 한미약품의 로수젯은 2000억원을 넘어섰고 오가논과 유한양행은 스타틴·에제티미브 복합제 시장에서 1000억원 이상을 확보했다.22일 의약품 조사기관 유비스트에 따르면 지난해 스타틴·에제티미브 복합제의 외래 처방시장은 총 1조2116억원으로 집계됐다. 스타틴·에제티미브 복합제 처방 시장은 2022년 7976억원에서 2년새 51.9% 확대되며 흥행행진을 이어가고 있다.현재 스타틴·에제티미브 복합제는 심바스타틴, 로수바스타틴, 아토르바스타틴, 피타바스타틴 등 4종의 스타틴과 에제티미브를 결합한 4개 종류의 복합제가 등장한 상태다. 지난해 로수바스타틴·에제티미브 복합제 처방 시장이 7238억원으로 가장 많았고 로수바스타틴·에제티미브 복합제와 피타바스타틴·에제티미브 복합제가 각각 3270억원, 1290억원으로 뒤를 이었다. 스타틴·에제티미브 복합제는 시장 규모가 급팽창하면서 제약사들의 새로운 캐시카우로 급부상했다.지난해 스타틴·에제티미브 복합제 중 처방금액이 100억원을 넘어선 제품은 총 27개로 집계됐다. 2023년 23개에서 1년 만에 4개 제품이 추가됐다. 지난 2019년 처방액 100억원 이상 올린 스타틴·에제티미브 복합제는 7개에 불과했지만 5년 만에 20개 제품이 합류했다.로수바스타틴·에제티미브 복합제 중 작년 처방액이 100억원을 넘은 제품은 18개 품목에 달했다. 2023년 16개에서 1년 만에 2개 품목이 가세했다.한미약품의 로수젯이 작년 처방액이 전년보다 17.6% 증가한 2103억원을 기록하며 독주를 이어갔다. 로수젯은 지난 2019년 처방액 787억원에서 지난 5년 간 167.2% 확대됐다. 로수젯은 지난 2020년부터 4년 연속 처방액 1000억원 이상을 기록했고 지난해 2000억원을 돌파했다.유한양행의 로수바미브는 작년 처방액이 891억원으로 전년보다 14.6% 증가하며 로수바스타틴·에제티미브 복합제 시장에서 2위에 이름을 올렸다. 로수바미브는 2019년 처방액 448억원에서 매년 신기록 행진을 기록하며 5년 새 2배 가량 확대됐다.HK이노엔의 로바젯은 작년 처방금액이 전년보다 23.0% 증가한 474억원을 기록했다. 로바젯은 2019년 211억원에서 5년 동안 124.5% 증가했다. 대웅제약의 크레젯은 2023년 354억원에서 지난해 404억원으로 14.1% 늘었다. 2019년 137억원과 비교하면 5년 동안 3배 가량 확대됐다.녹십자의 다비듀오는 2019년 처방액 79억원에서 5년 만에 302억원으로 4배 가량 치솟았다. 아주약품의 크레트롤, 휴온스의 에슈바, 제일약품의 로제듀오, 명문제약의 로젯 등이 최근 가파른 상승세로 작년 처방액이 200억원을 넘어섰다.애보트, 에이치엘비제약, 경동제약, 동국제약, 마더스제약, 안국약품, 하나제약, 국제약품, 메디카코리아 등이 지난해 로수바스타틴·에제티미브 복합제 시장에서 100억원대 처방실적을 올렸다. 아토르바스타틴·에제티미브 복합제 시장에서는 지난해 총 5개 제품이 100억원 이상의 처방액을 기록했다. 2023년 4개에서 1개 제품이 추가됐다.오가논의 아토젯이 작년 처방액 1187억원으로 선두를 질주했다. 아토젯은 아토르바스타틴·에제티미브 복합제의 오리지널 제품이다. 아토젯은 지난 2019년 636억원에서 5년 새 86.7% 확대됐다. 지난 2021년부터 국내제약사 100여곳이 앞다퉈 아토르바스타틴·에제티미브 복합제 시장에 진출했는데도 아토젯은 높은 성장세를 이어갔다. 종근당이 아토젯의 판매를 담당한다.제일약품이 생산하는 리피토플러스가 지난해 384억원의 처방액으로 국내 생산 제품 중 처방액 선두에 올랐다. 리피토플러스는 2021년 발매 첫해 25억원의 처방액을 올렸고 2022년과 2023년에 각각 100억원, 200억원을 넘어섰다. 지난해에는 전년보다 45.6% 증가하며 300억원을 돌파했다. 제일약품은 비아트리스와 리피토플러스를 공동으로 판매 중이다.대웅제약의 리토바젯이 작년 처방액 201억원을 올렸다. 리토바젯은 2022년 처방실적 100억원을 넘어섰고 매년 성장세를 이어갔다. 유한양행과 보령이 아토르바스타틴·에제티미브 복합제 시장에서 100억원 이상의 처방액을 형성했다.피타바스타틴·에제티미브 복합제 시장에서는 총 3개 제품이 지난해 100억원 이상의 처방실적을 나타냈다.JW중외제약의 리바로젯은 지난해 처방금액이 933억원으로 전년보다 32.4% 증가했다. 리바로젯은 2021년 10월에 발매됐는데 2022년과 2023년 각각 318억원, 720억원으로 급증했고 지난해에는 1000억원에 육박했다.대원제약의 타바로젯이 작년 처방액 142억원을 올리며 두각을 나타냈고 안국약품의 페바로젯은 113억원을 기록했다.심바스타틴·에제티미브 복합제 시장에서는 오가논의 바이토린 1개 제품만이 지난해 100억원 이상의 처방실적을 나타냈다.업체별로 보면 스타틴·에제티니브 복합제 시장에서 한미약품이 지난해 로수젯 1개 품목으로 가장 많은 2103억원을 올렸다. 오가논과 유한양행이 각각 2개 제품으로 1000억원 이상을 기록했다.이상지질혈증치료제 복합제 시장분석2025-01-22 06:20:59천승현 -
 HK이노엔, 로슈와 항암제 아바스틴 같이 판다HK이노엔 곽달원 대표(오른쪽)와 한국로슈 이자트 아젬 대표이사(왼쪽) [데일리팜=천승현 기자] HK이노엔은 한국로슈와 표적항암제 ‘아바스틴(성분명 베바시주맙)’의 공동 프로모션 협약식을 진행했다고 21일 밝혔다.아바스틴은 전이성 직결장암과 전이성 유방암, 비소세포폐암, 진행성 또는 전이성 신세포암, 교모세포종, 상피성 난소암, 난관암, 원발성 복막암, 자궁경부암 등에 사용되는 항암제다.HK이노엔은 대장암과 부인암 분야에서 아바스틴 마케팅과 영업을 담당한다. 한국로슈는 대장암과 부인암을 제외한 영역에서 아바스틴의 영업 마케팅을 진행하고 아바스틴의 임상적 가치 향상을 위한 연구와 임상시험을 수행한다.양 사 측은 “이번 파트너십은 국내 환자들의 미충족 의학적 수요를 해결하고 보다 많은 환자에게 ‘아바스틴’의 임상적 혜택을 제공하기 위해 체결됐다”라고 설명했다.곽달원 HK이노엔 대표는 "한국로슈와 인플루엔자치료제 조플루자와 타미플루 유통·공동 판매 계약에 이어 아바스틴 공동 프로모션의 소식을 전하게 돼 뜻깊게 생각한다”며 “고령화와 생활습관 변화로 대장암, 부인암 유병률이 빠르게 증가하고 있으며 아바스틴을 통해 암을 극복할 수 있도록 환자, 보호자와 함께 하겠다”고 전했다.이자트 아젬 한국로슈 대표이사는 “환자를 위한 혁신을 지속적으로 이어나가는 것이 한국로슈의 최우선 가치다”라며 “양사의 협약이 시너지 효과를 창출해 보다 많은 암 환자들의 삶에 기여할 수 있기를 기대한다”고 말했다.아바스틴은 지난 2004년 FDA 허가를 받은 뒤 약 20년 간 전세계 420만 명 이상의 암 환자에게 처방됐으며, 매년 34만 명의 환자에게 치료되고 있다. 국내에서는 2005년 전이성 직결장암에 대해 최초로 허가 받은 후 점차 영역을 넓혀 현재 비소세포폐암, 신세포암, 상피성 난소암, 자궁경부암, 교모세포종 등 총 7개 암종에서 적응증을 보유하고 있다. 티쎈트릭과의 병용요법을 포함하면 총 8개 암종의 치료에 활용된다.2025-01-21 09:02:44천승현
HK이노엔, 로슈와 항암제 아바스틴 같이 판다HK이노엔 곽달원 대표(오른쪽)와 한국로슈 이자트 아젬 대표이사(왼쪽) [데일리팜=천승현 기자] HK이노엔은 한국로슈와 표적항암제 ‘아바스틴(성분명 베바시주맙)’의 공동 프로모션 협약식을 진행했다고 21일 밝혔다.아바스틴은 전이성 직결장암과 전이성 유방암, 비소세포폐암, 진행성 또는 전이성 신세포암, 교모세포종, 상피성 난소암, 난관암, 원발성 복막암, 자궁경부암 등에 사용되는 항암제다.HK이노엔은 대장암과 부인암 분야에서 아바스틴 마케팅과 영업을 담당한다. 한국로슈는 대장암과 부인암을 제외한 영역에서 아바스틴의 영업 마케팅을 진행하고 아바스틴의 임상적 가치 향상을 위한 연구와 임상시험을 수행한다.양 사 측은 “이번 파트너십은 국내 환자들의 미충족 의학적 수요를 해결하고 보다 많은 환자에게 ‘아바스틴’의 임상적 혜택을 제공하기 위해 체결됐다”라고 설명했다.곽달원 HK이노엔 대표는 "한국로슈와 인플루엔자치료제 조플루자와 타미플루 유통·공동 판매 계약에 이어 아바스틴 공동 프로모션의 소식을 전하게 돼 뜻깊게 생각한다”며 “고령화와 생활습관 변화로 대장암, 부인암 유병률이 빠르게 증가하고 있으며 아바스틴을 통해 암을 극복할 수 있도록 환자, 보호자와 함께 하겠다”고 전했다.이자트 아젬 한국로슈 대표이사는 “환자를 위한 혁신을 지속적으로 이어나가는 것이 한국로슈의 최우선 가치다”라며 “양사의 협약이 시너지 효과를 창출해 보다 많은 암 환자들의 삶에 기여할 수 있기를 기대한다”고 말했다.아바스틴은 지난 2004년 FDA 허가를 받은 뒤 약 20년 간 전세계 420만 명 이상의 암 환자에게 처방됐으며, 매년 34만 명의 환자에게 치료되고 있다. 국내에서는 2005년 전이성 직결장암에 대해 최초로 허가 받은 후 점차 영역을 넓혀 현재 비소세포폐암, 신세포암, 상피성 난소암, 자궁경부암, 교모세포종 등 총 7개 암종에서 적응증을 보유하고 있다. 티쎈트릭과의 병용요법을 포함하면 총 8개 암종의 치료에 활용된다.2025-01-21 09:02:44천승현 -
 스타틴·에제 시장 1조 돌파...피타바 복합제 2년새 4배↑[데일리팜=천승현 기자] 이상지질혈증치료제 시장에서 ‘스타틴’과 ‘에제티미브’를 결합한 복합제가 고공행진을 이어갔다. 스타틴·에제티미브 복합제는 지난 5년 간 처방액이 3배 이상 증가하며 시장 규모가 1조원을 돌파했다. 로수바스타틴·에제티미브 복합제 시장이 7000억원을 넘어섰고 아토르바스타틴·에제티미브 복합제와 피타바스타틴·에제티미브 복합제도 가파른 성장세를 나타냈다.21일 의약품 조사기관 유비스트에 따르면 지난해 스타틴·에제티미브 복합제의 외래 처방 시장은 총 1조2116억원으로 집계됐다. 2023년 9900억원보다 22.4% 증가하며 처음으로 1조원을 돌파했다. 스타틴·에제티미브 복합제 처방 시장은 2022년 7976억원에서 2년새 51.9% 확대되며 초강세가 계속됐다. 현재 스타틴·에제티미브 복합제는 심바스타틴, 로수바스타틴, 아토르바스타틴, 피타바스타틴 등 4종의 스타틴과 에제티미브를 결합한 4개 종류의 복합제가 등장한 상태다.스타틴·에제티미브 복합제가 저밀도 저단백 콜레스테롤(LDL-C)을 낮추는데 탁월한 효과를 보이는데다, 2개의 약을 따로 복용하는 것보다 약값 부담이 크지 않다는 이유로 선호도가 높아지는 것으로 분석된다.로수바스타틴·에제티미브 조합이 스타틴·에제티미브 복합제 시장에서 영향력이 가장 컸다.지난해 로수바스타틴·에제티미브 복합제의 원외 처방금액은 7238억원으로 전년대비 17.4% 늘었다. 2019년 2684억원과 비교하면 5년 새 시장 규모가 169.7% 확대됐다. 지난해 스타틴·에제티미브 복합제 시장에서 로수바스타틴·에제티미브 조합이 차지하는 비중은 59.7%에 달했다.로수바스타틴·에제티미브 복합제 시장은 지난 2015년 한미약품의 로수젯이 가장 먼저 등장했다. 한미약품은 에제티미브 사용권리를 특허권자 MSD로부터 확보하면서 경쟁사들보다 시장에 먼저 진입했다. 현재 국내제약사 50곳이 로수바스타틴·에제티미브 복합제 시장에 뛰어들었다.로수젯이 단연 두각을 나타냈다. 로수젯의 작년 외래 처방금액이 전년보다 17.6% 증가한 2103억원을 기록했다. 로수젯은 발매 이후 매년 신기록 행진을 이어가고 있다. 지난 2019년 처방액 787억원에서 지난 5년 간 167.2% 확대됐다. 로수젯은 지난 2020년부터 4년 연속 처방액 1000억원 이상을 기록했고 지난해 2000억원을 돌파했다. 로수젯이 로수바스타틴·에제티미브 복합제 시장에서 차지하는 비중은 28.7%에 달했다. 피타바스타틴·에제티미브 복합제의 성장세가 가장 가팔랐다.지난해 피타바스타틴·에제티미브 복합제의 외래 처방 시장은 1290억원으로 전년보다 79.1% 늘었다. 2022년 318억원에서 2년 만에 4배 이상 확대됐다.피타바스타틴·에제티미브 복합제는 2021년 JW중외제약이 리바로젯을 내놓으면서 본격적으로 시장에 출격했다. 피타바스타틴은 JW중외제약의 간판 고지혈증치료제 리바로의 주성분이다.지난해 리바로젯의 처방금액은 933억원으로 전년보다 32.4% 증가했다. 리바로젯은 2021년 10월에 발매됐는데 2022년과 2023년 각각 318억원, 720억원으로 급증했고 지난해에는 1000억원에 육박했다.대원제약, 안국약품, 보령 등도 최근 피타바스타틴·에제티미브 복합제 시장에 가세하며 시장 성장에 기여했다. 피타바스타틴·에제티미브 복합제는 2022년 스타틴·에제티미브 복합제 시장에서 차지하는 비중이 4.0%에 불과했지만 지난해에는 10.6%로 상승하며 존재감이 커졌다.아토르바스타틴·에제티미브 복합제도 제약사들의 무더기 진출 이후 높은 성장세를 지속했다.지난해 아토르바스타틴·에제티미브 복합제 처방액은 3269억원으로 1년 전보다 22.3% 상승했다. 지난 2021년 1314억원에서 3년 동안 148.8% 증가하며 매년 고성장을 기록 중이다.아토젯의 제네릭이 무더기로 진출하면서 시장 규모가 단기간에 빠른 속도로 확대됐다. 2020년까지 아토르바스타틴·에제티미브 복합제는 한국오가논의 아토젯 1개 품목이었다.2021년부터 국내기업 100여곳이 아토르바스타틴·에제티미브 시장에 동시다발로 진입하면서 시장 규모가 확대됐다. 2020년 10월 종근당이 임상시험을 거쳐 아토젯과 동일 성분의 복합제 리피로우젯을 허가받았다. 이때 22개사가 리피로우젯 위임제네릭 제품을 허가받고 2021년 4월부터 급여목록에 이름을 올렸다.2021년 2월부터 제약사 88곳이 추가로 아토젯 제네릭 허가를 받았고 리피로우젯 위임제네릭보다 한 달 늦은 5월에 급여등재 됐다. 2021년 6월 2개 업체가 추가로 아토젯 제네릭 제품을 허가받으면서 아토젯 시장에 뛰어든 국내사는 총 113곳으로 늘었다.아토르바스타틴·에제티미브 복합제는 아토젯 1개 품목만 판매되던 2020년 785억원에서 4년 만에 4배 이상 확대됐다. 스타틴·에제티미브 복합제 시장에서 아토르바스타틴·에제티미브 조합의 점유율은 2019년 17.1%에서 지난해에는 27.0%로 상승했다.심바스타틴·에제티미브 복합제는 주춤했다. 지난해 심바스타틴·에제티미브 복합제의 처방액은 318억원으로 전년보다 7.2% 감소했다. 심바스타틴·에제티미브 복합제는 2020년 429억원을 기록한 이후 4년 연속 하락했다. 심바스타틴·에제티미브 복합제의 작년 처방액은 4년 전과 비교하면 25.9% 축소됐다.한국오가논의 바이토린이 오리지널 제품인 심바스타틴·에제티미브 복합제는 스타틴·에제티미브 복합제 시장에서 가장 먼저 진입했다. 하지만 다른 조합의 성분에 비해 처방 시장이 점차적으로 위축된 양상이다. 스타틴·에제티미브 복합제 시장에서 심바스타틴·에제티미브 조합의 점유율은 2019년 10.8%를 기록했지만 지난해에는 2.6%로 쪼그라들었다.이상지질혈증치료제 시장 분석2025-01-21 06:20:27천승현
스타틴·에제 시장 1조 돌파...피타바 복합제 2년새 4배↑[데일리팜=천승현 기자] 이상지질혈증치료제 시장에서 ‘스타틴’과 ‘에제티미브’를 결합한 복합제가 고공행진을 이어갔다. 스타틴·에제티미브 복합제는 지난 5년 간 처방액이 3배 이상 증가하며 시장 규모가 1조원을 돌파했다. 로수바스타틴·에제티미브 복합제 시장이 7000억원을 넘어섰고 아토르바스타틴·에제티미브 복합제와 피타바스타틴·에제티미브 복합제도 가파른 성장세를 나타냈다.21일 의약품 조사기관 유비스트에 따르면 지난해 스타틴·에제티미브 복합제의 외래 처방 시장은 총 1조2116억원으로 집계됐다. 2023년 9900억원보다 22.4% 증가하며 처음으로 1조원을 돌파했다. 스타틴·에제티미브 복합제 처방 시장은 2022년 7976억원에서 2년새 51.9% 확대되며 초강세가 계속됐다. 현재 스타틴·에제티미브 복합제는 심바스타틴, 로수바스타틴, 아토르바스타틴, 피타바스타틴 등 4종의 스타틴과 에제티미브를 결합한 4개 종류의 복합제가 등장한 상태다.스타틴·에제티미브 복합제가 저밀도 저단백 콜레스테롤(LDL-C)을 낮추는데 탁월한 효과를 보이는데다, 2개의 약을 따로 복용하는 것보다 약값 부담이 크지 않다는 이유로 선호도가 높아지는 것으로 분석된다.로수바스타틴·에제티미브 조합이 스타틴·에제티미브 복합제 시장에서 영향력이 가장 컸다.지난해 로수바스타틴·에제티미브 복합제의 원외 처방금액은 7238억원으로 전년대비 17.4% 늘었다. 2019년 2684억원과 비교하면 5년 새 시장 규모가 169.7% 확대됐다. 지난해 스타틴·에제티미브 복합제 시장에서 로수바스타틴·에제티미브 조합이 차지하는 비중은 59.7%에 달했다.로수바스타틴·에제티미브 복합제 시장은 지난 2015년 한미약품의 로수젯이 가장 먼저 등장했다. 한미약품은 에제티미브 사용권리를 특허권자 MSD로부터 확보하면서 경쟁사들보다 시장에 먼저 진입했다. 현재 국내제약사 50곳이 로수바스타틴·에제티미브 복합제 시장에 뛰어들었다.로수젯이 단연 두각을 나타냈다. 로수젯의 작년 외래 처방금액이 전년보다 17.6% 증가한 2103억원을 기록했다. 로수젯은 발매 이후 매년 신기록 행진을 이어가고 있다. 지난 2019년 처방액 787억원에서 지난 5년 간 167.2% 확대됐다. 로수젯은 지난 2020년부터 4년 연속 처방액 1000억원 이상을 기록했고 지난해 2000억원을 돌파했다. 로수젯이 로수바스타틴·에제티미브 복합제 시장에서 차지하는 비중은 28.7%에 달했다. 피타바스타틴·에제티미브 복합제의 성장세가 가장 가팔랐다.지난해 피타바스타틴·에제티미브 복합제의 외래 처방 시장은 1290억원으로 전년보다 79.1% 늘었다. 2022년 318억원에서 2년 만에 4배 이상 확대됐다.피타바스타틴·에제티미브 복합제는 2021년 JW중외제약이 리바로젯을 내놓으면서 본격적으로 시장에 출격했다. 피타바스타틴은 JW중외제약의 간판 고지혈증치료제 리바로의 주성분이다.지난해 리바로젯의 처방금액은 933억원으로 전년보다 32.4% 증가했다. 리바로젯은 2021년 10월에 발매됐는데 2022년과 2023년 각각 318억원, 720억원으로 급증했고 지난해에는 1000억원에 육박했다.대원제약, 안국약품, 보령 등도 최근 피타바스타틴·에제티미브 복합제 시장에 가세하며 시장 성장에 기여했다. 피타바스타틴·에제티미브 복합제는 2022년 스타틴·에제티미브 복합제 시장에서 차지하는 비중이 4.0%에 불과했지만 지난해에는 10.6%로 상승하며 존재감이 커졌다.아토르바스타틴·에제티미브 복합제도 제약사들의 무더기 진출 이후 높은 성장세를 지속했다.지난해 아토르바스타틴·에제티미브 복합제 처방액은 3269억원으로 1년 전보다 22.3% 상승했다. 지난 2021년 1314억원에서 3년 동안 148.8% 증가하며 매년 고성장을 기록 중이다.아토젯의 제네릭이 무더기로 진출하면서 시장 규모가 단기간에 빠른 속도로 확대됐다. 2020년까지 아토르바스타틴·에제티미브 복합제는 한국오가논의 아토젯 1개 품목이었다.2021년부터 국내기업 100여곳이 아토르바스타틴·에제티미브 시장에 동시다발로 진입하면서 시장 규모가 확대됐다. 2020년 10월 종근당이 임상시험을 거쳐 아토젯과 동일 성분의 복합제 리피로우젯을 허가받았다. 이때 22개사가 리피로우젯 위임제네릭 제품을 허가받고 2021년 4월부터 급여목록에 이름을 올렸다.2021년 2월부터 제약사 88곳이 추가로 아토젯 제네릭 허가를 받았고 리피로우젯 위임제네릭보다 한 달 늦은 5월에 급여등재 됐다. 2021년 6월 2개 업체가 추가로 아토젯 제네릭 제품을 허가받으면서 아토젯 시장에 뛰어든 국내사는 총 113곳으로 늘었다.아토르바스타틴·에제티미브 복합제는 아토젯 1개 품목만 판매되던 2020년 785억원에서 4년 만에 4배 이상 확대됐다. 스타틴·에제티미브 복합제 시장에서 아토르바스타틴·에제티미브 조합의 점유율은 2019년 17.1%에서 지난해에는 27.0%로 상승했다.심바스타틴·에제티미브 복합제는 주춤했다. 지난해 심바스타틴·에제티미브 복합제의 처방액은 318억원으로 전년보다 7.2% 감소했다. 심바스타틴·에제티미브 복합제는 2020년 429억원을 기록한 이후 4년 연속 하락했다. 심바스타틴·에제티미브 복합제의 작년 처방액은 4년 전과 비교하면 25.9% 축소됐다.한국오가논의 바이토린이 오리지널 제품인 심바스타틴·에제티미브 복합제는 스타틴·에제티미브 복합제 시장에서 가장 먼저 진입했다. 하지만 다른 조합의 성분에 비해 처방 시장이 점차적으로 위축된 양상이다. 스타틴·에제티미브 복합제 시장에서 심바스타틴·에제티미브 조합의 점유율은 2019년 10.8%를 기록했지만 지난해에는 2.6%로 쪼그라들었다.이상지질혈증치료제 시장 분석2025-01-21 06:20:27천승현 -
 콜린알포 환수협상 5번째 소송 본격화...반전 일어날까[데일리팜=천승현 기자] 뇌기능개선제 콜린알포세레이트(콜린제제)의 환수협상 명령을 둘러싼 새로운 행정소송이 본격적으로 진행된다. 환수협상 명령이 부당하다는 내용의 행정소송 4건에 이어 협상 합의 자체가 무효라는 주장에 대해 법정 다툼이 펼쳐진다. 제약사들은 콜린제제 임상실패시 추진되는 환수를 저지하기 위해 총력전을 펼칠 태세다.14일 업계에 따르면 서울행정법원은 오는 3월 13일 제약사들이 청구한 계약 무효확인 소송의 첫 변론을 진행한다. 지난해 10월 소송이 제기된지 5개월만에 첫 변론이 열린다. 제약사들이 건보공단과 체결한 환수협상 계약이 무효라는 취지의 행정소송이다.소송에 참여한 제약사는 종근당, 경보제약, 한국프라임제약, 서흥, 한국유나이티드제약, 제뉴파마, 한국파마, 서울제약, 진양제약, 유니메드제약, 메디카코리아, 동구바이오제약, 메딕스제약, 명문제약, 성원애드콕제약, 환인제약, 한국글로벌제약, 이연제약, 넥스팜코리아, 한국파비스제약, 구주제약, 마더스제약, 고려제약, 국제약품 등 24곳이다. 콜린제제는 안전성과 유효성 검증을 위한 임상재평가가 진행 중이다. 식품의약품안전처는 2020년 6월 콜린제제 보유 업체들을 대상으로 임상시험 자료 제출을 요구했고 제약사 57곳이 재평가 임상시험에 착수했다.보건복지부는 2020년 10월 건강보험요양급여규칙 개정으로 환수협상의 근거를 마련했다. 당시 보건복지부장관은 이미 요양급여대상 여부 및 상한금액이 고시된 약제에 대해 안정적 공급 등을 위해 필요하다고 인정하는 경우에는 건보공단 이사장에게 해당 약제의 제조업자 등과 환수협상을 명령할 수 있다는 내용을 신설했다.지난 2020년 12월 보건복지부는 국민건강보험공단에 콜린제제를 보유한 업체들에 '임상시험에 실패할 경우 처방액을 반환하라‘는 내용의 요양급여계약을 명령했다. 협상 명령 8개월만에 제약사들은 콜린제제의 재평가 임상 실패로 최종적으로 적응증이 삭제될 경우 임상시험 계획서를 승인받은 날부터 삭제일까지 처방액의 20%를 건보공단에 돌려주겠다고 합의했다.제약사들은 환수협상 명령은 사실상 강요 성격이 있다는 주장을 펼쳤다.제약사들은 “만약 원고들이 건보공단 이사장의 협상 요구에 응하지 않을 경우 임상재평가 결과가 나오기도 전에 건강보험 약제급여목록에서 삭제될 것으로 우려됐다”라고 했다. 실제로 건강보험공단 측이 제약사들에 보낸 이메일에는 “협상에서 제외될 수 있는 방법은 식약처에 자진 취하하는 방법밖에 없다. 협상 마감일인 2021년 2월 10일 이전인 2021년 2월 1일자 약제급여목록에서 삭제될 경우에만 협상대상에서 제외돼 협상을 안할 수 있다”라고 명시했다.이에 따라 콜린제제를 보유한 130개 업체 중 절반이 넘는 업체들이 환수협상 요구에 따른 위험부담을 감당할 수 없다는 판단에 임상재평가를 포기했다는 설명이다.제약사들은 이 소송에서 환수조항이 법률유보의 원칙을 위배한다는 이유로 무효성을 주장하고 있다.콜린제제의 임상재평가 실패로 품목허가 취소를 받게 되더라도 처분의 효력은 장래를 향해 발생하기 때문에 요양급여지급 처분에 영향을 미치지 않는다는 논리다. 임상재평가 결과와 무관하게 제약사들이 지급받은 요양급여 비용은 적법하기 때문에 부당이익이라고 볼 수 없고 반환의무도 발생하지 않는다는 견해다제약사들은 “이 사건 환수조항은 품목허가 취소 등 사후적 사정을 들어 이미 적법하게 지급된 요양급여 비용을 소급해 반환할 의무를 새롭게 부담하도록 정하는 내용이다”라고 지적했다.임상재평가 결과에 따라 제약사들이 부담할 수 있는 금액이 과도하다는 점도 문제로 지적됐다. 콜린제제는 연간 6000억원 이상의 처방 시장을 형성 중이다. 임상재평가가 실패하면 제약사들이 환수협상에 따라 되돌려야 하는 금액은 수천억원에 달할 전망이다.제약사들은 “환수조항에서 정하고 있는 환수비율은 해당 의약품 제조로 인한 최소한의 이익보다도 상회한다”라면서 “환수조항에 따른 요양급여 반환이 이뤄질 경우 도리어 손해를 보는 구조다”라고 했다.제약사들은 콜린제제의 환수에 대한 근거가 명확하지 않다는 주장을 제기했다.국민건강보험법상 이 사건 환수조항의 법률상의 근거가 될 수 있는 다른 규정이 존재하지 않는다는 논리가 이 소송의 배경으로 제시됐다.보건당국은 국민건강보험법 제101조에 명시된 위법한 행위로 보험자·가입자 등에 손실을 주는 제약사들에 ’손실에 상당하는 금액‘을 징수하도록 규정한다. 하지만 환수조항에서 요양급여 반환의 조건으로 제시한 품목허가 처분은 부당한 방법으로 요양급여대상 여부의 결정과 급여비용 산정에 영향을 미치는 행위가 아니라는 게 제약사들의 입장이다.제약사들은 “환수조항은 어떠한 법적 근거도 없이 효능·효과에 대한 판단의 최종 책임을 제약사에 전가하고 제약사들의 정당한 권리구제 기회를 박탈하기 위한 탈법적인 조치에 해당한다”라고 주장했다.콜린제제의 환수협상을 둘러싼 행정소송은 총 5건이 진행 중이다.제약사들이 콜린제제 환수협상 관련 추가 행정소송을 제기하면 기존에 진행 중인 4건과 함께 총 5건의 소송이 동시에 가동하게 된다.콜린제제 환수협상 명령을 둘러싼 행정소송은 1차명령과 2차명령으로 구분된다.복지부의 환수협상 명령 이후 제약사들은 일제히 행정소송을 제기했다. 소송은 2개 그룹으로 나눠 제기됐다. 법무법인 광장은 대웅바이오 등 28개사의 소송을 대리했고 법무법인 세종이 종근당 등 28개사의 소송을 맡았다. 환수협상 명령의 행정소송에서는 2개 그룹 모두 지난 2022년 1심에서 각하 판결이 나왔다. 종근당 그룹이 2022년 3월 항소심을 제기했는데 지난 5월 또 다시 고배를 들었다.제약사들이 협상을 거부하자 복지부는 2021년 6월 2차 협상 명령을 내렸다. 이에 종근당 등 26개사와 대웅바이오 등 27개사로 나눠 취소소송을 제기했다. 지난 3월 종근당 등이 제기한 환수협상 2차명령 취소 소송에서 각하 판결을 내렸다. 대웅바이오 그룹은 27곳 중 씨엠지제약과 환인제약을 제외한 25곳이 이탈한 가운데 2022년 2월 각하 판결이 나왔고 항소심은 제기되지 않았다.콜린제제 행정소송 전망2025-01-20 06:20:59천승현
콜린알포 환수협상 5번째 소송 본격화...반전 일어날까[데일리팜=천승현 기자] 뇌기능개선제 콜린알포세레이트(콜린제제)의 환수협상 명령을 둘러싼 새로운 행정소송이 본격적으로 진행된다. 환수협상 명령이 부당하다는 내용의 행정소송 4건에 이어 협상 합의 자체가 무효라는 주장에 대해 법정 다툼이 펼쳐진다. 제약사들은 콜린제제 임상실패시 추진되는 환수를 저지하기 위해 총력전을 펼칠 태세다.14일 업계에 따르면 서울행정법원은 오는 3월 13일 제약사들이 청구한 계약 무효확인 소송의 첫 변론을 진행한다. 지난해 10월 소송이 제기된지 5개월만에 첫 변론이 열린다. 제약사들이 건보공단과 체결한 환수협상 계약이 무효라는 취지의 행정소송이다.소송에 참여한 제약사는 종근당, 경보제약, 한국프라임제약, 서흥, 한국유나이티드제약, 제뉴파마, 한국파마, 서울제약, 진양제약, 유니메드제약, 메디카코리아, 동구바이오제약, 메딕스제약, 명문제약, 성원애드콕제약, 환인제약, 한국글로벌제약, 이연제약, 넥스팜코리아, 한국파비스제약, 구주제약, 마더스제약, 고려제약, 국제약품 등 24곳이다. 콜린제제는 안전성과 유효성 검증을 위한 임상재평가가 진행 중이다. 식품의약품안전처는 2020년 6월 콜린제제 보유 업체들을 대상으로 임상시험 자료 제출을 요구했고 제약사 57곳이 재평가 임상시험에 착수했다.보건복지부는 2020년 10월 건강보험요양급여규칙 개정으로 환수협상의 근거를 마련했다. 당시 보건복지부장관은 이미 요양급여대상 여부 및 상한금액이 고시된 약제에 대해 안정적 공급 등을 위해 필요하다고 인정하는 경우에는 건보공단 이사장에게 해당 약제의 제조업자 등과 환수협상을 명령할 수 있다는 내용을 신설했다.지난 2020년 12월 보건복지부는 국민건강보험공단에 콜린제제를 보유한 업체들에 '임상시험에 실패할 경우 처방액을 반환하라‘는 내용의 요양급여계약을 명령했다. 협상 명령 8개월만에 제약사들은 콜린제제의 재평가 임상 실패로 최종적으로 적응증이 삭제될 경우 임상시험 계획서를 승인받은 날부터 삭제일까지 처방액의 20%를 건보공단에 돌려주겠다고 합의했다.제약사들은 환수협상 명령은 사실상 강요 성격이 있다는 주장을 펼쳤다.제약사들은 “만약 원고들이 건보공단 이사장의 협상 요구에 응하지 않을 경우 임상재평가 결과가 나오기도 전에 건강보험 약제급여목록에서 삭제될 것으로 우려됐다”라고 했다. 실제로 건강보험공단 측이 제약사들에 보낸 이메일에는 “협상에서 제외될 수 있는 방법은 식약처에 자진 취하하는 방법밖에 없다. 협상 마감일인 2021년 2월 10일 이전인 2021년 2월 1일자 약제급여목록에서 삭제될 경우에만 협상대상에서 제외돼 협상을 안할 수 있다”라고 명시했다.이에 따라 콜린제제를 보유한 130개 업체 중 절반이 넘는 업체들이 환수협상 요구에 따른 위험부담을 감당할 수 없다는 판단에 임상재평가를 포기했다는 설명이다.제약사들은 이 소송에서 환수조항이 법률유보의 원칙을 위배한다는 이유로 무효성을 주장하고 있다.콜린제제의 임상재평가 실패로 품목허가 취소를 받게 되더라도 처분의 효력은 장래를 향해 발생하기 때문에 요양급여지급 처분에 영향을 미치지 않는다는 논리다. 임상재평가 결과와 무관하게 제약사들이 지급받은 요양급여 비용은 적법하기 때문에 부당이익이라고 볼 수 없고 반환의무도 발생하지 않는다는 견해다제약사들은 “이 사건 환수조항은 품목허가 취소 등 사후적 사정을 들어 이미 적법하게 지급된 요양급여 비용을 소급해 반환할 의무를 새롭게 부담하도록 정하는 내용이다”라고 지적했다.임상재평가 결과에 따라 제약사들이 부담할 수 있는 금액이 과도하다는 점도 문제로 지적됐다. 콜린제제는 연간 6000억원 이상의 처방 시장을 형성 중이다. 임상재평가가 실패하면 제약사들이 환수협상에 따라 되돌려야 하는 금액은 수천억원에 달할 전망이다.제약사들은 “환수조항에서 정하고 있는 환수비율은 해당 의약품 제조로 인한 최소한의 이익보다도 상회한다”라면서 “환수조항에 따른 요양급여 반환이 이뤄질 경우 도리어 손해를 보는 구조다”라고 했다.제약사들은 콜린제제의 환수에 대한 근거가 명확하지 않다는 주장을 제기했다.국민건강보험법상 이 사건 환수조항의 법률상의 근거가 될 수 있는 다른 규정이 존재하지 않는다는 논리가 이 소송의 배경으로 제시됐다.보건당국은 국민건강보험법 제101조에 명시된 위법한 행위로 보험자·가입자 등에 손실을 주는 제약사들에 ’손실에 상당하는 금액‘을 징수하도록 규정한다. 하지만 환수조항에서 요양급여 반환의 조건으로 제시한 품목허가 처분은 부당한 방법으로 요양급여대상 여부의 결정과 급여비용 산정에 영향을 미치는 행위가 아니라는 게 제약사들의 입장이다.제약사들은 “환수조항은 어떠한 법적 근거도 없이 효능·효과에 대한 판단의 최종 책임을 제약사에 전가하고 제약사들의 정당한 권리구제 기회를 박탈하기 위한 탈법적인 조치에 해당한다”라고 주장했다.콜린제제의 환수협상을 둘러싼 행정소송은 총 5건이 진행 중이다.제약사들이 콜린제제 환수협상 관련 추가 행정소송을 제기하면 기존에 진행 중인 4건과 함께 총 5건의 소송이 동시에 가동하게 된다.콜린제제 환수협상 명령을 둘러싼 행정소송은 1차명령과 2차명령으로 구분된다.복지부의 환수협상 명령 이후 제약사들은 일제히 행정소송을 제기했다. 소송은 2개 그룹으로 나눠 제기됐다. 법무법인 광장은 대웅바이오 등 28개사의 소송을 대리했고 법무법인 세종이 종근당 등 28개사의 소송을 맡았다. 환수협상 명령의 행정소송에서는 2개 그룹 모두 지난 2022년 1심에서 각하 판결이 나왔다. 종근당 그룹이 2022년 3월 항소심을 제기했는데 지난 5월 또 다시 고배를 들었다.제약사들이 협상을 거부하자 복지부는 2021년 6월 2차 협상 명령을 내렸다. 이에 종근당 등 26개사와 대웅바이오 등 27개사로 나눠 취소소송을 제기했다. 지난 3월 종근당 등이 제기한 환수협상 2차명령 취소 소송에서 각하 판결을 내렸다. 대웅바이오 그룹은 27곳 중 씨엠지제약과 환인제약을 제외한 25곳이 이탈한 가운데 2022년 2월 각하 판결이 나왔고 항소심은 제기되지 않았다.콜린제제 행정소송 전망2025-01-20 06:20:59천승현 -
 2천억 성큼...국내제약, 의약품 패밀리 전략 승승장구[데일리팜=천승현 기자] 제약사들이 간판 의약품을 기반으로 개발한 복합제로 시장에 침투하는 브랜드 확장 전략이 성공 스토리를 쓰고 있다. 카나브, 아모잘탄, 제미글로, 리바로 등이 복합제 신제품을 지속적으로 내놓으며 영향력을 확대했다. 리바로패밀리는 3개 라인업만으로 2000억원에 육박하는 처방액을 기록하며 처음으로 선두에 등극했다.17일 의약품 조사기관 유비스트에 따르면 JW중외제약의 리바로, 리바로브이, 리바로젯 등 리바로패밀리 3종은 지난해 외래 처방실적 1957억원을 합작했다. 2023년 1687억원보다 16.0% 증가했다. 리바로패밀리는 지난 2021년 916억원에서 3년 만에 2배 이상 확대됐다.JW중외제약은 피타바스타틴 성분의 고지혈증치료제 리바로를 기반으로 리바로젯과 리바로브이 등 리바로패밀리 라인업 3종을 구축했다. 지난 2005년 단일제 리바로를 발매했고 2015년 리바로에 ARB 계열 고혈압치료제 발사르탄을 결합한 리바로브이를 선보였다. 2021년 10월 리바로에 고지혈증치료제 에제티미브를 결합한 리바로젯을 추가로 내놓았다.리바로젯이 높은 성장세를 이끌었다. 지난해 리바로젯의 처방금액은 933억원으로 전년보다 32.4% 증가했다.리바로젯은 리바로가 처방현장에서 구축한 신뢰도에 더해 스타틴·에제티미브 복합제의 인기몰이를 타고 흥행행진을 이어갔다. 스타틴·에제티미브 복합제는 저밀도 저단백 콜레스테롤(LDL-C)을 낮추는 데 탁월한 효과를 보이는 데다 2개의 약을 따로 복용하는 것보다 약값 부담이 크지 않다는 이유로 선호도가 높아지는 추세다.리바로젯은 지난 2022년 318억원의 처방액으로 돌풍을 일으켰고 2023년 704억원으로 2배 이상 뛰었다. 리바로젯은 지난해에도 상승세를 지속하며 2년 만에 처방액이 3배 가량 치솟았다. 발매 3년 만에 누적 처방액이 1973억원을 기록하며 회사 간판 의약품으로 도약했다.리바로의 작년 처방액은 965억원으로 전년대비 5.4% 증가했다. 리바로는 지난 2019년 700억원에서 5년 동안 37.8% 증가하며 발매 20년째에도 꾸준한 상승세를 나타냈다. 리바로브이는 지난해 60억원의 처방금액을 기록했다.리바로와 리바로젯의 선전으로 리바로패밀리는 지난 2022년 처음으로 처방액 1000억원을 넘어섰고 지난해에는 2000억원에 육박했다. 리바로패밀리는 국내 제약사의 간판 의약품패밀리 중 처음으로 처방실적 선두에 올랐다. 카나브패밀리는 가장 많은 라인업을 토대로 성장세를 이어갔다. 2011년 발매된 카나브는 보령이 자체 기술로 개발한 안지오텐신Ⅱ 수용체 차단제(ARB) 계열 고혈압 신약이다. 보령은 신약 카나브를 기반으로 6종의 복합제를 내놓았다.보령은 2013년 카나브와 이뇨제 히드로클로로티아지드를 결합한 라코르를 내놓았다. 2016년 카나브에 칼슘채널차단제(CCB) 계열 약물 암로디핀을 결합한 듀카브와 고지혈증치료제 로수바스타틴을 결합한 투베로를 선보였다. 2019년 듀카브에 로수바스타틴을 결합한 3제 복합제 듀카로와 카나브에 아토르바스타틴 성분을 결합한 고혈압·고지혈증 복합제 아카브를 발매했다. 2022년 6월 카나브에 암로디핀과 히드로클로로티아지드를 결합한 듀카브플러스를 출시했다. 이중 라코르는 동화약품이 판매한다.지난해 카나브 기반 의약품 7종의 처방금액은 1837억원으로 전년대비 8.3% 증가했다. 카나브패밀리는 지난 2020년부터 5년 연속 1000억원을 넘어섰다.카나브는 작년 처방액이 658억원으로 전년대비 4.8% 증가했다. 지난 2019년 471억원에서 5년새 39.7% 증가하며 꾸준한 성장세를 나타냈다. ARB계열 고혈압치료제 단일제가 수백개 난립하며 과당경쟁을 펼치고 새로운 복합제가 쏟아지는데도 카나브는 여전히 확고한 영향력을 유지했다.듀카브의 지난해 처방액은 608억원으로 전년보다 12.0% 늘었다. 듀카브는 지난 2019년 처방액 282억원에서 5년 동안 115.7% 확대됐다. 듀카브는 빠른 속도로 시장성을 입증하며 국내제약사들이 무더기로 특허 도전에 나선 상태다. 듀카브플러스는 작년 처방액이 185억원으로 전년보다 33.6% 뛰었다. 듀카브플러스는 지난 2년 간 4배 이상 증가하며 카나브 기반 의약품 중 가장 높은 성장률을 기록했다.듀카로는 지난해 154억원의 처방금액을 올렸고 아카브, 투베로, 라코르 등은 70억~80억원대를 기록하며 카나브패밀리 성장에 기여했다.LG화학의 제미글로, 제미메트, 제미로우, 제미다파 등 제미글로패밀리 4종은 지난해 처방액이 1530억원으로 전년보다 5.9% 늘었다.제미글로는 LG화학이 2012년 말 국산신약 19호로 허가 받은 DPP-4 억제제 계열 당뇨 신약이다. LG화학은 제미글로에 메트포르민을 결합한 제미메트, 제미글로에 이상지질혈증치료제 성분 로수바스타틴을 결합한 제미로우를 각각 내놓았다. 제미다파는 제미글로에 SGLT-2 억제제 다파글리플로진을 결합한 복합제로 2023년 4월 출시됐다.제미메트의 지난해 처방액은 1018억원으로 전년보다 1.5% 늘었다. 제미메트는 지난 2022년부터 3년 연속 1000억원 이상의 처방실적을 나타냈다. 제미글로는 지난해 처방금액이 417억원으로 전년보다 0.5% 늘었다.제미글로 기반 의약품 중 제미다파가 가파른 성장세를 나타냈다. 제미다파는 발매 첫해 21억원의 처방액을 올렸고 지난해에는 91억원으로 4배 이상 확대됐다.한미약품의 아모잘탄 기반 의약품 5종은 지난해 처방액이 총 1487억원으로 전년보다 3.2% 증가했다. 아모잘탄은 CCB 계열 암로디핀과 ARB 계열 로사르탄 2개 성분이 결합된 고혈압 복합제다.한미약품은 아모잘탄과 함께 아모잘탄플러스, 아모잘탄큐, 아모잘탄엑스큐를 판매 중이다. 아모잘탄플러스는 고혈압 치료제로 사용되는 암로디핀, 로사르탄, 클로르탈리돈 등 3개의 약물이 결합된 복합제다. 아모잘탄큐는 아모잘탄에 고지혈증치료제 로수바스타틴을 추가한 복합제다. 2021년 발매된 아모잘탄엑스큐는 아모잘탄에 로수바스타틴, 에제티미브를 결합한 제품이다. 아모잘탄은 한국MSD와의 공동 판촉 계약으로 코자엑스큐라는 제품명으로도 판매된다.아모잘탄은 작년 처방액이 911억원으로 전년보다 2.2% 늘었다. 아모잘탄은 지난 2009년 출시된 이후 1조원 이상의 누적 매출을 올렸다.아모잘탄엑스큐는 작년 처방실적이 127억원으로 전년보다 21.0% 증가하며 아모잘탄패밀리 중 가장 높은 성장률을 기록했다. 아모잘탄엑스큐는 지난 2022년 66억원에서 2년간 2배 가량 증가했다. 아모잘탄플러스는 지난해 전년보다 1.9% 증가한 315억원의 처방금액을 나타냈다.이슈=복합제 브랜드 확장 전략2025-01-17 06:20:20천승현
2천억 성큼...국내제약, 의약품 패밀리 전략 승승장구[데일리팜=천승현 기자] 제약사들이 간판 의약품을 기반으로 개발한 복합제로 시장에 침투하는 브랜드 확장 전략이 성공 스토리를 쓰고 있다. 카나브, 아모잘탄, 제미글로, 리바로 등이 복합제 신제품을 지속적으로 내놓으며 영향력을 확대했다. 리바로패밀리는 3개 라인업만으로 2000억원에 육박하는 처방액을 기록하며 처음으로 선두에 등극했다.17일 의약품 조사기관 유비스트에 따르면 JW중외제약의 리바로, 리바로브이, 리바로젯 등 리바로패밀리 3종은 지난해 외래 처방실적 1957억원을 합작했다. 2023년 1687억원보다 16.0% 증가했다. 리바로패밀리는 지난 2021년 916억원에서 3년 만에 2배 이상 확대됐다.JW중외제약은 피타바스타틴 성분의 고지혈증치료제 리바로를 기반으로 리바로젯과 리바로브이 등 리바로패밀리 라인업 3종을 구축했다. 지난 2005년 단일제 리바로를 발매했고 2015년 리바로에 ARB 계열 고혈압치료제 발사르탄을 결합한 리바로브이를 선보였다. 2021년 10월 리바로에 고지혈증치료제 에제티미브를 결합한 리바로젯을 추가로 내놓았다.리바로젯이 높은 성장세를 이끌었다. 지난해 리바로젯의 처방금액은 933억원으로 전년보다 32.4% 증가했다.리바로젯은 리바로가 처방현장에서 구축한 신뢰도에 더해 스타틴·에제티미브 복합제의 인기몰이를 타고 흥행행진을 이어갔다. 스타틴·에제티미브 복합제는 저밀도 저단백 콜레스테롤(LDL-C)을 낮추는 데 탁월한 효과를 보이는 데다 2개의 약을 따로 복용하는 것보다 약값 부담이 크지 않다는 이유로 선호도가 높아지는 추세다.리바로젯은 지난 2022년 318억원의 처방액으로 돌풍을 일으켰고 2023년 704억원으로 2배 이상 뛰었다. 리바로젯은 지난해에도 상승세를 지속하며 2년 만에 처방액이 3배 가량 치솟았다. 발매 3년 만에 누적 처방액이 1973억원을 기록하며 회사 간판 의약품으로 도약했다.리바로의 작년 처방액은 965억원으로 전년대비 5.4% 증가했다. 리바로는 지난 2019년 700억원에서 5년 동안 37.8% 증가하며 발매 20년째에도 꾸준한 상승세를 나타냈다. 리바로브이는 지난해 60억원의 처방금액을 기록했다.리바로와 리바로젯의 선전으로 리바로패밀리는 지난 2022년 처음으로 처방액 1000억원을 넘어섰고 지난해에는 2000억원에 육박했다. 리바로패밀리는 국내 제약사의 간판 의약품패밀리 중 처음으로 처방실적 선두에 올랐다. 카나브패밀리는 가장 많은 라인업을 토대로 성장세를 이어갔다. 2011년 발매된 카나브는 보령이 자체 기술로 개발한 안지오텐신Ⅱ 수용체 차단제(ARB) 계열 고혈압 신약이다. 보령은 신약 카나브를 기반으로 6종의 복합제를 내놓았다.보령은 2013년 카나브와 이뇨제 히드로클로로티아지드를 결합한 라코르를 내놓았다. 2016년 카나브에 칼슘채널차단제(CCB) 계열 약물 암로디핀을 결합한 듀카브와 고지혈증치료제 로수바스타틴을 결합한 투베로를 선보였다. 2019년 듀카브에 로수바스타틴을 결합한 3제 복합제 듀카로와 카나브에 아토르바스타틴 성분을 결합한 고혈압·고지혈증 복합제 아카브를 발매했다. 2022년 6월 카나브에 암로디핀과 히드로클로로티아지드를 결합한 듀카브플러스를 출시했다. 이중 라코르는 동화약품이 판매한다.지난해 카나브 기반 의약품 7종의 처방금액은 1837억원으로 전년대비 8.3% 증가했다. 카나브패밀리는 지난 2020년부터 5년 연속 1000억원을 넘어섰다.카나브는 작년 처방액이 658억원으로 전년대비 4.8% 증가했다. 지난 2019년 471억원에서 5년새 39.7% 증가하며 꾸준한 성장세를 나타냈다. ARB계열 고혈압치료제 단일제가 수백개 난립하며 과당경쟁을 펼치고 새로운 복합제가 쏟아지는데도 카나브는 여전히 확고한 영향력을 유지했다.듀카브의 지난해 처방액은 608억원으로 전년보다 12.0% 늘었다. 듀카브는 지난 2019년 처방액 282억원에서 5년 동안 115.7% 확대됐다. 듀카브는 빠른 속도로 시장성을 입증하며 국내제약사들이 무더기로 특허 도전에 나선 상태다. 듀카브플러스는 작년 처방액이 185억원으로 전년보다 33.6% 뛰었다. 듀카브플러스는 지난 2년 간 4배 이상 증가하며 카나브 기반 의약품 중 가장 높은 성장률을 기록했다.듀카로는 지난해 154억원의 처방금액을 올렸고 아카브, 투베로, 라코르 등은 70억~80억원대를 기록하며 카나브패밀리 성장에 기여했다.LG화학의 제미글로, 제미메트, 제미로우, 제미다파 등 제미글로패밀리 4종은 지난해 처방액이 1530억원으로 전년보다 5.9% 늘었다.제미글로는 LG화학이 2012년 말 국산신약 19호로 허가 받은 DPP-4 억제제 계열 당뇨 신약이다. LG화학은 제미글로에 메트포르민을 결합한 제미메트, 제미글로에 이상지질혈증치료제 성분 로수바스타틴을 결합한 제미로우를 각각 내놓았다. 제미다파는 제미글로에 SGLT-2 억제제 다파글리플로진을 결합한 복합제로 2023년 4월 출시됐다.제미메트의 지난해 처방액은 1018억원으로 전년보다 1.5% 늘었다. 제미메트는 지난 2022년부터 3년 연속 1000억원 이상의 처방실적을 나타냈다. 제미글로는 지난해 처방금액이 417억원으로 전년보다 0.5% 늘었다.제미글로 기반 의약품 중 제미다파가 가파른 성장세를 나타냈다. 제미다파는 발매 첫해 21억원의 처방액을 올렸고 지난해에는 91억원으로 4배 이상 확대됐다.한미약품의 아모잘탄 기반 의약품 5종은 지난해 처방액이 총 1487억원으로 전년보다 3.2% 증가했다. 아모잘탄은 CCB 계열 암로디핀과 ARB 계열 로사르탄 2개 성분이 결합된 고혈압 복합제다.한미약품은 아모잘탄과 함께 아모잘탄플러스, 아모잘탄큐, 아모잘탄엑스큐를 판매 중이다. 아모잘탄플러스는 고혈압 치료제로 사용되는 암로디핀, 로사르탄, 클로르탈리돈 등 3개의 약물이 결합된 복합제다. 아모잘탄큐는 아모잘탄에 고지혈증치료제 로수바스타틴을 추가한 복합제다. 2021년 발매된 아모잘탄엑스큐는 아모잘탄에 로수바스타틴, 에제티미브를 결합한 제품이다. 아모잘탄은 한국MSD와의 공동 판촉 계약으로 코자엑스큐라는 제품명으로도 판매된다.아모잘탄은 작년 처방액이 911억원으로 전년보다 2.2% 늘었다. 아모잘탄은 지난 2009년 출시된 이후 1조원 이상의 누적 매출을 올렸다.아모잘탄엑스큐는 작년 처방실적이 127억원으로 전년보다 21.0% 증가하며 아모잘탄패밀리 중 가장 높은 성장률을 기록했다. 아모잘탄엑스큐는 지난 2022년 66억원에서 2년간 2배 가량 증가했다. 아모잘탄플러스는 지난해 전년보다 1.9% 증가한 315억원의 처방금액을 나타냈다.이슈=복합제 브랜드 확장 전략2025-01-17 06:20:20천승현 -
 작년 외래 처방시장 역대 최대...의료 공백에도 호황기[데일리팜=천승현 기자] 지난해 외래 처방 의약품 시장이 역대 최대 규모를 형성했다. 지난해 3분기와 4분기 연거푸 신기록을 갈아치웠다. 코로나19 팬데믹 종식 이후 독감이나 감기 환자가 꾸준히 발생하면서 처방 시장 상승세가 계속된 것으로 분석된다. 정부의 의대 정원 증원 정책 여파로 대형병원의 진료가 축소되면서 의원급 의료기관을 중심으로 외래 처방 시장이 반사이익을 누렸다는 진단도 나온다.16일 의약품 조사기관 유비스트에 따르면 지난해 외래 처방 의약품 시장 규모는 20조4507억원으로 전년대비 5.9% 증가했다. 작년 외래 처방 시장은 역대 최대 기록을 경신하며 처음으로 20조원을 넘어섰다. 작년 처방 시장은 2020년 14조2441억원과 비교하면 4년간 34.2% 증가했다. 지난해에는 상반기보다 하반기 상승세가 더욱 두드러졌다. 작년 1분기 외래 처방시장은 4조9081억원으로 전년대비 5.5% 늘었고 2분기에는 4조9590억원으로 2.1% 증가했다. 지난해 3분기 처방규모는 5조1639억원으로 전년보다 7.7% 증가하며 역대 최대 규모를 나타냈고 4분기에는 전년대비 8.2% 증가한 5조4197억원으로 또 다시 신기록을 경신했다.지난해 독감이나 감기 환자가 꾸준히 발생하면서 외래 처방 시장이 확대된 것으로 분석된다.지난해 1월부터 6월 초까지 독감 유행이 어어졌다. 작년 23주차(6월 2일~8일)까지 독감 환자가 유행 기준 6.5명을 초과했다. 지난해 6월 15일 외래환자 1000명당 의사환자가 6.3명으로 전주(6.9명) 대비 0.6명 감소하면서 처음으로 독감 유행이 멈췄지만 26주차(7월6일)부터 다시 유행 기준을 넘어섰고 작년 35주차(8월31일)까지 독감 환자가 유행 기준을 초과했다.지난해 9월부터 2024·2025년 절기 유행기준 8.6명에 못 미쳤지만 12월에 독감 환자가 급증했다. 지난해 12월 마지막주에는 외래환자 1000명당 의사환자가 73.9명으로 치솟았다. 작년 12월 외래 처방시장 규모는 1조8850억원으로 전년동기대비 11.6% 뛰었다.전공의 집단 사직에 따른 대형 병원 진료 축소 등 진료 공백이 장기화하고 있지만 전체 외래 처방시장에 미치는 영향은 미미했다는 평가가 나온다.업계에서는 정부의 의대 정원 증원 정책에 대한 대형병원 진료 축소 움직임이 외래 처방 시장 확대 요인으로 작용했다는 분석도 제기한다. 대형병원의 진료 축소 여파로 입원 환자들에게 사용하는 원내 의약품 사용 감소는 불가피하지만 경증 환자들을 중심으로 대형 병원보다 의원급 의료기관을 찾으면서 외래 처방시장의 공백이 최소화했다는 견해다.외래 처방시장은 코로나19 팬데믹과 엔데믹을 겪으면서 높은 성장세가 이어졌다.코로나19 확산 첫해 2020년 외래 처방시장 규모는 15조2441억원으로 전년보다 3.5% 증가했다. 2019년 처방규모는 전년보다 8.1% 증가했는데 1년 만에 성장세가 절반 이하로 감소했다.당시 처방 시장 성장세 둔화는 코로나19가 직접적인 원인으로 지목된다. 코로나19 확산 이후 손 씻기와 마스크 착용 등 개인 위생 관리 강화로 독감이나 감기 같은 감염병 환자가 급감하면서 관련 치료제 시장도 크게 위축됐다.2021년 처방금액은 16조2601억원으로 전년보다 6.7% 증가하며 2020년 부진에서 다소 회복했다.외래 처방시장은 2021년 4분기 전년보다 11.5% 증가하며 갑작스럽게 큰 폭의 반등세를 나타냈다. 2021년 말부터 나타난 처방시장 호황은 공교롭게도 코로나19 확진자 급증의 영향으로 분석된다. 당시 코로나19 확진자가 폭증하면서 코로나19 증상 완화 용도로 사용되는 해열진통제나 감기약, 항생제 처방이 크게 늘었다. 감기약 등의 공급이 수요를 따라가지 못하는 품귀현상마저 연출됐다.지난 2022년과 처방 시장은 전년보다 9.4% 확대되며 호황기가 계속됐다. 2023년에는 코로나19 종식에도 처방시장 성장세가 지속됐다. 2023년 외래 처방 의약품 시장 규모는 19조3098억원으로 전년대비 8.5% 늘었고 작년에서 호황기가 이어졌다.2025-01-16 06:20:37천승현
작년 외래 처방시장 역대 최대...의료 공백에도 호황기[데일리팜=천승현 기자] 지난해 외래 처방 의약품 시장이 역대 최대 규모를 형성했다. 지난해 3분기와 4분기 연거푸 신기록을 갈아치웠다. 코로나19 팬데믹 종식 이후 독감이나 감기 환자가 꾸준히 발생하면서 처방 시장 상승세가 계속된 것으로 분석된다. 정부의 의대 정원 증원 정책 여파로 대형병원의 진료가 축소되면서 의원급 의료기관을 중심으로 외래 처방 시장이 반사이익을 누렸다는 진단도 나온다.16일 의약품 조사기관 유비스트에 따르면 지난해 외래 처방 의약품 시장 규모는 20조4507억원으로 전년대비 5.9% 증가했다. 작년 외래 처방 시장은 역대 최대 기록을 경신하며 처음으로 20조원을 넘어섰다. 작년 처방 시장은 2020년 14조2441억원과 비교하면 4년간 34.2% 증가했다. 지난해에는 상반기보다 하반기 상승세가 더욱 두드러졌다. 작년 1분기 외래 처방시장은 4조9081억원으로 전년대비 5.5% 늘었고 2분기에는 4조9590억원으로 2.1% 증가했다. 지난해 3분기 처방규모는 5조1639억원으로 전년보다 7.7% 증가하며 역대 최대 규모를 나타냈고 4분기에는 전년대비 8.2% 증가한 5조4197억원으로 또 다시 신기록을 경신했다.지난해 독감이나 감기 환자가 꾸준히 발생하면서 외래 처방 시장이 확대된 것으로 분석된다.지난해 1월부터 6월 초까지 독감 유행이 어어졌다. 작년 23주차(6월 2일~8일)까지 독감 환자가 유행 기준 6.5명을 초과했다. 지난해 6월 15일 외래환자 1000명당 의사환자가 6.3명으로 전주(6.9명) 대비 0.6명 감소하면서 처음으로 독감 유행이 멈췄지만 26주차(7월6일)부터 다시 유행 기준을 넘어섰고 작년 35주차(8월31일)까지 독감 환자가 유행 기준을 초과했다.지난해 9월부터 2024·2025년 절기 유행기준 8.6명에 못 미쳤지만 12월에 독감 환자가 급증했다. 지난해 12월 마지막주에는 외래환자 1000명당 의사환자가 73.9명으로 치솟았다. 작년 12월 외래 처방시장 규모는 1조8850억원으로 전년동기대비 11.6% 뛰었다.전공의 집단 사직에 따른 대형 병원 진료 축소 등 진료 공백이 장기화하고 있지만 전체 외래 처방시장에 미치는 영향은 미미했다는 평가가 나온다.업계에서는 정부의 의대 정원 증원 정책에 대한 대형병원 진료 축소 움직임이 외래 처방 시장 확대 요인으로 작용했다는 분석도 제기한다. 대형병원의 진료 축소 여파로 입원 환자들에게 사용하는 원내 의약품 사용 감소는 불가피하지만 경증 환자들을 중심으로 대형 병원보다 의원급 의료기관을 찾으면서 외래 처방시장의 공백이 최소화했다는 견해다.외래 처방시장은 코로나19 팬데믹과 엔데믹을 겪으면서 높은 성장세가 이어졌다.코로나19 확산 첫해 2020년 외래 처방시장 규모는 15조2441억원으로 전년보다 3.5% 증가했다. 2019년 처방규모는 전년보다 8.1% 증가했는데 1년 만에 성장세가 절반 이하로 감소했다.당시 처방 시장 성장세 둔화는 코로나19가 직접적인 원인으로 지목된다. 코로나19 확산 이후 손 씻기와 마스크 착용 등 개인 위생 관리 강화로 독감이나 감기 같은 감염병 환자가 급감하면서 관련 치료제 시장도 크게 위축됐다.2021년 처방금액은 16조2601억원으로 전년보다 6.7% 증가하며 2020년 부진에서 다소 회복했다.외래 처방시장은 2021년 4분기 전년보다 11.5% 증가하며 갑작스럽게 큰 폭의 반등세를 나타냈다. 2021년 말부터 나타난 처방시장 호황은 공교롭게도 코로나19 확진자 급증의 영향으로 분석된다. 당시 코로나19 확진자가 폭증하면서 코로나19 증상 완화 용도로 사용되는 해열진통제나 감기약, 항생제 처방이 크게 늘었다. 감기약 등의 공급이 수요를 따라가지 못하는 품귀현상마저 연출됐다.지난 2022년과 처방 시장은 전년보다 9.4% 확대되며 호황기가 계속됐다. 2023년에는 코로나19 종식에도 처방시장 성장세가 지속됐다. 2023년 외래 처방 의약품 시장 규모는 19조3098억원으로 전년대비 8.5% 늘었고 작년에서 호황기가 이어졌다.2025-01-16 06:20:37천승현 -
 동아제약, 3월부터 박카스 공급가 11% 인상[데일리팜=천승현 기자] 동아제약은 오는 3월 1일부터 박카스D와 박카스F의 공급가격을 인상한다고 15일 밝혔다.박카스D의 공급가는 10.9% 인상되고 박카스F의 공급가는 11.1% 오른다. 박카스D는 2021년 11월 이후 3년 5개월 만에 가격이 오르고 박카스F는 2021년 12월 이후 3년 4개월 만에 인상된다.박카스D는 약국 판매용이며 박카스F는 일반 대리점 공급 제품이다. 동아제약은 2011년 박카스가 약국 이외 장소에서도 판매가 가능한 의약외품으로 전환되면서 편의점용 박카스F를 출시했다.박카스F는 약국용 박카스D(100㎖)보다 용량이 20㎖ 많고 소화기능 항진·심장활력 증대 등에 효과가 있는 카르니틴을 함유했다는 점만 다르다.동아제약 측은 "고객의 부담을 감안해 공급가격 인상을 최대한 억제해 왔지만, 원부자재와 제조경비 등 제반경비의 지속된 상승으로 인해 부득이하게 결정됐다"라면서 "앞으로도 지속적인 제품의 품질개선과 서비스를 제공하기 위해 노력하겠다”고 말했다2025-01-15 10:44:33천승현
동아제약, 3월부터 박카스 공급가 11% 인상[데일리팜=천승현 기자] 동아제약은 오는 3월 1일부터 박카스D와 박카스F의 공급가격을 인상한다고 15일 밝혔다.박카스D의 공급가는 10.9% 인상되고 박카스F의 공급가는 11.1% 오른다. 박카스D는 2021년 11월 이후 3년 5개월 만에 가격이 오르고 박카스F는 2021년 12월 이후 3년 4개월 만에 인상된다.박카스D는 약국 판매용이며 박카스F는 일반 대리점 공급 제품이다. 동아제약은 2011년 박카스가 약국 이외 장소에서도 판매가 가능한 의약외품으로 전환되면서 편의점용 박카스F를 출시했다.박카스F는 약국용 박카스D(100㎖)보다 용량이 20㎖ 많고 소화기능 항진·심장활력 증대 등에 효과가 있는 카르니틴을 함유했다는 점만 다르다.동아제약 측은 "고객의 부담을 감안해 공급가격 인상을 최대한 억제해 왔지만, 원부자재와 제조경비 등 제반경비의 지속된 상승으로 인해 부득이하게 결정됐다"라면서 "앞으로도 지속적인 제품의 품질개선과 서비스를 제공하기 위해 노력하겠다”고 말했다2025-01-15 10:44:33천승현 -
 한미약품, 7년 연속 처방시장 선두...대형제약 동반 선전[데일리팜=천승현 기자] 한미약품이 국내 외래 처방 시장에서 7년 연속 선두를 질주했다. 연구개발(R&D) 역량으로 개발한 복합신약의 고공행진으로 독주체제를 구축했다. 종근당, 대웅제약, 유한양행, HK이노엔, 대원제약 등이 대형 제약사들이 신약과 복합신약 등 주력 의약품의 선전으로 높은 성장세를 나타냈다.15일 의약품 조사기관 유비스트에 따르면 지난해 국내 외래 처방시장에서 한미약품이 전년보다 7.1% 증가한 9951억원을 기록하며 국내외 제약사 중 가장 많은 처방실적을 올렸다. 한미약품은 지난 2018년 처음으로 처방 실적 선두에 오른 이후 7년 연속 선두 자리를 수성했다. 한미약품은 지난 2019년 처방금액 6591억원에서 지난해까지 5년간 51.0% 확대되며 꾸준한 상승세를 나타냈다. 한미약품은 지난 2019년 2위 종근당과의 격차가 631억원에 불과했지만 지난해에는 2593억원으로 벌리며 견고한 독주체제를 구축했다.한미약품은 자체 개발 복합신약이 처방 시장 강세를 이끌었다.로수젯은 지난해 외래 처방금액이 2103억원으로 전년보다 17.6% 증가했다. 로수젯은 로수바스타틴과 에제티미브 2개 성분으로 구성된 복합제다. 로수젯은 국내 개발 의약품 중 연간 처방액이 처음으로 2000억원을 돌파하며 외래 처방 시장 선두에 등극했다.로수젯은 발매 이후 매년 신기록 행진을 이어가고 있다. 지난 2019년 처방액 787억원에서 지난 5년 간 167.2% 확대됐다. 로수젯은 지난 2020년부터 4년 연속 처방액 1000억원 이상을 기록했고 지난해 2000억원을 돌파했다.고혈압복합제 아모잘탄은 작년 처방액이 911억원으로 전년보다 2.2% 증가했다. 아모잘탄은 암로디핀과 로사르탄 성분이 결합된 복합제다. 아모잘탄플러스는 지난해 처방액이 전년보다 1.9% 증가한 315억원을 기록했다. 아모잘탄플러스는 고혈압 치료제로 사용되는 암로디핀, 로사르탄, 클로르탈리돈 등 3개의 약물이 결합된 복합제다.아모잘탄을 기반으로 개발한 아모잘탄패밀리 제품 중 아모잘탄엑스큐의 성장세가 높았다. 아모잘탄엑스큐의 작년 처방 실적은 127억원으로 전년 대비 21.0% 확대됐다. 지난 2022년 66억원에서 2년새 2배 가량 성장했다. 2021년 출시된 아모잘탄엑스큐는 아모잘탄에 로수바스타틴, 에제티미브를 결합한 제품이다.지난해 국내 대형 제약사들이 처방 시장에서 동반 선전했다.종근당은 지난해 외래 처방금액이 7358억원으로 전년보다 3.2% 늘었다. 종근당은 지난 2018년부터 7년 연속 한미약품에 이어 처방 시장에서 2위를 기록했다. 종근당은 지난 2020년 처방액 6198억원에서 2021년 5995억원으로 3.3% 감소했지만 이듬해부터 3년 연속 성장세를 나타냈다.복합신약 텔미누보는 지난해 처방금액이 573억원으로 전년보다 5.9% 증가했다. 텔미누보는 두 개의 고혈압약 성분(텔미사르탄+S암로디핀)을 결합한 복합제다. 텔미누보는 2019년 처방액 423억원에서 5년간 35.3% 증가하며 지속적인 성장세를 나타냈다. 콜린알포세레이트 성분의 뇌기능개선제 종근당글리아타민은 작년 처방액이 전년보다 8.5% 증가한 1213억원을 기록했다.대웅제약은 지난해 원외 처방액이 6153억원으로 전년대비 7.0% 늘었다. 2019년 4429억원에서 5년새 38.9% 확대됐다. 신약 펙수클루가 높은 성장률로 상승세를 견인했다. 지난해 펙수클루의 처방실적은 788억원으로 전년대비 47.3% 늘었다. 2022년 7월 발매된 펙수클루는 '칼륨 경쟁적 위산분비억제제(P-CAB)’ 계열 위식도역류질환 치료 약물이다. 펙수클루는 발매 첫해 129억원의 처방실적을 기록했고 2년 만에 6배 이상 치솟았다. 대웅제약은 지난해 4월부터 종근당과 공동 판매에 나서며 영업력을 강화했다.유한양행은 지난해 처방액이 5404억원으로 전년보다 7.6% 증가했다. 항암신약 렉라자의 작년 외래 처방액이 478억원으로 전년동기대비 91.5% 늘었다. 렉라자는 2021년 1월 국내 개발 31호 신약으로 허가 받은 비소세포폐암 치료제다. 지난해부터 렉라자가 1차치료제로 건강보험 급여 범위가 확대되면서 외래 처방도 급증했다.HK이노엔의 지난해 원외 처방금액은 5221억원으로 전년보다 6.0% 늘었다. P-CAB 계열 위식도역류질환 신약 케이캡은 전년대비 처방액이 24.4% 증가한 1969억원을 기록했다. 케이캡은 2019년 304억원의 첫 처방실적을 기록하며 돌풍을 일으켰고 5년 만에 6배 이상 치솟았다. 케이캡은 기존 프로톤펌프억제제(PPI) 계열 제품보다 약효가 빠르게 나타나고, 식사 전후 상관 없이 복용이 가능한 점 등 장점을 앞세워 높은 성장세를 지속하고 있다.대원제약은 감기약과 소염진통제의 약진으로 처방실적 상위 제약사 중 가장 높은 성장률을 기록했다. 대원제약은 작년 원외 처방금액이 4738원으로 전년대비 15.4% 성장했다. 감기약 코대원에스의 처방금액이 2023년 519억원에서 지난해 701억원으로 35.1% 증가했다. 소염진통제 신약 펠루비는 작년 처방액이 622억원으로 전년동기대비 30.9% 늘었다. 대원제약의 처방금액은 2019년 2815억원에서 5년새 68.3% 확대됐다.2025-01-15 06:20:29천승현
한미약품, 7년 연속 처방시장 선두...대형제약 동반 선전[데일리팜=천승현 기자] 한미약품이 국내 외래 처방 시장에서 7년 연속 선두를 질주했다. 연구개발(R&D) 역량으로 개발한 복합신약의 고공행진으로 독주체제를 구축했다. 종근당, 대웅제약, 유한양행, HK이노엔, 대원제약 등이 대형 제약사들이 신약과 복합신약 등 주력 의약품의 선전으로 높은 성장세를 나타냈다.15일 의약품 조사기관 유비스트에 따르면 지난해 국내 외래 처방시장에서 한미약품이 전년보다 7.1% 증가한 9951억원을 기록하며 국내외 제약사 중 가장 많은 처방실적을 올렸다. 한미약품은 지난 2018년 처음으로 처방 실적 선두에 오른 이후 7년 연속 선두 자리를 수성했다. 한미약품은 지난 2019년 처방금액 6591억원에서 지난해까지 5년간 51.0% 확대되며 꾸준한 상승세를 나타냈다. 한미약품은 지난 2019년 2위 종근당과의 격차가 631억원에 불과했지만 지난해에는 2593억원으로 벌리며 견고한 독주체제를 구축했다.한미약품은 자체 개발 복합신약이 처방 시장 강세를 이끌었다.로수젯은 지난해 외래 처방금액이 2103억원으로 전년보다 17.6% 증가했다. 로수젯은 로수바스타틴과 에제티미브 2개 성분으로 구성된 복합제다. 로수젯은 국내 개발 의약품 중 연간 처방액이 처음으로 2000억원을 돌파하며 외래 처방 시장 선두에 등극했다.로수젯은 발매 이후 매년 신기록 행진을 이어가고 있다. 지난 2019년 처방액 787억원에서 지난 5년 간 167.2% 확대됐다. 로수젯은 지난 2020년부터 4년 연속 처방액 1000억원 이상을 기록했고 지난해 2000억원을 돌파했다.고혈압복합제 아모잘탄은 작년 처방액이 911억원으로 전년보다 2.2% 증가했다. 아모잘탄은 암로디핀과 로사르탄 성분이 결합된 복합제다. 아모잘탄플러스는 지난해 처방액이 전년보다 1.9% 증가한 315억원을 기록했다. 아모잘탄플러스는 고혈압 치료제로 사용되는 암로디핀, 로사르탄, 클로르탈리돈 등 3개의 약물이 결합된 복합제다.아모잘탄을 기반으로 개발한 아모잘탄패밀리 제품 중 아모잘탄엑스큐의 성장세가 높았다. 아모잘탄엑스큐의 작년 처방 실적은 127억원으로 전년 대비 21.0% 확대됐다. 지난 2022년 66억원에서 2년새 2배 가량 성장했다. 2021년 출시된 아모잘탄엑스큐는 아모잘탄에 로수바스타틴, 에제티미브를 결합한 제품이다.지난해 국내 대형 제약사들이 처방 시장에서 동반 선전했다.종근당은 지난해 외래 처방금액이 7358억원으로 전년보다 3.2% 늘었다. 종근당은 지난 2018년부터 7년 연속 한미약품에 이어 처방 시장에서 2위를 기록했다. 종근당은 지난 2020년 처방액 6198억원에서 2021년 5995억원으로 3.3% 감소했지만 이듬해부터 3년 연속 성장세를 나타냈다.복합신약 텔미누보는 지난해 처방금액이 573억원으로 전년보다 5.9% 증가했다. 텔미누보는 두 개의 고혈압약 성분(텔미사르탄+S암로디핀)을 결합한 복합제다. 텔미누보는 2019년 처방액 423억원에서 5년간 35.3% 증가하며 지속적인 성장세를 나타냈다. 콜린알포세레이트 성분의 뇌기능개선제 종근당글리아타민은 작년 처방액이 전년보다 8.5% 증가한 1213억원을 기록했다.대웅제약은 지난해 원외 처방액이 6153억원으로 전년대비 7.0% 늘었다. 2019년 4429억원에서 5년새 38.9% 확대됐다. 신약 펙수클루가 높은 성장률로 상승세를 견인했다. 지난해 펙수클루의 처방실적은 788억원으로 전년대비 47.3% 늘었다. 2022년 7월 발매된 펙수클루는 '칼륨 경쟁적 위산분비억제제(P-CAB)’ 계열 위식도역류질환 치료 약물이다. 펙수클루는 발매 첫해 129억원의 처방실적을 기록했고 2년 만에 6배 이상 치솟았다. 대웅제약은 지난해 4월부터 종근당과 공동 판매에 나서며 영업력을 강화했다.유한양행은 지난해 처방액이 5404억원으로 전년보다 7.6% 증가했다. 항암신약 렉라자의 작년 외래 처방액이 478억원으로 전년동기대비 91.5% 늘었다. 렉라자는 2021년 1월 국내 개발 31호 신약으로 허가 받은 비소세포폐암 치료제다. 지난해부터 렉라자가 1차치료제로 건강보험 급여 범위가 확대되면서 외래 처방도 급증했다.HK이노엔의 지난해 원외 처방금액은 5221억원으로 전년보다 6.0% 늘었다. P-CAB 계열 위식도역류질환 신약 케이캡은 전년대비 처방액이 24.4% 증가한 1969억원을 기록했다. 케이캡은 2019년 304억원의 첫 처방실적을 기록하며 돌풍을 일으켰고 5년 만에 6배 이상 치솟았다. 케이캡은 기존 프로톤펌프억제제(PPI) 계열 제품보다 약효가 빠르게 나타나고, 식사 전후 상관 없이 복용이 가능한 점 등 장점을 앞세워 높은 성장세를 지속하고 있다.대원제약은 감기약과 소염진통제의 약진으로 처방실적 상위 제약사 중 가장 높은 성장률을 기록했다. 대원제약은 작년 원외 처방금액이 4738원으로 전년대비 15.4% 성장했다. 감기약 코대원에스의 처방금액이 2023년 519억원에서 지난해 701억원으로 35.1% 증가했다. 소염진통제 신약 펠루비는 작년 처방액이 622억원으로 전년동기대비 30.9% 늘었다. 대원제약의 처방금액은 2019년 2815억원에서 5년새 68.3% 확대됐다.2025-01-15 06:20:29천승현 -
 임성기연구자상 대상에 최형진 서울대 교수[데일리팜=천승현 기자] 임성기재단은 제4회 임성기연구자상 대상 수상자로 서울대학교 뇌인지과학과 해부학교실 최형진 교수를 선정했다고 14일 밝혔다. 만 45세 미만 연구자 대상의 젊은연구자상은 성균관대학교 의과대학 임세진 교수와 성균관대 화학과 이원화 교수가 각각 선정됐다.임성기연구자상은 한미약품 창업주 고 임성기 회장의 신약 개발에 대한 유지를 계승하기 위해 임 회장 가족이 설립한 임성기재단이 제정한 상이다. 재단은 의학, 약학, 생명과학 분야 석학들로 이뤄진 별도의 심사위원회를 구성해 엄격한 심사를 거쳐 수상자들을 선정했다.최형진 교수대상 수상자 최형진 교수는 GLP-1 비만 치료제가 뇌의 시상하부에 작용해 음식을 인지하는 것만으로도 포만감을 유발하고 식욕을 억제한다는 사실을 세계 최초로 규명했다.이번에 수상하게 된 연구 내용은 뇌의 배부름 중추와 인지과학에 대한 기초과학적 발견으로 평가되며, 세계적인 과학저널 사이언스지에 관련 논문이 게재됐다.최 교수는 배부름을 인지하는 뇌의 기전과 이를 관장하는 뇌의 중추를 최초로 발견함으로써, 부작용 없는 안전하고 혁신적 비만 치료제 개발의 기틀을 마련했다는 평가를 받았다.젊은연구자상을 받는 임세진 교수는 ‘이식편대숙주병'의 면역치료 전략 개발에 중요한 돌파구를 마련했다는 평가다. 이식편대숙주병은 골수이식 과정에서 수혈된 림프구가 면역기능이 저하된 환자의 몸을 공격하면서 여러 합병증을 일으키는 질환으로, 치사율이 매우 높아 치명적이다.왼쪽부터 임세진 교수와 이원화 교수임 교수는 동종 이식모델을 활용해 독점적 증식 잠재력을 가진 전사조절인자 TCF1을 발현하는 새로운 CD8 T세포 아집단을 발견했다. TCF1 발현 T세포가 자원 세포로 기능하는 반면 Tim-3 발현 효과 T세포가 GVHD를 유발하는 주된 세포군임을 밝혀냈다.젊은연구자상 수상자 이원화 교수는 코로나19를 유발하는 바이러스인 SARS-CoV-2에 감염됐을 때 발현되는 TOX 단백질의 새로운 병리학적 역할을 규명했다.이 연구 내용은 고령자와 기저질환이 있는 취약 계층에서 바이러스 감염으로 유발되는 심각한 염증 반응과 조직 손상의 기전을 밝혀낸 성과로 평가된다.김창수 임성기재단 이사장은 “올해 임성기연구자상 수상자들의 연구는 최근 전 세계적으로 주목받고 있는 분야에서 혁신적 성과를 이뤄냈고, 이를 통해 신약 개발의 중요한 단초를 제공했다는 점에서 큰 의의가 있다”고 설명했다.시상식은 오는 3월초 열리며 대상 수상자에게는 상패와 상금 3억원, 젊은연구자상 수상자 2명에게는 각각 상패와 상금 5000만원이 전달된다.2025-01-14 14:45:05천승현
임성기연구자상 대상에 최형진 서울대 교수[데일리팜=천승현 기자] 임성기재단은 제4회 임성기연구자상 대상 수상자로 서울대학교 뇌인지과학과 해부학교실 최형진 교수를 선정했다고 14일 밝혔다. 만 45세 미만 연구자 대상의 젊은연구자상은 성균관대학교 의과대학 임세진 교수와 성균관대 화학과 이원화 교수가 각각 선정됐다.임성기연구자상은 한미약품 창업주 고 임성기 회장의 신약 개발에 대한 유지를 계승하기 위해 임 회장 가족이 설립한 임성기재단이 제정한 상이다. 재단은 의학, 약학, 생명과학 분야 석학들로 이뤄진 별도의 심사위원회를 구성해 엄격한 심사를 거쳐 수상자들을 선정했다.최형진 교수대상 수상자 최형진 교수는 GLP-1 비만 치료제가 뇌의 시상하부에 작용해 음식을 인지하는 것만으로도 포만감을 유발하고 식욕을 억제한다는 사실을 세계 최초로 규명했다.이번에 수상하게 된 연구 내용은 뇌의 배부름 중추와 인지과학에 대한 기초과학적 발견으로 평가되며, 세계적인 과학저널 사이언스지에 관련 논문이 게재됐다.최 교수는 배부름을 인지하는 뇌의 기전과 이를 관장하는 뇌의 중추를 최초로 발견함으로써, 부작용 없는 안전하고 혁신적 비만 치료제 개발의 기틀을 마련했다는 평가를 받았다.젊은연구자상을 받는 임세진 교수는 ‘이식편대숙주병'의 면역치료 전략 개발에 중요한 돌파구를 마련했다는 평가다. 이식편대숙주병은 골수이식 과정에서 수혈된 림프구가 면역기능이 저하된 환자의 몸을 공격하면서 여러 합병증을 일으키는 질환으로, 치사율이 매우 높아 치명적이다.왼쪽부터 임세진 교수와 이원화 교수임 교수는 동종 이식모델을 활용해 독점적 증식 잠재력을 가진 전사조절인자 TCF1을 발현하는 새로운 CD8 T세포 아집단을 발견했다. TCF1 발현 T세포가 자원 세포로 기능하는 반면 Tim-3 발현 효과 T세포가 GVHD를 유발하는 주된 세포군임을 밝혀냈다.젊은연구자상 수상자 이원화 교수는 코로나19를 유발하는 바이러스인 SARS-CoV-2에 감염됐을 때 발현되는 TOX 단백질의 새로운 병리학적 역할을 규명했다.이 연구 내용은 고령자와 기저질환이 있는 취약 계층에서 바이러스 감염으로 유발되는 심각한 염증 반응과 조직 손상의 기전을 밝혀낸 성과로 평가된다.김창수 임성기재단 이사장은 “올해 임성기연구자상 수상자들의 연구는 최근 전 세계적으로 주목받고 있는 분야에서 혁신적 성과를 이뤄냈고, 이를 통해 신약 개발의 중요한 단초를 제공했다는 점에서 큰 의의가 있다”고 설명했다.시상식은 오는 3월초 열리며 대상 수상자에게는 상패와 상금 3억원, 젊은연구자상 수상자 2명에게는 각각 상패와 상금 5000만원이 전달된다.2025-01-14 14:45:05천승현 -
 로수젯·케이캡 처방시장 제패...'2천억' K-신약 전성시대[데일리팜=천승현 기자] 국내 외래 처방시장에서 국내 개발 의약품이 선두권을 장악했다. 한미약품의 복합신약 로수젯이 국내 개발 의약품 중 최초로 연간 외래 처방액 선두에 등극했다. 로수젯은 국내기업 개발 의약품으로는 처음으로 연간 처방금액이 2000억원을 돌파했다. HK이노엔의 신약 케이캡은 2000억원에 육박하는 처방액으로 선두권을 형성했다.14일 의약품 조사기관 유비스트에 따르면 지난해 한미약품의 로수젯의 외래 처방금액이 전년보다 17.6% 증가한 2103억원을 기록하며 전체 선두에 올랐다.로수젯은 지난 2021년부터 2023년까지 3년 연속 전체 2위를 기록했고 지난해 처음으로 선두에 올랐다. 국내 개발 의약품이 연간 외래 처방시장에서 1위에 오른 것은 로수젯이 최초다. 비아트리스의 리피토가 지난 2018년부터 2023년까지 6년 연속 선두를 수성한 바 있다. 2015년 말 출시된 로수젯은 로수바스타틴과 에제티미브 2개 성분으로 구성된 고지혈증 복합제다. 로수젯은 시장 선점 효과와 스타틴·에제티미브 복합제의 인기몰이로 가파른 성장세를 기록 중이다. 스타틴·에제티미브 복합제는 저밀도 저단백 콜레스테롤(LDL-C)을 낮추는 데 탁월한 효과를 보이는 데다 2개의 약을 따로 복용하는 것보다 약값 부담이 크지 않다는 이유로 선호도가 높아지는 추세다.로수젯은 발매 이후 매년 신기록 행진을 이어가고 있다. 지난 2019년 처방액 787억원에서 지난 5년 간 167.2% 확대됐다. 로수젯은 지난 2020년부터 4년 연속 처방액 1000억원 이상을 기록했고 지난해 2000억원을 돌파했다. 국내 개발 의약품 중 연간 처방액이 2000억원을 넘어선 것은 로수젯이 처음이다. 분기별 처방액을 보면 로수젯은 지난해 1분기 489억원의 처방액으로 선두에 올랐고 이후 500억원대를 기록하며 1위 자리를 수성했다.HK이노엔의 신약 케이캡이 작년 처방액 1969억원으로 2위에 올랐다. 지난해 케이캡은 전년대비 처방액이 24.4% 증가하는 높은 성장률을 나타냈다.지난 2018년 국내개발 신약 30호로 허가받은 케이캡은 '칼륨 경쟁적 위산분비억제제(P-CAB)’ 계열의 위식도역류질환치료제다. 위벽 세포에서 산분비 최종 단계에 위치하는 양성자펌프와 칼륨이온을 경쟁적으로 결합시켜 위산 분비를 저해하는 작용기전을 나타낸다.케이캡은 2019년 304억원의 첫 처방실적을 기록하며 돌풍을 일으켰고 5년 만에 6배 이상 치솟았다.케이캡은 기존 프로톤펌프억제제(PPI) 계열 제품보다 약효가 빠르게 나타나고, 식사 전후 상관 없이 복용이 가능한 점 등 장점을 앞세워 높은 성장세를 지속하고 있다. 케이캡은 출시 3년째인 2021년 처방액 1000억원을 돌파했고 지난해에는 2000억원에 근접하며 매년 신기록을 작성했다.케이캡은 미란성과 비미란성 위식도역류질환에 이어 위궤양, 소화성 궤양·만성 위축성 위염 환자에서 헬리코박터파일로리 제균을 위한 항생제 병용요법, 미란성 위식도역류질환 치료 후 유지요법 등 5개 적응증을 순차적으로 확보했다.케이캡은 지난해부터 영업 파트너가 종근당에서 보령으로 변경됐지만 고공행진을 지속했다. HK이노엔과 보령은 2023년 말 코프로모션 계약을 맺고 케이캡과 카나브패밀리의 공동 판매를 시작했다. 카나브패밀리는 보령의 고혈압신약 카나브와 카나브를 기반으로 개발한 복합제로 구성됐다.비아트리스의 리피토는 작년 처방액이 전년보다 3.6% 감소한 1887억원을 기록하며 6년 연속 선두를 마감하며 3위로 순위가 내려앉았다. 지난 1999년 국내 시장에 발매된 리피토는 아토르바스타틴 성분의 이상지질혈증치료제다. 리피토는 국내기업들의 제네릭 100여개 제품과 다양한 유형의 고지혈증복합제의 집중 공세를 감안하면 여전히 시장에서 건재를 과시하고 있다는 평가다.아스트라제네카의 항암제 타그리소가 큰 두각을 나타냈다. 타그리소는 작년 외래 처방금액이 1368억원으로 전년동기보다 52.9% 늘었다.타그리소는 상피세포성장인자수용체(EGFR) 티로신키나제억제제(TKI)다. EGFR-TKI는 EGFR 돌연변이를 동반한 전이성 비소세포폐암(NSCLC) 환자에게 처방되는 표적항암제다. 타그리소는 지난해부터 유한양행의 렉라자와 함께 특정 유전자 변이가 있는 국소 진행성 또는 전이성 비소세포폐암 1차 치료’로 건강보험 급여 범위가 확대됐다.항암제는 입원 환자 처방 비중이 크지만 타그리소는 경구용이라는 특성상 외래 처방액도 큰 폭으로 확대된 것으로 분석된다. 타그리소와 같은 시기에 급여가 확대된 렉라자는 지난해 외래 처방금액이 478억원으로 전년대비 91.5% 늘었다.한국오가논의 고지혈증복합제 아토젯은 지난해 처방액이 1187억원으로 전년대비 16.3% 증가하며 상위권에 포진했다. 아토젯은 아토르바스타틴과 에제티미브를 결합한 복합제다. 2021년부터 국내기업 100여곳이 아토르바스타틴·에제티미브 시장에 동시다발로 진입했지만 아토젯은 더욱 견고한 상승세를 나타냈다. 아토젯은 종근당이 판매하고 있다.다이이찌산쿄의 항응고제 릭시아나는 지난해 처방액이 전년보다 11.6% 증가한 1175억원을 기록하며 2년 연속 연간 처방실적 1000억원을 돌파했다.대웅바이오의 콜린알포세레이트 성분의 뇌기능개선제 글리아타민은 지난해 처방액이 전년보다 3.3% 증가한 1597억원을 기록하며 4년 연속 1000억원을 넘어섰다. 효능 논란에 이은 급여 축소, 환수협상 명령 등 고비를 겪고 있는데도 여전히 처방의약품 시장에서는 건재를 과시했다. 종근당의 콜린알포세레이트 성분 종근당글리아티린은 작년 처방액이 전년보다 8.5% 증가한 1213억원을 기록했다.LG화학이 자체 개발한 당뇨복합제 제미메트는 지난해 처방액이 1018억원으로 3년 연속 1000억원을 돌파했다. 제미메트는 LG화학이 자체 개발한 DPP-4 억제제 계열 당뇨병 신약 제미글로에 메트포르민을 결합한 복합제다.지난해 처방액이 1000억원을 넘은 제품은 총 10개로 역대 가장 많았다. 2021년과 2022년에는 각각 5개와 7개 제품이 1000억원 이상의 처방액을 기록했고 2023년에는 9개 제품이 1000억원을 넘어섰다. 작년 처방액 1000억원 이상 제품 중 국내 기업의 의약품이 5개로 절반을 차지했다.2025-01-14 06:20:10천승현
로수젯·케이캡 처방시장 제패...'2천억' K-신약 전성시대[데일리팜=천승현 기자] 국내 외래 처방시장에서 국내 개발 의약품이 선두권을 장악했다. 한미약품의 복합신약 로수젯이 국내 개발 의약품 중 최초로 연간 외래 처방액 선두에 등극했다. 로수젯은 국내기업 개발 의약품으로는 처음으로 연간 처방금액이 2000억원을 돌파했다. HK이노엔의 신약 케이캡은 2000억원에 육박하는 처방액으로 선두권을 형성했다.14일 의약품 조사기관 유비스트에 따르면 지난해 한미약품의 로수젯의 외래 처방금액이 전년보다 17.6% 증가한 2103억원을 기록하며 전체 선두에 올랐다.로수젯은 지난 2021년부터 2023년까지 3년 연속 전체 2위를 기록했고 지난해 처음으로 선두에 올랐다. 국내 개발 의약품이 연간 외래 처방시장에서 1위에 오른 것은 로수젯이 최초다. 비아트리스의 리피토가 지난 2018년부터 2023년까지 6년 연속 선두를 수성한 바 있다. 2015년 말 출시된 로수젯은 로수바스타틴과 에제티미브 2개 성분으로 구성된 고지혈증 복합제다. 로수젯은 시장 선점 효과와 스타틴·에제티미브 복합제의 인기몰이로 가파른 성장세를 기록 중이다. 스타틴·에제티미브 복합제는 저밀도 저단백 콜레스테롤(LDL-C)을 낮추는 데 탁월한 효과를 보이는 데다 2개의 약을 따로 복용하는 것보다 약값 부담이 크지 않다는 이유로 선호도가 높아지는 추세다.로수젯은 발매 이후 매년 신기록 행진을 이어가고 있다. 지난 2019년 처방액 787억원에서 지난 5년 간 167.2% 확대됐다. 로수젯은 지난 2020년부터 4년 연속 처방액 1000억원 이상을 기록했고 지난해 2000억원을 돌파했다. 국내 개발 의약품 중 연간 처방액이 2000억원을 넘어선 것은 로수젯이 처음이다. 분기별 처방액을 보면 로수젯은 지난해 1분기 489억원의 처방액으로 선두에 올랐고 이후 500억원대를 기록하며 1위 자리를 수성했다.HK이노엔의 신약 케이캡이 작년 처방액 1969억원으로 2위에 올랐다. 지난해 케이캡은 전년대비 처방액이 24.4% 증가하는 높은 성장률을 나타냈다.지난 2018년 국내개발 신약 30호로 허가받은 케이캡은 '칼륨 경쟁적 위산분비억제제(P-CAB)’ 계열의 위식도역류질환치료제다. 위벽 세포에서 산분비 최종 단계에 위치하는 양성자펌프와 칼륨이온을 경쟁적으로 결합시켜 위산 분비를 저해하는 작용기전을 나타낸다.케이캡은 2019년 304억원의 첫 처방실적을 기록하며 돌풍을 일으켰고 5년 만에 6배 이상 치솟았다.케이캡은 기존 프로톤펌프억제제(PPI) 계열 제품보다 약효가 빠르게 나타나고, 식사 전후 상관 없이 복용이 가능한 점 등 장점을 앞세워 높은 성장세를 지속하고 있다. 케이캡은 출시 3년째인 2021년 처방액 1000억원을 돌파했고 지난해에는 2000억원에 근접하며 매년 신기록을 작성했다.케이캡은 미란성과 비미란성 위식도역류질환에 이어 위궤양, 소화성 궤양·만성 위축성 위염 환자에서 헬리코박터파일로리 제균을 위한 항생제 병용요법, 미란성 위식도역류질환 치료 후 유지요법 등 5개 적응증을 순차적으로 확보했다.케이캡은 지난해부터 영업 파트너가 종근당에서 보령으로 변경됐지만 고공행진을 지속했다. HK이노엔과 보령은 2023년 말 코프로모션 계약을 맺고 케이캡과 카나브패밀리의 공동 판매를 시작했다. 카나브패밀리는 보령의 고혈압신약 카나브와 카나브를 기반으로 개발한 복합제로 구성됐다.비아트리스의 리피토는 작년 처방액이 전년보다 3.6% 감소한 1887억원을 기록하며 6년 연속 선두를 마감하며 3위로 순위가 내려앉았다. 지난 1999년 국내 시장에 발매된 리피토는 아토르바스타틴 성분의 이상지질혈증치료제다. 리피토는 국내기업들의 제네릭 100여개 제품과 다양한 유형의 고지혈증복합제의 집중 공세를 감안하면 여전히 시장에서 건재를 과시하고 있다는 평가다.아스트라제네카의 항암제 타그리소가 큰 두각을 나타냈다. 타그리소는 작년 외래 처방금액이 1368억원으로 전년동기보다 52.9% 늘었다.타그리소는 상피세포성장인자수용체(EGFR) 티로신키나제억제제(TKI)다. EGFR-TKI는 EGFR 돌연변이를 동반한 전이성 비소세포폐암(NSCLC) 환자에게 처방되는 표적항암제다. 타그리소는 지난해부터 유한양행의 렉라자와 함께 특정 유전자 변이가 있는 국소 진행성 또는 전이성 비소세포폐암 1차 치료’로 건강보험 급여 범위가 확대됐다.항암제는 입원 환자 처방 비중이 크지만 타그리소는 경구용이라는 특성상 외래 처방액도 큰 폭으로 확대된 것으로 분석된다. 타그리소와 같은 시기에 급여가 확대된 렉라자는 지난해 외래 처방금액이 478억원으로 전년대비 91.5% 늘었다.한국오가논의 고지혈증복합제 아토젯은 지난해 처방액이 1187억원으로 전년대비 16.3% 증가하며 상위권에 포진했다. 아토젯은 아토르바스타틴과 에제티미브를 결합한 복합제다. 2021년부터 국내기업 100여곳이 아토르바스타틴·에제티미브 시장에 동시다발로 진입했지만 아토젯은 더욱 견고한 상승세를 나타냈다. 아토젯은 종근당이 판매하고 있다.다이이찌산쿄의 항응고제 릭시아나는 지난해 처방액이 전년보다 11.6% 증가한 1175억원을 기록하며 2년 연속 연간 처방실적 1000억원을 돌파했다.대웅바이오의 콜린알포세레이트 성분의 뇌기능개선제 글리아타민은 지난해 처방액이 전년보다 3.3% 증가한 1597억원을 기록하며 4년 연속 1000억원을 넘어섰다. 효능 논란에 이은 급여 축소, 환수협상 명령 등 고비를 겪고 있는데도 여전히 처방의약품 시장에서는 건재를 과시했다. 종근당의 콜린알포세레이트 성분 종근당글리아티린은 작년 처방액이 전년보다 8.5% 증가한 1213억원을 기록했다.LG화학이 자체 개발한 당뇨복합제 제미메트는 지난해 처방액이 1018억원으로 3년 연속 1000억원을 돌파했다. 제미메트는 LG화학이 자체 개발한 DPP-4 억제제 계열 당뇨병 신약 제미글로에 메트포르민을 결합한 복합제다.지난해 처방액이 1000억원을 넘은 제품은 총 10개로 역대 가장 많았다. 2021년과 2022년에는 각각 5개와 7개 제품이 1000억원 이상의 처방액을 기록했고 2023년에는 9개 제품이 1000억원을 넘어섰다. 작년 처방액 1000억원 이상 제품 중 국내 기업의 의약품이 5개로 절반을 차지했다.2025-01-14 06:20:10천승현 -
 생동성시험 3년새 60%↓...제네릭 약가 재평가 그림자[데일리팜=천승현 기자] 지난해 제네릭 개발을 위한 생물학적동등성시험 건수가 크게 줄었다. 지난 2018년 이후 6년 만에 최소 건수를 나타냈다. 생동성시험 승인 건수는 2021년 이후 3년 연속 감소하며 3년새 60% 이상 줄었다. 2020년부터 진행한 제네릭 약가재평가가 종료되면서 약가유지를 위한 생동성시험 수행이 급감했다. 약가유지를 위한 생동성시험 수행으로 불필요한 비용을 지출하는 기현상이 정상화했다는 평가다.14일 식품의약품안전처에 따르면 지난해 생동성시험 계획 승인 건수는 총 197건으로 전년대비 14.0% 줄었다. 생동성시험 계획 승인 건수는 2021년 505건을 기록한 이후 3년 연속 감소세를 나타냈다. 지난해 생동성시험 시도 건수는 3년 전과 비교하면 61.0% 줄었다.연도별 생물학적동등성시험 계획 승인건수(단위: 개, 자료: 식품의약품안전처) 정부의 제네릭 약가재평가가 종료되면서 생동성시험 건수가 감소한 것으로 분석된다.지난 2020년 6월 보건복지부는 최고가 요건을 갖추지 못한 제네릭은 2023년 2월28일까지 ‘생동성시험 수행’과 ‘등록 원료의약품 사용’ 자료를 제출하면 종전 약가를 유지해주는 내용의 약제 상한금액 재평가 계획 공고를 냈다.제네릭 약가재평가는 2020년 7월부터 시행된 새 약가제도를 기등재 제네릭에 적용하기 위한 정책이다. 개편 약가제도에서 제네릭 제품은 생동성시험 직접 수행과 등록 원료의약품 사용 요건을 모두 충족해야만 최고가를 받을 수 있다.제약사들은 약가인하를 회피하기 위해 기허가 제네릭 제품에 대해서도 생동성시험에 착수했다. 제제 연구를 통해 제네릭을 만들어 생동성시험을 진행하고 동등 결과를 얻어내면 변경 허가를 통해 약가인하를 회피하는 전략이다. 이때 위탁제조를 자사 제조로 전환하면서 허가변경을 통해 ‘생동성시험 실시’ 요건을 충족하고 약가인하를 모면하는 방식이다.제약사들의 생동성시험 계획 승인 건수는 2019년 259건을 기록했는데 제네릭 약가재평가가 공고된 2020년에는 323건으로 24.7% 늘었다. 2021년에는 505건으로 2년만에 2배 가량 증가했다. 지난해 생동성시험 계획 승인 건수는 2018년 이후 6년 만에 가장 낮은 수치다.제네릭 약가재평가 자료 제출기한이 만료되면서 기허가 제품의 생동성시험을 진행하는 기현상이 사라졌다는 평가가 나온다. 제약사들은 기허가 제네릭의 생동성시험 수행에 대해 “불필요한 비용 낭비”라는 불만을 쏟아냈다. 이미 정부로부터 안전성과 유효성을 인정받고 문제 없이 판매 중인데도 단지 약가유지를 위해 또 다시 적잖은 비용을 들여 생동성시험을 진행하는 것은 소모적이라는 이유에서다. 생동성비용 1건당 많게는 5억원 이상의 비용이 소요되는 것으로 전해졌다. 제약사마다 많게는 수십억원을 기허가 제네릭의 생동성 비용으로 투입한 셈이다.이미 제약사들은 제네릭 약가재평가에 따른 약가인하로 적잖은 손실이 현실화했다. 지난 2023년 9월 1차 제네릭 약가재평가 결과 총 7355개 품목의 약가가 최대 28.6% 인하됐다.당시 약가인하로 총 179개 업체가 손실이 예고됐다. 한국휴텍스제약은 약가인하 품목 수가 153개로 가장 많았다. 하나제약과 대웅비아오가 긱각 122개, 115개로 뒤를 이었다. 이든파마와 일화가 각각 104개, 101개 품목이 약가인하 대상에 올랐다. 마더스제약, 셀트리온제약, 이연제약, 한국글로벌제약, 삼성제약, 메디카코리아, 보령바이오파마, 대한뉴팜, 동국제약, 아주약품, 제일약품, 한국유니온제약, 건일바이오팜, 동구바이오제약 등이 80개 이상 제품이 제네릭 약가재평가 결과 약가가 인하됐다.제네릭 약가재평가가 위탁 방식 허가 제네릭을 겨냥하면서 위탁 제네릭 비중이 높은 중소·중견제약사들이 타격이 컸다.제네릭 약가재평가가 진행되는 기간 중소·중견제약사들의 생동성시험 시도가 많았다. 2020년부터 2022까지 3년 동안 휴온스가 가장 많은 38건의 생동성시험계획을 승인받았다. 한국휴텍스제약, 한국프라임제약, 동구바이오제약, 알리코제약 등은 이 기간 동안 30건 이상의 생동성시험 계획을 승인받았다.중소·중견제약사들이 전 제조 위탁 방식으로 허가받은 제네릭의 약가유지 목적으로 생동성시험에 동시다발로 착수했고 비용 지출에 따른 수익성 악화가 불가피했다는 진단이 나온다.반면 최근에는 대형제약사와 중소제약사들이 고르게 생동성시험을 진행한 것으로 나타났다.지난해 업체별 생동성시험 계획 승인 건수를 보면 보령이 10건으로 가장 많았고 한국프라임제약이 9건을 나타냈다. 휴온스와 위더스제약이 각각 7건과 6건으로 뒤를 이었고 비보존제약, 알보젠코리아, 넥스팜코리아, 종근당, 동화약품 등이 5건을 나타냈다. 제네릭 약가재평가 종료로 중소·중견제약사들의 생동성시험 집중 현상이 희석됐다는 분석이다.2025-01-13 06:20:35천승현
생동성시험 3년새 60%↓...제네릭 약가 재평가 그림자[데일리팜=천승현 기자] 지난해 제네릭 개발을 위한 생물학적동등성시험 건수가 크게 줄었다. 지난 2018년 이후 6년 만에 최소 건수를 나타냈다. 생동성시험 승인 건수는 2021년 이후 3년 연속 감소하며 3년새 60% 이상 줄었다. 2020년부터 진행한 제네릭 약가재평가가 종료되면서 약가유지를 위한 생동성시험 수행이 급감했다. 약가유지를 위한 생동성시험 수행으로 불필요한 비용을 지출하는 기현상이 정상화했다는 평가다.14일 식품의약품안전처에 따르면 지난해 생동성시험 계획 승인 건수는 총 197건으로 전년대비 14.0% 줄었다. 생동성시험 계획 승인 건수는 2021년 505건을 기록한 이후 3년 연속 감소세를 나타냈다. 지난해 생동성시험 시도 건수는 3년 전과 비교하면 61.0% 줄었다.연도별 생물학적동등성시험 계획 승인건수(단위: 개, 자료: 식품의약품안전처) 정부의 제네릭 약가재평가가 종료되면서 생동성시험 건수가 감소한 것으로 분석된다.지난 2020년 6월 보건복지부는 최고가 요건을 갖추지 못한 제네릭은 2023년 2월28일까지 ‘생동성시험 수행’과 ‘등록 원료의약품 사용’ 자료를 제출하면 종전 약가를 유지해주는 내용의 약제 상한금액 재평가 계획 공고를 냈다.제네릭 약가재평가는 2020년 7월부터 시행된 새 약가제도를 기등재 제네릭에 적용하기 위한 정책이다. 개편 약가제도에서 제네릭 제품은 생동성시험 직접 수행과 등록 원료의약품 사용 요건을 모두 충족해야만 최고가를 받을 수 있다.제약사들은 약가인하를 회피하기 위해 기허가 제네릭 제품에 대해서도 생동성시험에 착수했다. 제제 연구를 통해 제네릭을 만들어 생동성시험을 진행하고 동등 결과를 얻어내면 변경 허가를 통해 약가인하를 회피하는 전략이다. 이때 위탁제조를 자사 제조로 전환하면서 허가변경을 통해 ‘생동성시험 실시’ 요건을 충족하고 약가인하를 모면하는 방식이다.제약사들의 생동성시험 계획 승인 건수는 2019년 259건을 기록했는데 제네릭 약가재평가가 공고된 2020년에는 323건으로 24.7% 늘었다. 2021년에는 505건으로 2년만에 2배 가량 증가했다. 지난해 생동성시험 계획 승인 건수는 2018년 이후 6년 만에 가장 낮은 수치다.제네릭 약가재평가 자료 제출기한이 만료되면서 기허가 제품의 생동성시험을 진행하는 기현상이 사라졌다는 평가가 나온다. 제약사들은 기허가 제네릭의 생동성시험 수행에 대해 “불필요한 비용 낭비”라는 불만을 쏟아냈다. 이미 정부로부터 안전성과 유효성을 인정받고 문제 없이 판매 중인데도 단지 약가유지를 위해 또 다시 적잖은 비용을 들여 생동성시험을 진행하는 것은 소모적이라는 이유에서다. 생동성비용 1건당 많게는 5억원 이상의 비용이 소요되는 것으로 전해졌다. 제약사마다 많게는 수십억원을 기허가 제네릭의 생동성 비용으로 투입한 셈이다.이미 제약사들은 제네릭 약가재평가에 따른 약가인하로 적잖은 손실이 현실화했다. 지난 2023년 9월 1차 제네릭 약가재평가 결과 총 7355개 품목의 약가가 최대 28.6% 인하됐다.당시 약가인하로 총 179개 업체가 손실이 예고됐다. 한국휴텍스제약은 약가인하 품목 수가 153개로 가장 많았다. 하나제약과 대웅비아오가 긱각 122개, 115개로 뒤를 이었다. 이든파마와 일화가 각각 104개, 101개 품목이 약가인하 대상에 올랐다. 마더스제약, 셀트리온제약, 이연제약, 한국글로벌제약, 삼성제약, 메디카코리아, 보령바이오파마, 대한뉴팜, 동국제약, 아주약품, 제일약품, 한국유니온제약, 건일바이오팜, 동구바이오제약 등이 80개 이상 제품이 제네릭 약가재평가 결과 약가가 인하됐다.제네릭 약가재평가가 위탁 방식 허가 제네릭을 겨냥하면서 위탁 제네릭 비중이 높은 중소·중견제약사들이 타격이 컸다.제네릭 약가재평가가 진행되는 기간 중소·중견제약사들의 생동성시험 시도가 많았다. 2020년부터 2022까지 3년 동안 휴온스가 가장 많은 38건의 생동성시험계획을 승인받았다. 한국휴텍스제약, 한국프라임제약, 동구바이오제약, 알리코제약 등은 이 기간 동안 30건 이상의 생동성시험 계획을 승인받았다.중소·중견제약사들이 전 제조 위탁 방식으로 허가받은 제네릭의 약가유지 목적으로 생동성시험에 동시다발로 착수했고 비용 지출에 따른 수익성 악화가 불가피했다는 진단이 나온다.반면 최근에는 대형제약사와 중소제약사들이 고르게 생동성시험을 진행한 것으로 나타났다.지난해 업체별 생동성시험 계획 승인 건수를 보면 보령이 10건으로 가장 많았고 한국프라임제약이 9건을 나타냈다. 휴온스와 위더스제약이 각각 7건과 6건으로 뒤를 이었고 비보존제약, 알보젠코리아, 넥스팜코리아, 종근당, 동화약품 등이 5건을 나타냈다. 제네릭 약가재평가 종료로 중소·중견제약사들의 생동성시험 집중 현상이 희석됐다는 분석이다.2025-01-13 06:20:35천승현 -
 건기식 파죽지세 성장...일반약은 10년새 968품목 줄어[데일리팜=천승현 기자] 건강기능식품과 일반의약품 시장에 진출하는 품목 수 격차가 크게 벌어졌다. 일반의약품 품목 수가 10년간 1000개 가량 줄어드는 동안 건강기능식품은 2만개 이상 확대됐다. 일반의약품과 건강기능식품 시장 규모도 벌어지는 추세다.10일 식품의약품안전처의 ‘2024년 식품의약품통계연보’에 따르면 지난 2023년 일반의약품 품목 수는 4873개로 집계됐다. 2022년 4884개에서 11개 감소했다. 일반의약품 품목 수는 지속적으로 감소세다. 지난 2013년 5841개에서 10년 동안 968개 줄었다. 국내 일반의약품 시장에서 신규 진출 제품보다 철수한 제품이 훨씬 많았다는 얘기다. 의약품 시장은 지속적으로 품목 허가 갱신과 같은 안전관리 제도로 많은 제품이 사라진다. 의약품 품목 갱신제는 보건당국서 허가 받은 의약품은 5년 마다 효능·안전성을 재입증해야 허가가 유지되는 내용이 핵심이다. 상당수 제품은 유효기간 만료시 시장성이 떨어진다고 판단되면 갱신을 포기하고 시장에서 철수하기도 한다.지난 2023년 전문의약품 품목 수는 1만6633개로 10년 전 1만781개보다 5852개 증가했다. 같은 의약품인데도 일반의약품 품목 수 감소세가 두드러졌다는 얘기다. 전문의약품 시장에는 새로운 효능을 내세운 신약 제품이 지속적으로 등장하지만 새롭게 일반의약품 시장을 두드리는 제품은 많지 않아 전체 품목 수도 감소세가 이어진다는 분석이다. 이에 반해 건강기능식품 품목 수는 급증세가 이어졌다.지난 2023년 건강기능식품 제조품목 수는 3만7273개로 2013년 1만4281개보다 2배 이상 늘었다. 지난 10년간 건강기능식품 생산 제품이 2만2993개 증가했다. 건강기능식품 시장에 연 평균 2000개 이상의 신제품이 쏟아졌다는 의미다.지난 2023년 건강기능식품 생산 품목 수는 일반의약품보다 7.6배 많았다. 지난 2013년 건강기능식품과 일반의약품 품목 수는 각각 1만4281개와 5841개로 2.4배 격차를 보였는데 10년 동안 큰 폭으로 확대됐다.최근에는 건강기능식품 시장이 매년 급성장세를 나타내며 일반약 시장을 잠식하고 있다는 분석도 나온다.지난 2023년 건강기능식품 시장은 4조919억원으로 전년보다 1.9% 감소했다. 하지만 2013년 1조4820억원과 비교하면 10년새 2.7배 확대됐다.지난 2003년 건강기능식품에 관한 법률이 제정되면서 본격적으로 건강기능식품 제도가 시행됐다. 건강기능식품의 안전성 확보 및 품질 향상과 건전한 유통·판매를 도모함으로써 국민의 건강 증진과 소비자 보호에 기여하겠다는 게 건강기능식품법의 도입 취지다. 국내 건강기능식품 시장은 2010년 처음으로 1조원을 넘어섰고 2016년에는 2조원을 돌파했다. 건강기능식품 시장 규모는 2020년 3조원대로 성장했고 2021년부터 4조원 이상을 형성하고 있다. 업계에서는 식품업체와 제약기업들이 건강기능식품 시장을 적극적으로 두드리면서 빠른 속도로 건강기능식품이 일반약 시장을 대체한 것으로 분석한다. 비타민과 같이 건강 보조역할을 하는 영역은 일반약보다 건강기능식품에 대한 선호도가 높아졌을 가능성이 제기된다.일반의약품 생산액은 2013년 2조3717억원에서 2023년 3조8554억원으로 10년 동안 62.6% 증가하는데 그쳤다. 같은 기간 전문의약품 생산액은 11조7608억원에서 23조153억원으로 95.7% 증가했다.최근 일반의약품 생산액이 반짝 회복세를 나타냈다. 일반의약품 생산액은 2021년 3조692억원에서 2023년 3조8554억원으로 2년간 25.6% 늘었다. 코로나19 팬데믹과 엔데믹을 거치면서 독감이나 감기환자가 급증하면서 일반약 시장도 반짝 호황을 나타낸 것으로 분석된다.일반의약품의 반짝 성장세에도 건강기능식품 시장에는 못 미쳤다. 지난 2013년 일반의약품 생산규모는 2조3717억원으로 건강기능식품 시장 규모 1조4090억원을 8897억원 앞섰다. 하지만 지난 2020년 건강기능식품 시장이 3조3254억원으로 일반의약품 생산액 3조1779억원을 1475억원 차이로 추월했고 2021년에는 격차가 9629억원으로 벌어졌다. 다만 지난 2년간 일반의약품 시장 성장으로 2023년 건강기능식품 시장과의 격차는 2437억원으로 좁혀졌다.2025-01-10 12:00:25천승현
건기식 파죽지세 성장...일반약은 10년새 968품목 줄어[데일리팜=천승현 기자] 건강기능식품과 일반의약품 시장에 진출하는 품목 수 격차가 크게 벌어졌다. 일반의약품 품목 수가 10년간 1000개 가량 줄어드는 동안 건강기능식품은 2만개 이상 확대됐다. 일반의약품과 건강기능식품 시장 규모도 벌어지는 추세다.10일 식품의약품안전처의 ‘2024년 식품의약품통계연보’에 따르면 지난 2023년 일반의약품 품목 수는 4873개로 집계됐다. 2022년 4884개에서 11개 감소했다. 일반의약품 품목 수는 지속적으로 감소세다. 지난 2013년 5841개에서 10년 동안 968개 줄었다. 국내 일반의약품 시장에서 신규 진출 제품보다 철수한 제품이 훨씬 많았다는 얘기다. 의약품 시장은 지속적으로 품목 허가 갱신과 같은 안전관리 제도로 많은 제품이 사라진다. 의약품 품목 갱신제는 보건당국서 허가 받은 의약품은 5년 마다 효능·안전성을 재입증해야 허가가 유지되는 내용이 핵심이다. 상당수 제품은 유효기간 만료시 시장성이 떨어진다고 판단되면 갱신을 포기하고 시장에서 철수하기도 한다.지난 2023년 전문의약품 품목 수는 1만6633개로 10년 전 1만781개보다 5852개 증가했다. 같은 의약품인데도 일반의약품 품목 수 감소세가 두드러졌다는 얘기다. 전문의약품 시장에는 새로운 효능을 내세운 신약 제품이 지속적으로 등장하지만 새롭게 일반의약품 시장을 두드리는 제품은 많지 않아 전체 품목 수도 감소세가 이어진다는 분석이다. 이에 반해 건강기능식품 품목 수는 급증세가 이어졌다.지난 2023년 건강기능식품 제조품목 수는 3만7273개로 2013년 1만4281개보다 2배 이상 늘었다. 지난 10년간 건강기능식품 생산 제품이 2만2993개 증가했다. 건강기능식품 시장에 연 평균 2000개 이상의 신제품이 쏟아졌다는 의미다.지난 2023년 건강기능식품 생산 품목 수는 일반의약품보다 7.6배 많았다. 지난 2013년 건강기능식품과 일반의약품 품목 수는 각각 1만4281개와 5841개로 2.4배 격차를 보였는데 10년 동안 큰 폭으로 확대됐다.최근에는 건강기능식품 시장이 매년 급성장세를 나타내며 일반약 시장을 잠식하고 있다는 분석도 나온다.지난 2023년 건강기능식품 시장은 4조919억원으로 전년보다 1.9% 감소했다. 하지만 2013년 1조4820억원과 비교하면 10년새 2.7배 확대됐다.지난 2003년 건강기능식품에 관한 법률이 제정되면서 본격적으로 건강기능식품 제도가 시행됐다. 건강기능식품의 안전성 확보 및 품질 향상과 건전한 유통·판매를 도모함으로써 국민의 건강 증진과 소비자 보호에 기여하겠다는 게 건강기능식품법의 도입 취지다. 국내 건강기능식품 시장은 2010년 처음으로 1조원을 넘어섰고 2016년에는 2조원을 돌파했다. 건강기능식품 시장 규모는 2020년 3조원대로 성장했고 2021년부터 4조원 이상을 형성하고 있다. 업계에서는 식품업체와 제약기업들이 건강기능식품 시장을 적극적으로 두드리면서 빠른 속도로 건강기능식품이 일반약 시장을 대체한 것으로 분석한다. 비타민과 같이 건강 보조역할을 하는 영역은 일반약보다 건강기능식품에 대한 선호도가 높아졌을 가능성이 제기된다.일반의약품 생산액은 2013년 2조3717억원에서 2023년 3조8554억원으로 10년 동안 62.6% 증가하는데 그쳤다. 같은 기간 전문의약품 생산액은 11조7608억원에서 23조153억원으로 95.7% 증가했다.최근 일반의약품 생산액이 반짝 회복세를 나타냈다. 일반의약품 생산액은 2021년 3조692억원에서 2023년 3조8554억원으로 2년간 25.6% 늘었다. 코로나19 팬데믹과 엔데믹을 거치면서 독감이나 감기환자가 급증하면서 일반약 시장도 반짝 호황을 나타낸 것으로 분석된다.일반의약품의 반짝 성장세에도 건강기능식품 시장에는 못 미쳤다. 지난 2013년 일반의약품 생산규모는 2조3717억원으로 건강기능식품 시장 규모 1조4090억원을 8897억원 앞섰다. 하지만 지난 2020년 건강기능식품 시장이 3조3254억원으로 일반의약품 생산액 3조1779억원을 1475억원 차이로 추월했고 2021년에는 격차가 9629억원으로 벌어졌다. 다만 지난 2년간 일반의약품 시장 성장으로 2023년 건강기능식품 시장과의 격차는 2437억원으로 좁혀졌다.2025-01-10 12:00:25천승현 -
 위기의 제약사들, 행정처분에 존폐 위협...법정다툼 사활[데일리팜=천승현 기자] 올해 제약업계에서는 정부 행정처분에 맞서 진행 중인 행정소송의 결과가 대거 윤곽을 드러낼 전망이다. 제조·품질관리기준(GMP) 적합 판정 취소 처분에 대한 행정소송이 줄줄이 1심 판결이 예고됐다. 뇌기능개선제 콜린알포세레이트(콜린제제)의 급여 축소와 환수협상 명령을 두고 진행된 소송도 연내 결론이 도출될 가능성이 크다. 보툴리눔독소제제 업체들의 허가취소 행정소송도 속도를 낼 것으로 예상된다. 행정소송 결과에 따라 제약사들에 치명적인 손실로 이어질 수 있어 올해 사업의 중요한 변수로 작용할 전망이다.GMP 적합판정 취소 행정소송 선고 예고...제약사 패소시 치명적 손실 불가피10일 업계에 따르면 수원지방법원 제3행정부는 오는 16일 한국휴텍스제약이 제기한 의약품 제조 및 품질관리기준 적합판정 취소처분 취소소송을 선고한다. GMP 적합판정 취소 처분에 대한 행정소송 첫 판결이다.2022년 12월부터 GMP 적합판정을 거짓·부정하게 받거나 반복적으로 의약품 제조·품질관리에 관한 기록을 거짓으로 작성해 판매한 사실이 적발된 경우 GMP 적합판정을 취소하는 일명 'GMP 원스트라이크 아웃'이 도입됐다.식품의약품안전처는 2023년 7월 휴텍스제약이 6개 제품을 제조하는 과정에서 첨가제를 임의로 증량하거나 감량해 허가 사항과 다르게 제조하고, 제조기록서에는 허가사항과 동일하게 제조하는 것처럼 거짓 작성하는 등의 위반 사실을 확인하고 제조·판매중지를 명령했다.식약처는 2023년 12월 휴텍스제약에 해당 처분을 사전통지했고 청문회를 거쳐 최종적으로 처분 방침을 결정했다. ‘GMP 원스트라이크 아웃’ 처분의 첫 시행 사례다. 휴텍스제약은 처분이 내려지자 지난해 1월 처분 취소 행정소송을 제기했고 1년 만에 선고가 임박했다.한국신텍스제약과 동구바이오제약도 GMP 적합판정 취소를 두고 법정 다툼을 벌이고 있다.식약처는 2023년 11월 신텍스제약이 제조·판매하는 의약품 6개 품목에 대해 잠정 제조·판매 중지와 회수 조치를 내렸다. 온장환, 신텍스연년익수불로단, 신텍스청신환, 위력환, 신텍스청기환, 영수환 등이 처분 대상이다. 신텍스제약의 특별기획 점검 실시 결과 해당 6개 제품을 제조하는 과정에서 변경 신고를 하지 않고 첨가제 등을 임의로 변경해 제조하거나 제조기록서를 거짓으로 작성하는 등 약사법 위반사항이 확인됐다고 식약처는 설명했다.식약처는 작년 4월 신텍스제약의 내용고형제 제조시설에 대해 GMP 적합판정 취소 처분을 확정했다. 이에 한국신텍스제약은 행정처분 취소소송과 집행정지를 청구했다. 집행정지 청구가 인용되면서 처분은 시행되지 않았다. 당초 지난해 11월 본안소송 1심 선고가 예고됐지만 오는 2월로 연기된 상태다.식약처는 지난해 8월 동구바이오제약의 내용고형제 제조시설에 대해 GMP 적합 판정 취소 처분을 통보했다. 작년 2월 식약처가 동구바이오제약의 GMP 위반 행위를 적발한 데 이어 후속절차를 거쳐 처분 수위가 결정됐다.동구바이오제약은 처분 통지 직후 행정소송을 제기했고 올해 본격적인 법정다툼이 진행될 전망이다. 지난해 9월 동구바이오제약이 청구한 내용고형제 제조시설 GMP 적합판정 취소 처분의 집행정지가 인용됐고. 처분을 내린 경인식약청이 항고하지 않아 집행정지는 확정됐다. GMP 적합판정 취소 처분은 제약사들에 치명적인 손실을 일으킬 수 있다는 이유로 제약사들이 체감하는 위협은 크다.휴텍스제약은 행정처분이 한 달 가량 효력이 발생하면서 막대한 손실이 현실화했다. 식약처는 휴텍스제약의 GMP 적합판정 취소 처분을 지난해 2월부터 시행하기로 공고했다. 휴텍스제약은 행정처분 시행 중단을 위한 집행정지를 청구했는데 재판부의 판결이 지연되면서 작년 2월 1일 처분 효력이 발생했다. 지난해 2월 7일 수원지방법원은 휴텍스제약의 집행정지 청구를 기각하면서 GMP 적합판정 취소 처분의 효력이 유지됐다. 휴텍스제약은 항고했고 작년 3월 4일 2심 재판부의 인용 판결로 해당 처분의 시행이 보류됐다.휴텍스제약은 2월 1일부터 지난 3월 4일까지 33일 동안 GMP 적합판정 취소 처분 효력이 발생하면서 처방실적 공백이 발생했다.의약품 조사기관 유비스트에 따르면 지난해 3분기 휴텍스제약의 외래 처방금액은 306억원으로 전년동기대비 56.9% 감소했다. 작년 3분기 누적 처방액은 1068억원으로 작년 같은 기간보다 53.4% 축소됐다.휴텍스제약은 처분 시행 기간 동안 직접 생산 뿐만 아니라 다른 업체에 위탁하는 방식의 의약품 제조도 금지됐다. 의약품 제조업자는 1개 이상의 제형군에 대한 GMP 적합판정서가 있는 경우 위탁제조를 할 수 있다. 휴텍스제약은 처분이 결정됐을 때 GMP 적합판정을 받은 제형군은 내용고형제 1개 뿐이다. 당시 보유 중인 제조시설 1개의 GMP 적합판정이 취소되면서 위탁제조의 자격도 상실됐다.동구바이오제약은 내용고형제 제조시설에 대해 GMP 적합판정 처분이 예고됐다. 동구바이오제약은 향남 공장에 내용고형제, 외용액제, 내용액제, 연고제 등 4개의 제조시설을 보유하고 있다. 동구바이오제약은 내용고형제 제조시설 행정처분만으로 영업정지금액을 1430억원으로 추산했다. 만약 행정소송 패소로 GMP 적합판정 취소 처분이 시행되면 연간 1430억원의 손실이 발생한다는 의미다. 전체 매출액 2149억원의 66.6%에 해당하는 규모다.콜린제제, 급여축소 취소소송 대법원 선고 예고...환수협상 명령 행정소송 결론 임박콜린제제와 급여 축소와 환수협상 명령을 둘러싼 행정소송도 올해 결론날 가능성이 크다.보건복지부는 2020년 8월 콜린제제의 새로운 급여 기준 내용을 담은 ‘요양급여의 적용기준 및 방법에 관한 세부사항’ 일부 개정고시를 발령했다. 치매 진단을 받지 않은 환자가 콜린제제를 사용할 경우 약값 부담률을 30%에서 80%로 올리는 내용이다.제약사들은 콜린제제 급여 축소의 부당함을 따지는 취소 소송을 제기했다. 소송은 법률 대리인에 따라 2건으로 나눠서 제기됐다. 법무법인 세종이 종근당 등 39개사와 개인 8명을 대리해 소송을 제기했고 법무법인 광장은 대웅바이오 등 39개사와 1명의 소송을 맡았다.종근당 그룹은 지난 2022년 7월 패소 판결을 받았다. 제약사들은 정부의 콜린제제 급여축소 절차가 부적절하고 임상적 유용성도 입증받았다고 주장했지만 재판부는 모두 받아들이지 않았다. 종근당 그룹이 제기한 항소심에서도 지난해 5월 기각 판결이 내려졌다. 현재 대법원에서 사건 심리가 진행 중이다.대웅바이오 그룹은 지난 2022년 11월 패소 판결을 받았고 현재 2심이 진행 중이다. 다만 제약사들이 청구한 급여축소 집행정지 청구는 모두 승소해 선별급여 시행은 중단된 상태다. 콜린제제 환수협상 명령을 둘러싼 행정소송은 1차명령과 2차명령으로 구분된다.2020년 12월 복지부는 국민건강보험공단에 콜린제제를 보유한 업체들에 '임상시험에 실패할 경우 처방액을 반환하라‘는 내용의 요양급여계약을 명령했다.복지부의 환수협상 명령 이후 제약사들은 일제히 행정소송을 제기했다. 소송은 2개 그룹으로 나눠 제기됐다. 법무법인 광장은 대웅바이오 등 28개사의 소송을 대리했고 법무법인 세종이 종근당 등 28개사의 소송을 맡았다. 환수협상 명령의 행정소송에서는 2개 그룹 모두 지난 2022년 1심에서 각하 판결이 나왔다. 종근당 그룹은 지난해 5월 항소심에서 기각 판결을 받았고 대법원도 심리불속행 기각 결정을 내렸다. 대웅바이오 그룹은 1심 패소 이후 항소하지 않았다.제약사들이 환수협상을 거부하자 복지부는 2021년 6월 2차 협상 명령을 내렸다. 이에 종근당 등 26개사와 대웅바이오 등 27개사로 나눠 취소소송을 제기했다. 지난해 3월 종근당 등이 제기한 환수협상 2차명령 취소 소송에서 각하 판결을 내렸고 현재 2심 재판이 진행 중이다. 대웅바이오 그룹은 27곳 중 씨엠지제약과 환인제약을 제외한 25곳이 이탈한 가운데 2022년 2월 각하 판결이 나왔고 항소심은 제기되지 않았다.제약사들은 콜린제제의 행정소송에 사활을 걸 수 밖에 없는 처지다. 임상재평가 실패 이후 환수가 현실화하면 막대한 손실이 불가피하다.제약사들은 콜린제제의 재평가 임상 실패로 최종적으로 적응증이 삭제될 경우 임상시험 계획서를 승인받은 날부터 삭제일까지 처방액의 20%를 건보공단에 돌려주겠다고 합의했다. 만약 콜린제제 임상시험 계획 승인 이후 5년간 진행한 임상시험이 실패할 경우 5년간 처방액의 20%를 환수해야 한다는 의미다.지난 2023년 콜린제제의 외래 처방시장 규모는 6226억원으로 집계됐다. 작년 3분기까지 처방액은 4566억원에 달했다. 제약사들이 임상실패시 청구되는 환수금액은 수천억원 규모로 추산된다.국내 생산 보툴리눔제제 57% 허가 취소 위기...대법원 선고 임박보툴리눔독소제제 기업들도 시장 퇴출을 모면하기 위한 행정소송이 결론을 앞두고 있다.국내 제약바이오기업 7곳의 보툴리눔독소제제 16개 품목이 허가취소 처분이 예고됐다. 메디톡스, 휴젤, 파마리서치바이오, 제테마, 한국비엠아이, 한국비엔씨, 휴온스바이오파마 등 7개 업체가 보툴리눔독소제제의 허가취소 처분 등이 예고됐다. 메디톡스는 총 3건의 허가취소 처분에 대한 행정소송을 진행 중이다.2020년 10월 식약처는 국가출하승인을 받지 않고 판매한 메디톡신주 50・100・150・200단위, 코어톡스주에 대해 약사법 위반으로 품목 허가취소 행정처분 절차에 착수했다.식약처는 2020년 12월 이노톡스에 대해 잠정 제조·판매·사용 중지와 허가 취소 등 처분 절차에 착수했다. 국민권익위원회에 공익신고로 제보된 허가제출서류 조작 의혹에 대해 검찰의 수사 결과에 따른 후속조치다. 검찰은 메디톡스가 이노톡스의 품목허가와 변경허가를 하는 과정에서 안정성 시험 자료를 위조했다는 이유로 공무집행방해로 기소했다. 식약처는 메디톡스가 ‘거짓이나 그 밖의 부정한 방법으로 품목허가와 변경허가를 받은 경우’에 해당한다고 판단해 품목 허가취소 절차에 착수했다.메디톡신 50・100・150・200단위, 코어톡스 등의 간접수출 위반 사건은 메디톡스가 1심과 2심에서 승소한 상태다. 메디톡스는 메디톡신의 성분 변경 처분에 대해 원액은 바뀌지 않았다는 이유로 처분이 부당하다는 행정소송을 제기했다. 메디톡스는 2023년 11월 1심에서 승소했고 지난해 9월 2심에서도 승소 판결을 받았다. 현재 대법원 심리가 진행 중이다. 메디톡스가 청구한 이노톡스 행정처분 취소소송은 현재 1심 재판이 진행 중이다.2021년 11월 식약처는 국가출하승인을 받지 않고 판매했다는 혐의로 휴젤의 보툴렉스, 보툴렉스50단위, 보툴렉스150단위, 보툴렉스200단위 등 4종과 파마리서치바이오의 리엔톡스100단위와 리엔톡스200단위 등에 대해 품목허가 취소 등 행정처분과 회수·폐기 절차에 착수했다. 2022년 12월 제테마의 제테마더톡신100단위, 한국비엠아이의 하이톡스100단위, 한국비엔씨의 비에녹스주 등 3개사의 3개 제품이 품목허가 취소가 통지됐다. 지난해 7월 휴온스바이오파마의 리즈톡스주100단위에 대해 허가 취소 처분이 예고됐다.파마리서치바이오는 2023년 12월 식약처를 상대로 제기한 처분 취소소송에서 승소 판결을 받았다. 휴젤은 지난해 2월 서울행정법원으로부터 1심 승소 판결을 선고받았다. 휴젤의 행정소송 사건에서 재판부는 “의약품 자체를 판매할 수 없는 품목허가 취소 처분은 지나치게 가혹하다”라면서 재량권 일탈 남용에 해당한다고 판단했다. 재판부는 “위반행위의 동기와 경위, 비난가능성, 국민보건상 위해 발생 정도 등과 관련해 참작할만한 사정이 있음에도 불구하고 관련 규정이 정한 기준을 기계적으로 적용해 처분한 것으로 보인다”라고 결론내렸다.지난 2023년 국내 제약바이오기업들이 생산한 보툴리눔독소제제 생산실적은 총 5761억원으로 집계됐다. 이중 허가 취소가 예고된 보툴리눔독소제제 16개 제품의 생산실적은 총 3284억원으로 전체 생산액의 57.0%에 해당한다. 국내 생산 보툴리눔독소제제 절반 이상이 퇴출 위기에 놓인 셈이다. 만약 최종적으로 행정처분 예고 제품들이 허가가 취소된다면 국내에선 유례없는 보툴리눔독소제제 수급난이 발생할 수 있다는 우려가 나온다.2025-01-10 06:20:28천승현
위기의 제약사들, 행정처분에 존폐 위협...법정다툼 사활[데일리팜=천승현 기자] 올해 제약업계에서는 정부 행정처분에 맞서 진행 중인 행정소송의 결과가 대거 윤곽을 드러낼 전망이다. 제조·품질관리기준(GMP) 적합 판정 취소 처분에 대한 행정소송이 줄줄이 1심 판결이 예고됐다. 뇌기능개선제 콜린알포세레이트(콜린제제)의 급여 축소와 환수협상 명령을 두고 진행된 소송도 연내 결론이 도출될 가능성이 크다. 보툴리눔독소제제 업체들의 허가취소 행정소송도 속도를 낼 것으로 예상된다. 행정소송 결과에 따라 제약사들에 치명적인 손실로 이어질 수 있어 올해 사업의 중요한 변수로 작용할 전망이다.GMP 적합판정 취소 행정소송 선고 예고...제약사 패소시 치명적 손실 불가피10일 업계에 따르면 수원지방법원 제3행정부는 오는 16일 한국휴텍스제약이 제기한 의약품 제조 및 품질관리기준 적합판정 취소처분 취소소송을 선고한다. GMP 적합판정 취소 처분에 대한 행정소송 첫 판결이다.2022년 12월부터 GMP 적합판정을 거짓·부정하게 받거나 반복적으로 의약품 제조·품질관리에 관한 기록을 거짓으로 작성해 판매한 사실이 적발된 경우 GMP 적합판정을 취소하는 일명 'GMP 원스트라이크 아웃'이 도입됐다.식품의약품안전처는 2023년 7월 휴텍스제약이 6개 제품을 제조하는 과정에서 첨가제를 임의로 증량하거나 감량해 허가 사항과 다르게 제조하고, 제조기록서에는 허가사항과 동일하게 제조하는 것처럼 거짓 작성하는 등의 위반 사실을 확인하고 제조·판매중지를 명령했다.식약처는 2023년 12월 휴텍스제약에 해당 처분을 사전통지했고 청문회를 거쳐 최종적으로 처분 방침을 결정했다. ‘GMP 원스트라이크 아웃’ 처분의 첫 시행 사례다. 휴텍스제약은 처분이 내려지자 지난해 1월 처분 취소 행정소송을 제기했고 1년 만에 선고가 임박했다.한국신텍스제약과 동구바이오제약도 GMP 적합판정 취소를 두고 법정 다툼을 벌이고 있다.식약처는 2023년 11월 신텍스제약이 제조·판매하는 의약품 6개 품목에 대해 잠정 제조·판매 중지와 회수 조치를 내렸다. 온장환, 신텍스연년익수불로단, 신텍스청신환, 위력환, 신텍스청기환, 영수환 등이 처분 대상이다. 신텍스제약의 특별기획 점검 실시 결과 해당 6개 제품을 제조하는 과정에서 변경 신고를 하지 않고 첨가제 등을 임의로 변경해 제조하거나 제조기록서를 거짓으로 작성하는 등 약사법 위반사항이 확인됐다고 식약처는 설명했다.식약처는 작년 4월 신텍스제약의 내용고형제 제조시설에 대해 GMP 적합판정 취소 처분을 확정했다. 이에 한국신텍스제약은 행정처분 취소소송과 집행정지를 청구했다. 집행정지 청구가 인용되면서 처분은 시행되지 않았다. 당초 지난해 11월 본안소송 1심 선고가 예고됐지만 오는 2월로 연기된 상태다.식약처는 지난해 8월 동구바이오제약의 내용고형제 제조시설에 대해 GMP 적합 판정 취소 처분을 통보했다. 작년 2월 식약처가 동구바이오제약의 GMP 위반 행위를 적발한 데 이어 후속절차를 거쳐 처분 수위가 결정됐다.동구바이오제약은 처분 통지 직후 행정소송을 제기했고 올해 본격적인 법정다툼이 진행될 전망이다. 지난해 9월 동구바이오제약이 청구한 내용고형제 제조시설 GMP 적합판정 취소 처분의 집행정지가 인용됐고. 처분을 내린 경인식약청이 항고하지 않아 집행정지는 확정됐다. GMP 적합판정 취소 처분은 제약사들에 치명적인 손실을 일으킬 수 있다는 이유로 제약사들이 체감하는 위협은 크다.휴텍스제약은 행정처분이 한 달 가량 효력이 발생하면서 막대한 손실이 현실화했다. 식약처는 휴텍스제약의 GMP 적합판정 취소 처분을 지난해 2월부터 시행하기로 공고했다. 휴텍스제약은 행정처분 시행 중단을 위한 집행정지를 청구했는데 재판부의 판결이 지연되면서 작년 2월 1일 처분 효력이 발생했다. 지난해 2월 7일 수원지방법원은 휴텍스제약의 집행정지 청구를 기각하면서 GMP 적합판정 취소 처분의 효력이 유지됐다. 휴텍스제약은 항고했고 작년 3월 4일 2심 재판부의 인용 판결로 해당 처분의 시행이 보류됐다.휴텍스제약은 2월 1일부터 지난 3월 4일까지 33일 동안 GMP 적합판정 취소 처분 효력이 발생하면서 처방실적 공백이 발생했다.의약품 조사기관 유비스트에 따르면 지난해 3분기 휴텍스제약의 외래 처방금액은 306억원으로 전년동기대비 56.9% 감소했다. 작년 3분기 누적 처방액은 1068억원으로 작년 같은 기간보다 53.4% 축소됐다.휴텍스제약은 처분 시행 기간 동안 직접 생산 뿐만 아니라 다른 업체에 위탁하는 방식의 의약품 제조도 금지됐다. 의약품 제조업자는 1개 이상의 제형군에 대한 GMP 적합판정서가 있는 경우 위탁제조를 할 수 있다. 휴텍스제약은 처분이 결정됐을 때 GMP 적합판정을 받은 제형군은 내용고형제 1개 뿐이다. 당시 보유 중인 제조시설 1개의 GMP 적합판정이 취소되면서 위탁제조의 자격도 상실됐다.동구바이오제약은 내용고형제 제조시설에 대해 GMP 적합판정 처분이 예고됐다. 동구바이오제약은 향남 공장에 내용고형제, 외용액제, 내용액제, 연고제 등 4개의 제조시설을 보유하고 있다. 동구바이오제약은 내용고형제 제조시설 행정처분만으로 영업정지금액을 1430억원으로 추산했다. 만약 행정소송 패소로 GMP 적합판정 취소 처분이 시행되면 연간 1430억원의 손실이 발생한다는 의미다. 전체 매출액 2149억원의 66.6%에 해당하는 규모다.콜린제제, 급여축소 취소소송 대법원 선고 예고...환수협상 명령 행정소송 결론 임박콜린제제와 급여 축소와 환수협상 명령을 둘러싼 행정소송도 올해 결론날 가능성이 크다.보건복지부는 2020년 8월 콜린제제의 새로운 급여 기준 내용을 담은 ‘요양급여의 적용기준 및 방법에 관한 세부사항’ 일부 개정고시를 발령했다. 치매 진단을 받지 않은 환자가 콜린제제를 사용할 경우 약값 부담률을 30%에서 80%로 올리는 내용이다.제약사들은 콜린제제 급여 축소의 부당함을 따지는 취소 소송을 제기했다. 소송은 법률 대리인에 따라 2건으로 나눠서 제기됐다. 법무법인 세종이 종근당 등 39개사와 개인 8명을 대리해 소송을 제기했고 법무법인 광장은 대웅바이오 등 39개사와 1명의 소송을 맡았다.종근당 그룹은 지난 2022년 7월 패소 판결을 받았다. 제약사들은 정부의 콜린제제 급여축소 절차가 부적절하고 임상적 유용성도 입증받았다고 주장했지만 재판부는 모두 받아들이지 않았다. 종근당 그룹이 제기한 항소심에서도 지난해 5월 기각 판결이 내려졌다. 현재 대법원에서 사건 심리가 진행 중이다.대웅바이오 그룹은 지난 2022년 11월 패소 판결을 받았고 현재 2심이 진행 중이다. 다만 제약사들이 청구한 급여축소 집행정지 청구는 모두 승소해 선별급여 시행은 중단된 상태다. 콜린제제 환수협상 명령을 둘러싼 행정소송은 1차명령과 2차명령으로 구분된다.2020년 12월 복지부는 국민건강보험공단에 콜린제제를 보유한 업체들에 '임상시험에 실패할 경우 처방액을 반환하라‘는 내용의 요양급여계약을 명령했다.복지부의 환수협상 명령 이후 제약사들은 일제히 행정소송을 제기했다. 소송은 2개 그룹으로 나눠 제기됐다. 법무법인 광장은 대웅바이오 등 28개사의 소송을 대리했고 법무법인 세종이 종근당 등 28개사의 소송을 맡았다. 환수협상 명령의 행정소송에서는 2개 그룹 모두 지난 2022년 1심에서 각하 판결이 나왔다. 종근당 그룹은 지난해 5월 항소심에서 기각 판결을 받았고 대법원도 심리불속행 기각 결정을 내렸다. 대웅바이오 그룹은 1심 패소 이후 항소하지 않았다.제약사들이 환수협상을 거부하자 복지부는 2021년 6월 2차 협상 명령을 내렸다. 이에 종근당 등 26개사와 대웅바이오 등 27개사로 나눠 취소소송을 제기했다. 지난해 3월 종근당 등이 제기한 환수협상 2차명령 취소 소송에서 각하 판결을 내렸고 현재 2심 재판이 진행 중이다. 대웅바이오 그룹은 27곳 중 씨엠지제약과 환인제약을 제외한 25곳이 이탈한 가운데 2022년 2월 각하 판결이 나왔고 항소심은 제기되지 않았다.제약사들은 콜린제제의 행정소송에 사활을 걸 수 밖에 없는 처지다. 임상재평가 실패 이후 환수가 현실화하면 막대한 손실이 불가피하다.제약사들은 콜린제제의 재평가 임상 실패로 최종적으로 적응증이 삭제될 경우 임상시험 계획서를 승인받은 날부터 삭제일까지 처방액의 20%를 건보공단에 돌려주겠다고 합의했다. 만약 콜린제제 임상시험 계획 승인 이후 5년간 진행한 임상시험이 실패할 경우 5년간 처방액의 20%를 환수해야 한다는 의미다.지난 2023년 콜린제제의 외래 처방시장 규모는 6226억원으로 집계됐다. 작년 3분기까지 처방액은 4566억원에 달했다. 제약사들이 임상실패시 청구되는 환수금액은 수천억원 규모로 추산된다.국내 생산 보툴리눔제제 57% 허가 취소 위기...대법원 선고 임박보툴리눔독소제제 기업들도 시장 퇴출을 모면하기 위한 행정소송이 결론을 앞두고 있다.국내 제약바이오기업 7곳의 보툴리눔독소제제 16개 품목이 허가취소 처분이 예고됐다. 메디톡스, 휴젤, 파마리서치바이오, 제테마, 한국비엠아이, 한국비엔씨, 휴온스바이오파마 등 7개 업체가 보툴리눔독소제제의 허가취소 처분 등이 예고됐다. 메디톡스는 총 3건의 허가취소 처분에 대한 행정소송을 진행 중이다.2020년 10월 식약처는 국가출하승인을 받지 않고 판매한 메디톡신주 50・100・150・200단위, 코어톡스주에 대해 약사법 위반으로 품목 허가취소 행정처분 절차에 착수했다.식약처는 2020년 12월 이노톡스에 대해 잠정 제조·판매·사용 중지와 허가 취소 등 처분 절차에 착수했다. 국민권익위원회에 공익신고로 제보된 허가제출서류 조작 의혹에 대해 검찰의 수사 결과에 따른 후속조치다. 검찰은 메디톡스가 이노톡스의 품목허가와 변경허가를 하는 과정에서 안정성 시험 자료를 위조했다는 이유로 공무집행방해로 기소했다. 식약처는 메디톡스가 ‘거짓이나 그 밖의 부정한 방법으로 품목허가와 변경허가를 받은 경우’에 해당한다고 판단해 품목 허가취소 절차에 착수했다.메디톡신 50・100・150・200단위, 코어톡스 등의 간접수출 위반 사건은 메디톡스가 1심과 2심에서 승소한 상태다. 메디톡스는 메디톡신의 성분 변경 처분에 대해 원액은 바뀌지 않았다는 이유로 처분이 부당하다는 행정소송을 제기했다. 메디톡스는 2023년 11월 1심에서 승소했고 지난해 9월 2심에서도 승소 판결을 받았다. 현재 대법원 심리가 진행 중이다. 메디톡스가 청구한 이노톡스 행정처분 취소소송은 현재 1심 재판이 진행 중이다.2021년 11월 식약처는 국가출하승인을 받지 않고 판매했다는 혐의로 휴젤의 보툴렉스, 보툴렉스50단위, 보툴렉스150단위, 보툴렉스200단위 등 4종과 파마리서치바이오의 리엔톡스100단위와 리엔톡스200단위 등에 대해 품목허가 취소 등 행정처분과 회수·폐기 절차에 착수했다. 2022년 12월 제테마의 제테마더톡신100단위, 한국비엠아이의 하이톡스100단위, 한국비엔씨의 비에녹스주 등 3개사의 3개 제품이 품목허가 취소가 통지됐다. 지난해 7월 휴온스바이오파마의 리즈톡스주100단위에 대해 허가 취소 처분이 예고됐다.파마리서치바이오는 2023년 12월 식약처를 상대로 제기한 처분 취소소송에서 승소 판결을 받았다. 휴젤은 지난해 2월 서울행정법원으로부터 1심 승소 판결을 선고받았다. 휴젤의 행정소송 사건에서 재판부는 “의약품 자체를 판매할 수 없는 품목허가 취소 처분은 지나치게 가혹하다”라면서 재량권 일탈 남용에 해당한다고 판단했다. 재판부는 “위반행위의 동기와 경위, 비난가능성, 국민보건상 위해 발생 정도 등과 관련해 참작할만한 사정이 있음에도 불구하고 관련 규정이 정한 기준을 기계적으로 적용해 처분한 것으로 보인다”라고 결론내렸다.지난 2023년 국내 제약바이오기업들이 생산한 보툴리눔독소제제 생산실적은 총 5761억원으로 집계됐다. 이중 허가 취소가 예고된 보툴리눔독소제제 16개 제품의 생산실적은 총 3284억원으로 전체 생산액의 57.0%에 해당한다. 국내 생산 보툴리눔독소제제 절반 이상이 퇴출 위기에 놓인 셈이다. 만약 최종적으로 행정처분 예고 제품들이 허가가 취소된다면 국내에선 유례없는 보툴리눔독소제제 수급난이 발생할 수 있다는 우려가 나온다.2025-01-10 06:20:28천승현 -
 생동 실시 제네릭 12년 만에 위탁 추월...규제강화 여파[데일리팜=천승현 기자] 생물학적동등성 인정 제네릭 중 위탁 제품의 비중이 크게 축소됐다. 임상시험을 직접 실시한 제네릭 개수가 위탁 제품을 12년 만에 넘어섰다. 생동성시험 진행 제품의 약가를 우대하는 개편 약가제도와 공동개발 규제가 시행되면서 위탁 제네릭의 허가 건수가 급감했다.9일 식품의약품안전처의 '2024년 식품의약품통계연보'에 따르면 지난 2023년 생물학적동등성 인정품목은 359개로 집계됐다. 2022년 235개보다 52.8% 증가했지만 2021년 648개보다 44.6% 감소했다.생동성인정품목은 오리지널 의약품과 동등성을 인정받은 제품으로 대부분 신규 허가 제네릭이 차지한다. 2023년 생동성인정품목은 지난 2019년 2358개와 비교하면 4년새 84.8% 쪼그라들었다. 생동성시험을 직접 실시한 제네릭 건수가 크게 늘었고 위탁 제품 개수가 급감했다.지난 2023년 생동성시험 직접 실시 제네릭은 219개로 2022년 52개보다 4배 이상 늘었다. 지난 2015년 238개를 기록한 이후 8년 만에 최대 규모다. 2023년 생동성시험을 수행하지 않고 위탁 방식으로 동등성을 인정받은 제네릭은 140개로 전년대비 23.5% 줄었다. 지난 2019년 2277개와 비교하면 4년새 93.9% 축소됐다.생동성시험 직접 실시 제품이 위탁 제품 개수를 넘어선 것은 지난 2011년 이후 12년 만이다. 지난 2011년에는 생동성시험 직접 실시 제품이 543개로 위탁 제품 366개를 앞섰지만 이후 위탁 제품 비중이 더욱 컸다.약가제도 개편과 허가규제 강화로 위탁 제네릭이 감소하면서 전체 제네릭 허가 건수가 급감한 것으로 분석된다.2020년 7월부터 시행된 개편 약가제도는 제네릭 제품은 생동성시험 직접 수행과 등록 원료의약품 사용을 모두 충족해야만 현행 특허만료 전 오리지널 의약품 대비 53.55% 상한가를 유지하는 내용이 핵심이다.직접 생동성시험을 수행하지 않으면 높은 약가를 받을 수 없다는 이유로 전 제조 공정 위탁 방식의 제네릭 허가 시도가 감소했다.공동개발 규제도 강화됐다. 2021년 7월부터 개정 약사법 적용에 따라 하나의 임상시험으로 허가받을 수 있는 개량신약과 제네릭 개수가 제한됐다. 생동성시험을 직접 시행한 제약사의 의약품과 동일한 제조소에서 동일 처방·제조법으로 모든 제조 공정을 동일하게 제조하는 경우 생동성자료 사용이 3회로 제한된다. 1건의 생동성시험으로 4개의 제네릭만 허가 받을 수 있다는 의미다.약가와 허가 규제 강화로 생동성시험 1건당 허가받는 제네릭 건수가 크게 줄었다. 2019년 생동성인정품목 2358개 중 생동성시험 직접실시 제품은 81개에 불과했다. 당시 1년 간 허가받은 제네릭 중 생동성시험을 진행한 제품은 3.4%에 그쳤다. 생동성시험 1건 당 제네릭 허가건수는 29.1개에 달했다. 생동성시험 1건 당 제네릭 허가건수는 2020년과 2021년 각각 9.4개, 8.6개로 줄었다.2022년 생동성시험 1건당 4.5개의 제네릭이 허가받았고 2023년에는 1.6개로 감소했다. 2023년 동등성을 인정받은 제네릭 중 생동성시험을 직접 수행한 제품의 비중은 61.0%에 달했다. 약가와 규제 제도 변화에 위탁제네릭 허가 급감으로 이어진 셈이다.약가제도 개편 후속조치로 진행된 제네릭 약가재평가 결과 생동성시험 직접 실시 제네릭이 급증했다는 분석이 나온다. 제네릭 약가재평가는 2020년 7월부터 시행된 새 약가제도를 기등재 제네릭에 적용하기 위한 정책이다.지난 2020년 6월 보건복지부는 최고가 요건을 갖추지 못한 제네릭은 2023년 2월28일까지 ‘생동성시험 수행’과 ‘등록 원료의약품 사용’ 자료를 제출하면 종전 약가를 유지해주는 내용의 약제 상한금액 재평가 계획 공고를 냈다.제약사들은 약가인하를 회피하기 위해 기허가 제네릭 제품에 대해서도 생동성시험에 착수했다. 제제 연구를 통해 제네릭을 만들어 생동성시험을 진행하고 동등 결과를 얻어내면 변경 허가를 통해 약가인하도 피할 수 있다는 전략이다. 이때 위탁제조를 자사 제조로 전환하면서 허가변경을 진행하면 ‘생동성시험 실시’ 요건을 충족하는 구조다. 제약사들의 기허가 제네릭의 약가인하 회피 움직임이 생동성시험 직접 실시 제품 비중 확대로 이어졌다.2025-01-09 06:18:33천승현
생동 실시 제네릭 12년 만에 위탁 추월...규제강화 여파[데일리팜=천승현 기자] 생물학적동등성 인정 제네릭 중 위탁 제품의 비중이 크게 축소됐다. 임상시험을 직접 실시한 제네릭 개수가 위탁 제품을 12년 만에 넘어섰다. 생동성시험 진행 제품의 약가를 우대하는 개편 약가제도와 공동개발 규제가 시행되면서 위탁 제네릭의 허가 건수가 급감했다.9일 식품의약품안전처의 '2024년 식품의약품통계연보'에 따르면 지난 2023년 생물학적동등성 인정품목은 359개로 집계됐다. 2022년 235개보다 52.8% 증가했지만 2021년 648개보다 44.6% 감소했다.생동성인정품목은 오리지널 의약품과 동등성을 인정받은 제품으로 대부분 신규 허가 제네릭이 차지한다. 2023년 생동성인정품목은 지난 2019년 2358개와 비교하면 4년새 84.8% 쪼그라들었다. 생동성시험을 직접 실시한 제네릭 건수가 크게 늘었고 위탁 제품 개수가 급감했다.지난 2023년 생동성시험 직접 실시 제네릭은 219개로 2022년 52개보다 4배 이상 늘었다. 지난 2015년 238개를 기록한 이후 8년 만에 최대 규모다. 2023년 생동성시험을 수행하지 않고 위탁 방식으로 동등성을 인정받은 제네릭은 140개로 전년대비 23.5% 줄었다. 지난 2019년 2277개와 비교하면 4년새 93.9% 축소됐다.생동성시험 직접 실시 제품이 위탁 제품 개수를 넘어선 것은 지난 2011년 이후 12년 만이다. 지난 2011년에는 생동성시험 직접 실시 제품이 543개로 위탁 제품 366개를 앞섰지만 이후 위탁 제품 비중이 더욱 컸다.약가제도 개편과 허가규제 강화로 위탁 제네릭이 감소하면서 전체 제네릭 허가 건수가 급감한 것으로 분석된다.2020년 7월부터 시행된 개편 약가제도는 제네릭 제품은 생동성시험 직접 수행과 등록 원료의약품 사용을 모두 충족해야만 현행 특허만료 전 오리지널 의약품 대비 53.55% 상한가를 유지하는 내용이 핵심이다.직접 생동성시험을 수행하지 않으면 높은 약가를 받을 수 없다는 이유로 전 제조 공정 위탁 방식의 제네릭 허가 시도가 감소했다.공동개발 규제도 강화됐다. 2021년 7월부터 개정 약사법 적용에 따라 하나의 임상시험으로 허가받을 수 있는 개량신약과 제네릭 개수가 제한됐다. 생동성시험을 직접 시행한 제약사의 의약품과 동일한 제조소에서 동일 처방·제조법으로 모든 제조 공정을 동일하게 제조하는 경우 생동성자료 사용이 3회로 제한된다. 1건의 생동성시험으로 4개의 제네릭만 허가 받을 수 있다는 의미다.약가와 허가 규제 강화로 생동성시험 1건당 허가받는 제네릭 건수가 크게 줄었다. 2019년 생동성인정품목 2358개 중 생동성시험 직접실시 제품은 81개에 불과했다. 당시 1년 간 허가받은 제네릭 중 생동성시험을 진행한 제품은 3.4%에 그쳤다. 생동성시험 1건 당 제네릭 허가건수는 29.1개에 달했다. 생동성시험 1건 당 제네릭 허가건수는 2020년과 2021년 각각 9.4개, 8.6개로 줄었다.2022년 생동성시험 1건당 4.5개의 제네릭이 허가받았고 2023년에는 1.6개로 감소했다. 2023년 동등성을 인정받은 제네릭 중 생동성시험을 직접 수행한 제품의 비중은 61.0%에 달했다. 약가와 규제 제도 변화에 위탁제네릭 허가 급감으로 이어진 셈이다.약가제도 개편 후속조치로 진행된 제네릭 약가재평가 결과 생동성시험 직접 실시 제네릭이 급증했다는 분석이 나온다. 제네릭 약가재평가는 2020년 7월부터 시행된 새 약가제도를 기등재 제네릭에 적용하기 위한 정책이다.지난 2020년 6월 보건복지부는 최고가 요건을 갖추지 못한 제네릭은 2023년 2월28일까지 ‘생동성시험 수행’과 ‘등록 원료의약품 사용’ 자료를 제출하면 종전 약가를 유지해주는 내용의 약제 상한금액 재평가 계획 공고를 냈다.제약사들은 약가인하를 회피하기 위해 기허가 제네릭 제품에 대해서도 생동성시험에 착수했다. 제제 연구를 통해 제네릭을 만들어 생동성시험을 진행하고 동등 결과를 얻어내면 변경 허가를 통해 약가인하도 피할 수 있다는 전략이다. 이때 위탁제조를 자사 제조로 전환하면서 허가변경을 진행하면 ‘생동성시험 실시’ 요건을 충족하는 구조다. 제약사들의 기허가 제네릭의 약가인하 회피 움직임이 생동성시험 직접 실시 제품 비중 확대로 이어졌다.2025-01-09 06:18:33천승현 -
 "CSO 맞춤형 CP 솔루션 제공"...일동그룹의 친절한 도전[데일리팜=천승현 기자] 지난해 10월부터 의약품 판촉영업자(CSO) 신고제가 시행되면서 신고하지 않은 CSO의 판촉·영업 활동은 불법으로 간주된다.CSO 업체들은 CSO의 신고, 교육, 판촉업무 CSO 위탁 시 위탁계약서 작성·보관, 위탁받은 판촉업무 재위탁 시 서면 알림 등의 의무를 준수해야 한다. 이를 위반하면 3년 이하의 징역 또는 3000만원 벌금 및 1년 이하의 영업정지에 처한다. CSO 업체들은 판촉영업위탁계약서 작성이나 지출보고서 신고 등 실무 처리 부담이 커진 셈이다.조노제 CMJC 본부장CSO신고제 시행으로 영업 관리 및 사무 자동화 솔루션, 컴플라이언스(CP) 컨설팅 등 CSO 사업자를 대상으로 한 서비스도 속속 등장하고 있다.일동제약그룹의 IT 관계사 CMJC는 최근 CP 솔루션 플랫폼 CP링크(CPLINK)를 구축하고 CSO 업체를 상대로 CP 컨설팅과 관리 솔루션 사업에 나섰다.조노제 CMJC 본부장은 “CP 솔루션은 CSO 사업자가 복지부 가이드라인에 맞게 처리해야 하는 일들을 보다 전문적이고 원활하게 할 수 있도록 지원하는 사업 모델이다”라고 설명했다. 일동제약의 CP 역량과 노하우를 활용해 CSO 업체들에 CP 규정 준수와 내부 통제 등의 기능을 담당하는 CP 컨설팅 역할을 담당하는 개념이다.조 본부장은 일동제약그룹의 IT시스템 회사 CMJC에서 CP 솔루션 사업을 이끌고 있다. 조 본부장은 2005년 일동제약에 입사해 영업 담당자와 영업 소장을 거치며 약 10년간 ETC 영업을 경험했고 컴플라이언스 부서(CP팀)에서 11년째 근무 중이다. 현재 일동제약의 CP 운영 팀장과 CMJC의 CP 솔루션 사업 본부장을 겸직하고 있다.CP링크는 CSO가 보건복지부에 보고해야 하는 경제적 이익 제공에 관한 지출 내역 등이 규정에 맞게 정확하게 입력되도록 돕는 지출보고서 작성 시스템 중심으로 CP 관련 전문 정보 제공, 찾아가는 CP 교육, 실시간 CP 상담 등의 기능으로 구성됐다.예를 들어 지출보고서 작성 시스템의 경우 CSO 업체가 거래처 기본 정보만 등록하면 지출 내역이 발생할 때마다 자동으로 지출보고서가 입력되는 시스템이다. 영업·마케팅 활동을 진행하면서 CP 규정 위반 여부가 모호할 때 CP링크에서 실시간 상담을 통해 궁금증을 해결할 수 있다.CMJC는 전문 CP 컨설팅 CP링크 서비스를 시작했다. CP링크에서는 CSO 영업관리 시스템 ‘V-링크’ 플랫폼과도 연동되도록 설계해 ▲AI기술 기반 EDI 자료 자동 정리 ▲위탁 계약서 관리 ▲위탁 현황 차트 구현 등 CSO 운영과 영업관리 등을 해결할 수 있다.CP링크에는 CSO를 위한 ▲제약영업 ??翅?판촉물 전문몰 및 비즈마켓 ▲법무 · 세무법인 제휴 서비스 등 CSO 사업에 유용한 부가 서비스도 갖추고 있다. 조 본부장은 “CP링크의 가장 큰 차별점이자 경쟁력은 일동그룹이 CP 분야에서 오랜 기간 다져 온 실무 역량과 노하우가 뒷받침 된다는 점이다”라면서 “CP링크는 단순히 지출보고서 관리 서비스만이 아닌 ‘토털 CP 컨설팅 플랫폼’으로서 CP 규제 대응, 리스크 매니지먼트 등 CSO 사업에 필요한 CP 분야의 제반 관리 서비스와 컨설팅 제공이 가능하다”라고 소개했다.조 본부장은 CP 컨설팅 사업 론칭 배경에 대해 CSO 업체를 활용한 영업이 증가하는 제약업계 영업방식 변화를 지목했다.조 본부장은 “최근 제약사가 직접 영업 조직을 거느리던 방식에서 위탁 영업, 공동 판촉 등으로 다변화하고 있고, CSO 등 대행 업체의 진입도 크게 늘고 있다”라고 했다. 조 본부장은 “시장 원리와 업계 활성화와 측면에서 다양한 참여자들이 유입되는 것은 긍정적인 현상이다. 시장 상황에 발맞춰 CSO 사업자를 정당한 플레이어로 인식하고, 해당 사업을 제도권 안에서 양성화해 바람직한 문화를 조성하는 것이 CSO 신고제의 취지 중 하나다”라고 설명했다.그룹 차원에서 제약 산업의 발전에 기여하고, CSO를 포함한 다양한 구성원들이 함께 협력하고 상생할 수 있는 건강한 생태계를 만들어보자는 취지로 CP 컨설팅 사업을 추진했다는 게 조 본부장의 설명이다.일동제약그룹의 CP 컨설팅 사업의 출범은 그룹 차원에서 CMJC의 사업 루트를 다변화하고 독자적인 비즈니스 영역을 구축하겠다는 목적도 있다. 그동안 CMJC는 일동제약그룹에 대한 의존도를 낮추고 자체적 사업 기반을 다지기 위해 꾸준히 노력해왔는데 CMJC가 보유한 IT 분야의 역량에 일동제약이 축적해온 CP 관련 노하우를 결합해 새로운 사업 모델을 창출하겠다는 전략이다.조 본부장은 제약사가 다른 업체의 CP 컨설팅을 담당하는 것에 대한 CSO 측의 경계 우려를 일축했다.조 본부장은 “일동제약의 경우 CSO 영업을 도입하거나 검토한 바가 없어 CSO 업체와는 사업적으로 경쟁 관계에 있지 않다”라면서 “CP 솔루션 및 컨설팅 사업에서 이용되는 정보는 개인정보보호법 등의 관련 법규와 사업상의 비밀유지 계약에 따라 안전하게 취급·관리된다”고 했다.CP링크에서 다뤄지는 정보는 보건복지부에 의무적으로 제출돼야 하는 항목으로 국한되며, 최종적으로는 정부의 정보공개를 통해 공개되는 내용에 한정되기 때문에 CSO 측에서 우려하는 영업 노하우 유출 가능성은 없다는 설명이다.조 본부장은 “그동안 CP 운영 실무자로서 일하면서 CSO 사업자들을 대상으로 의식 개선을 위한 교육과 캠페인 활동에 참여한 바 있다. 많은 CSO 관계자들이 CP에 대한 관심과 의지가 큼에도 불구하고 전문성과 정보 부족으로 인해 적극적으로 동참하지 못하거나, CSO에 대한 외부의 선입견 등에 부담을 느끼는 사례들을 보면서 안타까운 마음이 컸다”라고 전했다.조 본부장은 “그동안 실무자로서 쌓아온 제약 영업과 CP 관리 분야의 경험, 그리고 일동그룹과 CP링크가 추구하는 방향성이 업계의 발전과 시장 활성화에 조금이나마 보탬이 되기를 바란다”라면서 “나아가 CP링크가 제약회사와 CSO 업체는 물론 관계 당국을 호혜적으로 이어주는 상생 모델로 자리매김하길 기대한다”라고 강조했다.CP 컨설팅 CP링크의 주요 서비스2025-01-07 06:18:23천승현
"CSO 맞춤형 CP 솔루션 제공"...일동그룹의 친절한 도전[데일리팜=천승현 기자] 지난해 10월부터 의약품 판촉영업자(CSO) 신고제가 시행되면서 신고하지 않은 CSO의 판촉·영업 활동은 불법으로 간주된다.CSO 업체들은 CSO의 신고, 교육, 판촉업무 CSO 위탁 시 위탁계약서 작성·보관, 위탁받은 판촉업무 재위탁 시 서면 알림 등의 의무를 준수해야 한다. 이를 위반하면 3년 이하의 징역 또는 3000만원 벌금 및 1년 이하의 영업정지에 처한다. CSO 업체들은 판촉영업위탁계약서 작성이나 지출보고서 신고 등 실무 처리 부담이 커진 셈이다.조노제 CMJC 본부장CSO신고제 시행으로 영업 관리 및 사무 자동화 솔루션, 컴플라이언스(CP) 컨설팅 등 CSO 사업자를 대상으로 한 서비스도 속속 등장하고 있다.일동제약그룹의 IT 관계사 CMJC는 최근 CP 솔루션 플랫폼 CP링크(CPLINK)를 구축하고 CSO 업체를 상대로 CP 컨설팅과 관리 솔루션 사업에 나섰다.조노제 CMJC 본부장은 “CP 솔루션은 CSO 사업자가 복지부 가이드라인에 맞게 처리해야 하는 일들을 보다 전문적이고 원활하게 할 수 있도록 지원하는 사업 모델이다”라고 설명했다. 일동제약의 CP 역량과 노하우를 활용해 CSO 업체들에 CP 규정 준수와 내부 통제 등의 기능을 담당하는 CP 컨설팅 역할을 담당하는 개념이다.조 본부장은 일동제약그룹의 IT시스템 회사 CMJC에서 CP 솔루션 사업을 이끌고 있다. 조 본부장은 2005년 일동제약에 입사해 영업 담당자와 영업 소장을 거치며 약 10년간 ETC 영업을 경험했고 컴플라이언스 부서(CP팀)에서 11년째 근무 중이다. 현재 일동제약의 CP 운영 팀장과 CMJC의 CP 솔루션 사업 본부장을 겸직하고 있다.CP링크는 CSO가 보건복지부에 보고해야 하는 경제적 이익 제공에 관한 지출 내역 등이 규정에 맞게 정확하게 입력되도록 돕는 지출보고서 작성 시스템 중심으로 CP 관련 전문 정보 제공, 찾아가는 CP 교육, 실시간 CP 상담 등의 기능으로 구성됐다.예를 들어 지출보고서 작성 시스템의 경우 CSO 업체가 거래처 기본 정보만 등록하면 지출 내역이 발생할 때마다 자동으로 지출보고서가 입력되는 시스템이다. 영업·마케팅 활동을 진행하면서 CP 규정 위반 여부가 모호할 때 CP링크에서 실시간 상담을 통해 궁금증을 해결할 수 있다.CMJC는 전문 CP 컨설팅 CP링크 서비스를 시작했다. CP링크에서는 CSO 영업관리 시스템 ‘V-링크’ 플랫폼과도 연동되도록 설계해 ▲AI기술 기반 EDI 자료 자동 정리 ▲위탁 계약서 관리 ▲위탁 현황 차트 구현 등 CSO 운영과 영업관리 등을 해결할 수 있다.CP링크에는 CSO를 위한 ▲제약영업 ??翅?판촉물 전문몰 및 비즈마켓 ▲법무 · 세무법인 제휴 서비스 등 CSO 사업에 유용한 부가 서비스도 갖추고 있다. 조 본부장은 “CP링크의 가장 큰 차별점이자 경쟁력은 일동그룹이 CP 분야에서 오랜 기간 다져 온 실무 역량과 노하우가 뒷받침 된다는 점이다”라면서 “CP링크는 단순히 지출보고서 관리 서비스만이 아닌 ‘토털 CP 컨설팅 플랫폼’으로서 CP 규제 대응, 리스크 매니지먼트 등 CSO 사업에 필요한 CP 분야의 제반 관리 서비스와 컨설팅 제공이 가능하다”라고 소개했다.조 본부장은 CP 컨설팅 사업 론칭 배경에 대해 CSO 업체를 활용한 영업이 증가하는 제약업계 영업방식 변화를 지목했다.조 본부장은 “최근 제약사가 직접 영업 조직을 거느리던 방식에서 위탁 영업, 공동 판촉 등으로 다변화하고 있고, CSO 등 대행 업체의 진입도 크게 늘고 있다”라고 했다. 조 본부장은 “시장 원리와 업계 활성화와 측면에서 다양한 참여자들이 유입되는 것은 긍정적인 현상이다. 시장 상황에 발맞춰 CSO 사업자를 정당한 플레이어로 인식하고, 해당 사업을 제도권 안에서 양성화해 바람직한 문화를 조성하는 것이 CSO 신고제의 취지 중 하나다”라고 설명했다.그룹 차원에서 제약 산업의 발전에 기여하고, CSO를 포함한 다양한 구성원들이 함께 협력하고 상생할 수 있는 건강한 생태계를 만들어보자는 취지로 CP 컨설팅 사업을 추진했다는 게 조 본부장의 설명이다.일동제약그룹의 CP 컨설팅 사업의 출범은 그룹 차원에서 CMJC의 사업 루트를 다변화하고 독자적인 비즈니스 영역을 구축하겠다는 목적도 있다. 그동안 CMJC는 일동제약그룹에 대한 의존도를 낮추고 자체적 사업 기반을 다지기 위해 꾸준히 노력해왔는데 CMJC가 보유한 IT 분야의 역량에 일동제약이 축적해온 CP 관련 노하우를 결합해 새로운 사업 모델을 창출하겠다는 전략이다.조 본부장은 제약사가 다른 업체의 CP 컨설팅을 담당하는 것에 대한 CSO 측의 경계 우려를 일축했다.조 본부장은 “일동제약의 경우 CSO 영업을 도입하거나 검토한 바가 없어 CSO 업체와는 사업적으로 경쟁 관계에 있지 않다”라면서 “CP 솔루션 및 컨설팅 사업에서 이용되는 정보는 개인정보보호법 등의 관련 법규와 사업상의 비밀유지 계약에 따라 안전하게 취급·관리된다”고 했다.CP링크에서 다뤄지는 정보는 보건복지부에 의무적으로 제출돼야 하는 항목으로 국한되며, 최종적으로는 정부의 정보공개를 통해 공개되는 내용에 한정되기 때문에 CSO 측에서 우려하는 영업 노하우 유출 가능성은 없다는 설명이다.조 본부장은 “그동안 CP 운영 실무자로서 일하면서 CSO 사업자들을 대상으로 의식 개선을 위한 교육과 캠페인 활동에 참여한 바 있다. 많은 CSO 관계자들이 CP에 대한 관심과 의지가 큼에도 불구하고 전문성과 정보 부족으로 인해 적극적으로 동참하지 못하거나, CSO에 대한 외부의 선입견 등에 부담을 느끼는 사례들을 보면서 안타까운 마음이 컸다”라고 전했다.조 본부장은 “그동안 실무자로서 쌓아온 제약 영업과 CP 관리 분야의 경험, 그리고 일동그룹과 CP링크가 추구하는 방향성이 업계의 발전과 시장 활성화에 조금이나마 보탬이 되기를 바란다”라면서 “나아가 CP링크가 제약회사와 CSO 업체는 물론 관계 당국을 호혜적으로 이어주는 상생 모델로 자리매김하길 기대한다”라고 강조했다.CP 컨설팅 CP링크의 주요 서비스2025-01-07 06:18:23천승현 -
 K-신약, 상업적 성과 쏟아질까...글로벌 경쟁력 시험대[데일리팜=천승현 기자] 올해 국내 제약바이오기업이 개발한 신약이 글로벌 시장에서 상업적 경쟁력을 검증받는다. 유한양행의 항암신약 렉라자가 미국과 유럽 시장 관문을 통과하고 본격적인 판매에 돌입한다. 녹십자의 혈액제제와 휴젤의 보툴리눔독소제제가 미국 시장에서 상업적 성공 가능성을 타진한다. SK바이오팜, 한미약품, 대웅제약 등이 미국에 내놓은 신약 제품들의 성장세도 관전포인트다. HK이노엔의 케이캡은 국내 시장 흥행을 기반으로 미국 시장 진출을 타진한다.유한양행 렉라자 미국·유럽 출격...K-항암신약 첫 글로벌 시장 도전장6일 업계에 따르면 유한양행의 렉라자가 올해 본격적으로 글로벌 시장에서 데뷔전을 치른다. 렉라자는 2021년 1월 국내 개발 31호 신약으로 허가 받은 비소세포폐암 치료제다.렉라자는 지난해 8월 미국 식품의약품국(FDA)의 시판허가를 승인받았다. 렉라자는 존슨앤드존슨의 리브리반트와의 병용요법으로 상피세포성장인자수용체(EGFR) 엑손 19 결실 또는 엑손 21 L858R 치환 변이가 확인된 국소 진행성 또는 전이성 비소세포폐암(NSCLC) 성인 환자의 1차 치료제로 승인받았다.렉라자는 지난해 말 유럽연합 집행위원회(EC) 승인을 받으며 국내개발 항암신약 중 처음으로 미국과 유럽 시장 진출에 성공했다. 렉라자의 미국과 유럽 승인은 MARIPOSA 3상 연구 결과를 기반으로 이뤄졌다. 렉라자·리브라반트 병용요법군은 타그리소군보다 질병 진행과 사망위험을 30% 낮춘 것으로 나타났다. 렉라자·리브라반트 병용요법의 무진행 생존기간(PFS)은 23.7개월로, 오시머티닙의 16.6개월 보다 길었고 반응 지속 기간(DOR)도 25.8개월로 타그리소의 16.8개월보다 9개월 더 길었다. 렉라자의 미국과 유럽시장 허가로 올해부터 현지 의료현장에서 본격적으로 리브리반트와의 병용요법 처방이 시작될 전망이다.렉라자·리브리반트 병용요법은 임상적 유용성을 바탕으로 미국종합암네트워크(NCCN)에 1차 치료제로 권고됐다. NCCN은 암의 진단, 치료, 예후 등에 대한 권고사항을 제공하는 가이드라인이다. 이 기관은 미국 국립암센터, 연구소 등 32개 기관이 연합한 단체로 구성돼 있으며 전 세계 의료진들은 NCCN을 암 진료와 치료에 있어 주요 가이드라인으로 참고하고 있다.렉라자는 해외 진출에 속도를 내면서 추가 기술료도 꾸준히 발생하고 있다. 유한양행은 렉라자의 미국과 유럽 허가로 각각 기술료 6000만달러와 3000만달러를 확보했다.렉라자는 국내 시장에서도 항암신약 매출 신기록을 모두 갈아치울 태세다. 의약품 조사기관 아이큐비아에 따르면 렉라자는 지난해 3분기 누적 매출이 521억원으로 전년동기 164억원보다 3배 이상 늘었다.지난해부터 렉라자의 건강보험 급여 범위가 확대되면서 처방 수요가 수직상승했다. 당초 렉라자는 1, 2세대 상피세포성장인자수용체(EGFR) 티로신키나제억제제(TKI) 투여 후 특정 유전자(T790M) 내성이 생긴 국소진행성 또는 전이성 비소세포폐암의 2차치료제로 허가받았다. 지난해부터 렉라자는 ‘특정 유전자 변이가 있는 국소 진행성 또는 전이성 비소세포폐암 1차 치료’로 급여 범위가 확대됐다. 렉라자는 국내개발 항암신약 중 처음으로 분기 매출 100억원을 넘어섰다. 렉라자 이전에 허가 받은 국내 개발 항암신약 중 연 매출 100억원을 넘어선 제품도 없다.녹십자 알리글로 미국 시장 본격 판매...안정적 원료 공급처 확보녹십자의 혈액제제 알리글로가 미국 시장에서 상업성 검증에 나선다. 녹십자는 2023년 12월 FDA로부터 혈액제제 알리글로의 품목 허가를 획득했다. 알리글로는 혈장분획으로부터 정제된 액상형 면역글로불린제제다. 선천성 면역결핍증, 면역성 혈소판감소증과 같은 1차성 면역결핍 질환 치료에 사용된다. 알리글로는 국내 기업이 개발한 혈액제제 중 처음으로 미국 시장에 진출했다.녹십자는 지난해 7월 혈액제제 알리글로의 초도 물량을 선적 완료했다. 알리글로는 정맥주사용 면역글로불린(IVIG)로 신속히 투여가 가능하다는 장점이 있다. 냉장 보관이 필요한 다른 IVIG 약물과 달리 상온 보관이 가능해 유통과 보관이 편리하며 유통 중 변질 위험이 적다는 평가다.미국에서는 면역글로불린제제가 100개 이상의 적응증에 허가범위 초과사용(오프라벨)으로 처방되고 있어 알리글로가 추가 적응증 확장 없이도 다양한 질환에 오프라벨로 처방될 것으로 전망된다.녹십자는 작년 7월 알리글로의 초도 물량을 선적 완료하며 본격적인 판매에 나섰다. 지난해 3분기 녹십자 혈액제제의 매출은 1522억원으로 전 분기 906억원과 비교하면 1분기 만에 68.0% 확대됐다 알리글로의 미국 매출로 300억원 이상을 올린 것으로 추산된다.녹십자는 최근 대규모 투자를 통해 혈액원을 사들이며 알리글로의 미국 시장 안착을 위한 로드맵을 완성했다. 녹십자는 지난해 12월 1380억원을 들여 ABO홀딩스의 지분 전량을 인수했다. ABO홀딩스는 미국 캘리포니아주에 위치한 회사로 뉴저지, 유타, 캘리포니아 등 3개 지역에 6곳의 혈액원을 운영하고 있다. 녹십자는 지난 2020년 미국 현지에 보유한 혈액원을 매각한지 4년 만에 새로운 혈액원을 사들였다혈액제제는 혈액을 원료로 사용하는 특성상 원료 확보가 쉽지 않다는 어려움이 있는데 녹십자는 ABO홀딩스 인수로 안정적인 혈액 공급처를 확보했다. 녹십자가 ABO홀딩스로부터 공급받은 혈액으로 국내 오창 공장에서 알리글로를 생산해 미국에서 판매하는 방식이다.알리글로의 미국 판매 유통 채널도 빠른 속도로 정비됐다. 녹십자는 미국 면역글로불린 유통 채널의 약 50%를 차지하는 전문약국(Specialty Pharmacy)을 통해 알리글로를 판매한다. 지난해 알리글로는 시그나 헬스케어(Cigna Healthcare), 유나이티드 헬스케어(United Healthcare), 블루크로스 블루실드(Blue Cross Blue Shield) 등 미국 내 주요 보험사 3곳의 처방집에 등재되며 미국 내 사보험 가입자의 80%를 확보했다.알리글로는 익스프레스스크립츠(ESI, Express Scripts) 등 미국 내 3대 처방급여관리업체(PBM, Pharmacy Benefit Manager)를 포함한 6곳의 의약품 구매대행사와의 계약 체결도 완료된 바 있다. 알리글로를 판매를 위한 보험사, PBM, 전문약국, 유통사에 이르는 수직통합채널의 구축이 일단락됐다.동아에스티, 첫 바이오시밀러 미국·유럽 진출...휴젤, 보툴리눔제제 미국 공략올해 동아에스티의 첫 바이오시밀러 이뮬도사가 처음으로 미국과 유럽 시장에 출격한다.동아에스티는 자가면역질환치료제 스텔라라의 바이오시밀러 이뮬도사를 지난해 10월 FDA 허가를 받았고 작년 12월에는 유럽연합 집행위원회(EC)로부터 품목허가를 획득했다. 스텔라라는 얀센이 개발한 인터루킨-12,23 저해제 계열 자가면역질환 치료제다. 염증세포의 활성화를 억제하는 기전을 통해 판상 건선과 건선성 관절염, 크론병 및 궤양성 대장염 등 적응증을 보유하고 있다.이뮬도사는 동아에스티가 개발한 바이오시밀러 제품 중 처음으로 미국과 유럽에 진출했다. 동아에스티는 지난 2011년 바이오시밀러 사업 진출을 선언했다.에스티젠바이오 송도 공장 전경 동아쏘시오홀딩스는 지난 2013년부터 일본 메이지세이카파마와 이뮬도사의 공동 개발을 시작했다. 2020년 7월 효율적인 글로벌 프로젝트 수행을 위해 동아에스티로 개발과 상업화 권리가 이전됐다.동아에스티는 2021년부터 2022년 말까지 미국, 폴란드, 에스토니아 등 9개국에서 총 605명의 환자를 대상으로 이뮬도사의 글로벌 임상 3상시험을 진행했다. 임상시험 결과 이뮬도사는 미국 식품의약품국(FDA)과 유럽 의약품청(EMA) 품목허가를 위한 유효성과 안전성에 대해 스텔라라와 동등성을 확인했다.이뮬도사의 글로벌 상업화는 인타스의 자회사 어코드 헬스케어가 담당한다. 동아에스티는 2021년 7월 다국적 제약사 인타스와 이뮬도사의 기술수출 계약을 체결했다. 인타스는 한국과 일본, 일부 아시아 국가를 제외한 글로벌 지역의 허가와 판매에 관한 독점 권리를 확보했다. 인타스는 85개국 이상의 글로벌 판매망을 갖춘 인도의 다국적 제약사다.휴젤의 보툴리눔독소제제 레티보가 미국 시장 판매를 시작한다. 휴젤은 지난해 3월 FDA로부터 레티보의 품목허가를 승인받았다. 적응증은 '중등증~중증의 미간주름 개선'이다. 레티보는 대웅제약 나보타에 이어 국내 개발 보툴리눔독소제제 중 미국 시장에 두 번째 진출했다.휴젤은 지난해 7월 레티보 미국 초도 물량을 선적했다.당초 휴젤은 2022년 10월 레티보의 품목허가를 신청했지만 2023년 4월 보완요구서한을 받았다. 휴젤은 공정설비와 일부 데이터 등에 대한 보완 작업을 완료하고 2023년 9월 허가 신청서를 제출했고 지난해 최종 승인을 획득했다.휴젤은 현지법인인 '휴젤아메리카(HUGEL AMERICA)'를 통해 세계 최대 보툴리눔톡신 시장을 공략한다는 계획을 세웠다. 휴젤은 지난 2018년 8월 미국 시장 진출을 위해 휴젤아메리카를 설립했다. 휴젤의 글로벌 파트너사인 크로마파마(CROMA-PHARMA)의 미국 자회사 크로마USA와 합작회사를 설립했다. 이어 지난해 크로마 측 잔여주식을 취득하며 100% 자회사로 전환했다.레티보는 지적재산권 침해 문제에서 벗어나며 미국 판매 걸림돌을 해소한 상태다. 메디톡스는 2022년 3월 미국 ITC에 휴젤의 보툴리눔톡신 레티보가 자사 영업비밀과 균주를 도용했다며 휴젤과 휴젤아메리카, 크로마파마를 상대로 소송을 제기했다. 지난해 10월 미국 국제무역위원회(ITC)는 레티보가 지적재산권 침해 사실이 없다는 취지로 관세법 337조를 위반한 사례가 없다고 심결했다.SK바이오팜·한미약품·대웅제약, 미국 판매 신약 고공행진 기대감SK바이오팜, 한미약품, 대웅제약 등이 미국 시장에 내놓은 신약의 매출 성장도 기대되는 R&D 성과다.SK바이오팜이 미국 현지에서 독자적으로 판매 중인 뇌전증 신약 세노바메이트가 급성장하고 있다. 세노바메이트는 부분발작 증상을 보이는 성인 뇌전증 환자에게 처방되는 제품으로 SK바이오팜이 초기 개발부터 미국식품의약국(FDA) 허가까지 전 과정을 독자적으로 수행했다. SK바이오팜은 지난 2019년 11월 세노바메이트를 '엑스코프리‘라는 제품명으로 FDA 허가를 받았다. 2020년 5월부터 SK라이프사이언스를 통해 직접 판매하고 있다.분기별 엑스코프리 미국 매출(단위: 억원, 자료: SK바이오팜) 세노바메이트는 국내기업이 개발한 신약 제품 중 미국에서 가장 많은 매출을 기록 중이다.세노바메이트는 2020년 2분기 첫 매출 21억원을 발생한 이후 매 분기 성장세를 지속하고 있다. 지난해 3분기 세노바메이트의 미국 매출은 1133억원으로 전년동기대비 49.7% 늘었다. 세노바메이트는 2020년 미국 시장 진출 이후 매 분기 매출 신기록을 경신하고 있다. 작년 3분기까지 누적 매출은 총 8402억원으로 집계됐다.세노바메이트는 현재 미국외에도 유럽과 캐나다, 아시아, 중남미 지역은 파트너사와의 기술이전 계약을 통해 판매되고 있다. 유럽에서는 파트너사 안젤리니파마가 온투즈리라는 제품명으로 판매하고 있으며 아시아 지역은 임상3상시험이 진행 중이다. SK바이오팜은 지난해 1월 동아에스티와 라이선싱 계약을 체결했다. 동아에스티가 한국, 러시아, 터키, 호주, 남아프리카, 동남아시아 등 30개국에서 세노바메이트의 허가·생산·판매 권리를 확보하는 내용이다. 동아에스티는 SK바이오팜에 계약금 50억원을 지급했다.SK바이오팜은 성인 대상 전신 발작 임상3상, 소아/청소년 대상 부분발작 임상3상을 통해 세노바메이트의 적응증을 확장할 계획이다.한미약품이 개발한 신약 중 처음으로 미국 관문을 통과한 롤론티스도 성장세가 기대된다.롤론티스는 골수억제성 항암화학요법을 적용 받는 암환자에게 호중구감소증 치료 또는 예방 용도로 투여된다. 과립구(granulocyte)를 자극해 호중구 수를 증가시키는 'G-CSF'(과립구집락자극인자) 계열로 암젠의 블록버스터 약물 뉴라스타와 유사한 작용기전을 나타낸다.한미약품은 지난 2012년 스펙트럼에 롤론티스를 기술이전했고 2021년 9월 FDA로부터 롤베돈이라는 제품명으로 허가받았다. 미국 호중구감소증치료제 시장 규모는 연간 3조원에 달한다. 스펙트럼은 지난해 4월 중추신경계·통증·염증 전문 제약사 어썰티오홀딩스에 인수됐다. 롤베돈의 작년 3분기 미국 시장 매출은 1500만 달러(약 210억원)로 전년 동기 대비 87.5% 증가했다. 지난해 3분기 누적 매출은 4460만달러를 기록했다. 롤베돈은 2022년 4분기 미국에 출시된 이후 올린 누적 매출은 총 1억1030만 달러로 집계됐다.대웅제약의 보툴리눔독소제제 나보타의 미국 판매 확장도 전망된다. 미국에서 주보라는 제품명으로 판매 중인 나보타는 국내 개발 의약품 중 엑스코프리에 이어 미국에서 가장 많이 팔리는 제품이다.에볼루스의 작년 3분기 매출은 6110만 달러로 전년 동기 5000만 달러 대비 22.2% 늘었다. 지난해 3분기까지 총 1억8700만달러의 매출로 1년 전보다 32.6% 증가하며 성장세를 지속 중이다. 에볼루스의 매출 대부분은 나보타 판매 실적에서 나온다. 대웅제약은 에볼루스와 지난 2013년 나보타 공급 계약을 맺었고 에볼루스는 2020년 북미 시장에 나보타를 선보였다.나보타의 미국 사용 경험 축적으로 신뢰도가 축적된 데다 2019년부터 진행한 메디톡스와 균주 도용 소송이 종결된 이후 수출 실적이 급증하기 시작했다. 2021년 2월 메디톡스는 나보타(미국 상품명 주보) 미국 판매와 관련해 대웅제약 미국 파트너사 에볼루스, 애브비와 3자 합의 계약을 체결했다. 메디톡스와 애브비는 미국 내에서 주보의 지속적인 판매·유통 권리를 에볼루스에 부여하고 일정 금액의 대가를 받는 내용이 핵심이다.분기별 나보타 매출 추이(단위: 억원, 자료: 대웅제약) 대웅제약은 지난해 3분기 나보타의 매출 475억원을 기록했는데 수출이 차지하는 비중은 84.0%로 집계됐다. 작년 1분기부터 3분기 연속 수출이 80%를 상회하며 해외 판매 비중이 압도적이다.에볼루스는 지난해 6월 스페인에 나보타를 정식 출시하며 유럽 시장 확대도 모색하고 있다. 현재 유럽에서 나보타는 누시바라는 제품명으로 스페인을 비롯해 영국, 독일, 오스트리아, 이탈리아 등에 진출하며 미국에 이어 유럽시장 진출 국가가 지속적으로 확대했다. 나보타는 전 세계 68개 국에서 품목 허가를 획득하고 80여 개국과 파트너십을 체결했다.HK이노엔 케이캡 미국 시장 진출 예고...임상3상 막바지HK이노엔의 위식도역류질환 신약 케이캡은 미국 시장 진출 가능성이 제기된다.HK이노엔은 지난 2021년 12월 미국 제약사 세벨라의 자회사 브레인트리 래보라토리스와 케이캡의 기술수출 계약을 체결했다. 선급금으로 250만 달러를 수취하고, 임상·허가 및 매출에 따른 단계별 마일스톤으로 5억3750만 달러를 추가로 수령하는 조건이다.브레인트리 래보라토리스는 2022년 4월 케이캡의 임상1상시험을 완료했고 2022년 10월 미국 임상3상시험을 시작했다. 케이캡의 미국 임상시험은 ▲미란성 위식도역류질환 치료 및 치료효과 유지 ▲비미란성 위식도역류질환에 대해 테고프라잔과 PPI계열 간 유효성 및 안전성을 비교하는 2건이 진행 중이다. 비미란성식도염의 임상3상시험이 완료됐고, 미란성식도염 임상3상시험이 진행 중이다.케이캡은 미국과 중국을 포함한 45개국에 기술 수출이 완료됐고 케이캡은 수출 계약 이후 현지 허가 절차를 거쳐 중국, 필리핀, 몽골, 멕시코, 인도네시아, 싱가포르, 페루, 칠레, 콜롬비아 등 해외 9개국에 출시됐다.이미 케이캡은 국내 시장에서 상업성을 입증했다. 케이캡은 지난해 3분기 누계 처방실적이 1422억원을 기록했다. 케이캡은 기존 프로톤펌프억제제(PPI) 계열 제품보다 약효가 빠르게 나타나고, 식사 전후 상관 없이 복용이 가능한 점 등 장점을 앞세워 높은 성장세를 지속하고 있다. 케이캡은 출시 3년째인 2021년 처방액 1000억원을 돌파했고 지난해까지 4년 연속 1000억원을 넘어섰다.HLB의 항암신약 리보세라닙도 올해 미국 허가가 기대되는 약물이다. 리보세라닙은 종양 내 신생혈관 형성에 관여하는 혈관내피세포성장인자수용체2(VEGFR2) 억제제 계열 표적항암제다.HLB는 리보세라닙·캄렐리주맙 병용요법을 간암 1차 치료제로 FDA 품목허가(NDA)를 신청했지만 지난해 5월 보완요구서한(CRL)을 수령했다. CRL은 지적 사항을 보완해 다시 NDA를 다시 제출하라는 통지서다.HLB가 지목한 CRL 수령 원인은 캄렐리주맙 제조공정(CMC)과 바이오리서치 모니터링(BIMO) 실사 관련 문제다.FDA는 지난해 11월 리보세라닙과 캄렐리주맙 병용요법의 다국가 임상 3상을 진행한 임상병원에 대한 BIMO 실사를 진행한 결과 '보완할 사항이 없다'고 판정했다. BIMO는 FDA가 신약 승인 과정에서 임상을 진행한 주요 지역(site)를 확인하는 절차다.지난해 9월 HLB의 파트너사 항서제약이 CMC에 대한 모든 보완 업무를 마치고 간암신약 허가를 위한 재심사 신청서를 제출한 상태다. 리보세라닙·캄렐리주맙 병용요법이 FDA 허가를 받으면 렉라자에 이어 국내개발 항암신약 중 두 번째로 미국 시장에 진출하게 된다.2025-01-06 06:20:22천승현
K-신약, 상업적 성과 쏟아질까...글로벌 경쟁력 시험대[데일리팜=천승현 기자] 올해 국내 제약바이오기업이 개발한 신약이 글로벌 시장에서 상업적 경쟁력을 검증받는다. 유한양행의 항암신약 렉라자가 미국과 유럽 시장 관문을 통과하고 본격적인 판매에 돌입한다. 녹십자의 혈액제제와 휴젤의 보툴리눔독소제제가 미국 시장에서 상업적 성공 가능성을 타진한다. SK바이오팜, 한미약품, 대웅제약 등이 미국에 내놓은 신약 제품들의 성장세도 관전포인트다. HK이노엔의 케이캡은 국내 시장 흥행을 기반으로 미국 시장 진출을 타진한다.유한양행 렉라자 미국·유럽 출격...K-항암신약 첫 글로벌 시장 도전장6일 업계에 따르면 유한양행의 렉라자가 올해 본격적으로 글로벌 시장에서 데뷔전을 치른다. 렉라자는 2021년 1월 국내 개발 31호 신약으로 허가 받은 비소세포폐암 치료제다.렉라자는 지난해 8월 미국 식품의약품국(FDA)의 시판허가를 승인받았다. 렉라자는 존슨앤드존슨의 리브리반트와의 병용요법으로 상피세포성장인자수용체(EGFR) 엑손 19 결실 또는 엑손 21 L858R 치환 변이가 확인된 국소 진행성 또는 전이성 비소세포폐암(NSCLC) 성인 환자의 1차 치료제로 승인받았다.렉라자는 지난해 말 유럽연합 집행위원회(EC) 승인을 받으며 국내개발 항암신약 중 처음으로 미국과 유럽 시장 진출에 성공했다. 렉라자의 미국과 유럽 승인은 MARIPOSA 3상 연구 결과를 기반으로 이뤄졌다. 렉라자·리브라반트 병용요법군은 타그리소군보다 질병 진행과 사망위험을 30% 낮춘 것으로 나타났다. 렉라자·리브라반트 병용요법의 무진행 생존기간(PFS)은 23.7개월로, 오시머티닙의 16.6개월 보다 길었고 반응 지속 기간(DOR)도 25.8개월로 타그리소의 16.8개월보다 9개월 더 길었다. 렉라자의 미국과 유럽시장 허가로 올해부터 현지 의료현장에서 본격적으로 리브리반트와의 병용요법 처방이 시작될 전망이다.렉라자·리브리반트 병용요법은 임상적 유용성을 바탕으로 미국종합암네트워크(NCCN)에 1차 치료제로 권고됐다. NCCN은 암의 진단, 치료, 예후 등에 대한 권고사항을 제공하는 가이드라인이다. 이 기관은 미국 국립암센터, 연구소 등 32개 기관이 연합한 단체로 구성돼 있으며 전 세계 의료진들은 NCCN을 암 진료와 치료에 있어 주요 가이드라인으로 참고하고 있다.렉라자는 해외 진출에 속도를 내면서 추가 기술료도 꾸준히 발생하고 있다. 유한양행은 렉라자의 미국과 유럽 허가로 각각 기술료 6000만달러와 3000만달러를 확보했다.렉라자는 국내 시장에서도 항암신약 매출 신기록을 모두 갈아치울 태세다. 의약품 조사기관 아이큐비아에 따르면 렉라자는 지난해 3분기 누적 매출이 521억원으로 전년동기 164억원보다 3배 이상 늘었다.지난해부터 렉라자의 건강보험 급여 범위가 확대되면서 처방 수요가 수직상승했다. 당초 렉라자는 1, 2세대 상피세포성장인자수용체(EGFR) 티로신키나제억제제(TKI) 투여 후 특정 유전자(T790M) 내성이 생긴 국소진행성 또는 전이성 비소세포폐암의 2차치료제로 허가받았다. 지난해부터 렉라자는 ‘특정 유전자 변이가 있는 국소 진행성 또는 전이성 비소세포폐암 1차 치료’로 급여 범위가 확대됐다. 렉라자는 국내개발 항암신약 중 처음으로 분기 매출 100억원을 넘어섰다. 렉라자 이전에 허가 받은 국내 개발 항암신약 중 연 매출 100억원을 넘어선 제품도 없다.녹십자 알리글로 미국 시장 본격 판매...안정적 원료 공급처 확보녹십자의 혈액제제 알리글로가 미국 시장에서 상업성 검증에 나선다. 녹십자는 2023년 12월 FDA로부터 혈액제제 알리글로의 품목 허가를 획득했다. 알리글로는 혈장분획으로부터 정제된 액상형 면역글로불린제제다. 선천성 면역결핍증, 면역성 혈소판감소증과 같은 1차성 면역결핍 질환 치료에 사용된다. 알리글로는 국내 기업이 개발한 혈액제제 중 처음으로 미국 시장에 진출했다.녹십자는 지난해 7월 혈액제제 알리글로의 초도 물량을 선적 완료했다. 알리글로는 정맥주사용 면역글로불린(IVIG)로 신속히 투여가 가능하다는 장점이 있다. 냉장 보관이 필요한 다른 IVIG 약물과 달리 상온 보관이 가능해 유통과 보관이 편리하며 유통 중 변질 위험이 적다는 평가다.미국에서는 면역글로불린제제가 100개 이상의 적응증에 허가범위 초과사용(오프라벨)으로 처방되고 있어 알리글로가 추가 적응증 확장 없이도 다양한 질환에 오프라벨로 처방될 것으로 전망된다.녹십자는 작년 7월 알리글로의 초도 물량을 선적 완료하며 본격적인 판매에 나섰다. 지난해 3분기 녹십자 혈액제제의 매출은 1522억원으로 전 분기 906억원과 비교하면 1분기 만에 68.0% 확대됐다 알리글로의 미국 매출로 300억원 이상을 올린 것으로 추산된다.녹십자는 최근 대규모 투자를 통해 혈액원을 사들이며 알리글로의 미국 시장 안착을 위한 로드맵을 완성했다. 녹십자는 지난해 12월 1380억원을 들여 ABO홀딩스의 지분 전량을 인수했다. ABO홀딩스는 미국 캘리포니아주에 위치한 회사로 뉴저지, 유타, 캘리포니아 등 3개 지역에 6곳의 혈액원을 운영하고 있다. 녹십자는 지난 2020년 미국 현지에 보유한 혈액원을 매각한지 4년 만에 새로운 혈액원을 사들였다혈액제제는 혈액을 원료로 사용하는 특성상 원료 확보가 쉽지 않다는 어려움이 있는데 녹십자는 ABO홀딩스 인수로 안정적인 혈액 공급처를 확보했다. 녹십자가 ABO홀딩스로부터 공급받은 혈액으로 국내 오창 공장에서 알리글로를 생산해 미국에서 판매하는 방식이다.알리글로의 미국 판매 유통 채널도 빠른 속도로 정비됐다. 녹십자는 미국 면역글로불린 유통 채널의 약 50%를 차지하는 전문약국(Specialty Pharmacy)을 통해 알리글로를 판매한다. 지난해 알리글로는 시그나 헬스케어(Cigna Healthcare), 유나이티드 헬스케어(United Healthcare), 블루크로스 블루실드(Blue Cross Blue Shield) 등 미국 내 주요 보험사 3곳의 처방집에 등재되며 미국 내 사보험 가입자의 80%를 확보했다.알리글로는 익스프레스스크립츠(ESI, Express Scripts) 등 미국 내 3대 처방급여관리업체(PBM, Pharmacy Benefit Manager)를 포함한 6곳의 의약품 구매대행사와의 계약 체결도 완료된 바 있다. 알리글로를 판매를 위한 보험사, PBM, 전문약국, 유통사에 이르는 수직통합채널의 구축이 일단락됐다.동아에스티, 첫 바이오시밀러 미국·유럽 진출...휴젤, 보툴리눔제제 미국 공략올해 동아에스티의 첫 바이오시밀러 이뮬도사가 처음으로 미국과 유럽 시장에 출격한다.동아에스티는 자가면역질환치료제 스텔라라의 바이오시밀러 이뮬도사를 지난해 10월 FDA 허가를 받았고 작년 12월에는 유럽연합 집행위원회(EC)로부터 품목허가를 획득했다. 스텔라라는 얀센이 개발한 인터루킨-12,23 저해제 계열 자가면역질환 치료제다. 염증세포의 활성화를 억제하는 기전을 통해 판상 건선과 건선성 관절염, 크론병 및 궤양성 대장염 등 적응증을 보유하고 있다.이뮬도사는 동아에스티가 개발한 바이오시밀러 제품 중 처음으로 미국과 유럽에 진출했다. 동아에스티는 지난 2011년 바이오시밀러 사업 진출을 선언했다.에스티젠바이오 송도 공장 전경 동아쏘시오홀딩스는 지난 2013년부터 일본 메이지세이카파마와 이뮬도사의 공동 개발을 시작했다. 2020년 7월 효율적인 글로벌 프로젝트 수행을 위해 동아에스티로 개발과 상업화 권리가 이전됐다.동아에스티는 2021년부터 2022년 말까지 미국, 폴란드, 에스토니아 등 9개국에서 총 605명의 환자를 대상으로 이뮬도사의 글로벌 임상 3상시험을 진행했다. 임상시험 결과 이뮬도사는 미국 식품의약품국(FDA)과 유럽 의약품청(EMA) 품목허가를 위한 유효성과 안전성에 대해 스텔라라와 동등성을 확인했다.이뮬도사의 글로벌 상업화는 인타스의 자회사 어코드 헬스케어가 담당한다. 동아에스티는 2021년 7월 다국적 제약사 인타스와 이뮬도사의 기술수출 계약을 체결했다. 인타스는 한국과 일본, 일부 아시아 국가를 제외한 글로벌 지역의 허가와 판매에 관한 독점 권리를 확보했다. 인타스는 85개국 이상의 글로벌 판매망을 갖춘 인도의 다국적 제약사다.휴젤의 보툴리눔독소제제 레티보가 미국 시장 판매를 시작한다. 휴젤은 지난해 3월 FDA로부터 레티보의 품목허가를 승인받았다. 적응증은 '중등증~중증의 미간주름 개선'이다. 레티보는 대웅제약 나보타에 이어 국내 개발 보툴리눔독소제제 중 미국 시장에 두 번째 진출했다.휴젤은 지난해 7월 레티보 미국 초도 물량을 선적했다.당초 휴젤은 2022년 10월 레티보의 품목허가를 신청했지만 2023년 4월 보완요구서한을 받았다. 휴젤은 공정설비와 일부 데이터 등에 대한 보완 작업을 완료하고 2023년 9월 허가 신청서를 제출했고 지난해 최종 승인을 획득했다.휴젤은 현지법인인 '휴젤아메리카(HUGEL AMERICA)'를 통해 세계 최대 보툴리눔톡신 시장을 공략한다는 계획을 세웠다. 휴젤은 지난 2018년 8월 미국 시장 진출을 위해 휴젤아메리카를 설립했다. 휴젤의 글로벌 파트너사인 크로마파마(CROMA-PHARMA)의 미국 자회사 크로마USA와 합작회사를 설립했다. 이어 지난해 크로마 측 잔여주식을 취득하며 100% 자회사로 전환했다.레티보는 지적재산권 침해 문제에서 벗어나며 미국 판매 걸림돌을 해소한 상태다. 메디톡스는 2022년 3월 미국 ITC에 휴젤의 보툴리눔톡신 레티보가 자사 영업비밀과 균주를 도용했다며 휴젤과 휴젤아메리카, 크로마파마를 상대로 소송을 제기했다. 지난해 10월 미국 국제무역위원회(ITC)는 레티보가 지적재산권 침해 사실이 없다는 취지로 관세법 337조를 위반한 사례가 없다고 심결했다.SK바이오팜·한미약품·대웅제약, 미국 판매 신약 고공행진 기대감SK바이오팜, 한미약품, 대웅제약 등이 미국 시장에 내놓은 신약의 매출 성장도 기대되는 R&D 성과다.SK바이오팜이 미국 현지에서 독자적으로 판매 중인 뇌전증 신약 세노바메이트가 급성장하고 있다. 세노바메이트는 부분발작 증상을 보이는 성인 뇌전증 환자에게 처방되는 제품으로 SK바이오팜이 초기 개발부터 미국식품의약국(FDA) 허가까지 전 과정을 독자적으로 수행했다. SK바이오팜은 지난 2019년 11월 세노바메이트를 '엑스코프리‘라는 제품명으로 FDA 허가를 받았다. 2020년 5월부터 SK라이프사이언스를 통해 직접 판매하고 있다.분기별 엑스코프리 미국 매출(단위: 억원, 자료: SK바이오팜) 세노바메이트는 국내기업이 개발한 신약 제품 중 미국에서 가장 많은 매출을 기록 중이다.세노바메이트는 2020년 2분기 첫 매출 21억원을 발생한 이후 매 분기 성장세를 지속하고 있다. 지난해 3분기 세노바메이트의 미국 매출은 1133억원으로 전년동기대비 49.7% 늘었다. 세노바메이트는 2020년 미국 시장 진출 이후 매 분기 매출 신기록을 경신하고 있다. 작년 3분기까지 누적 매출은 총 8402억원으로 집계됐다.세노바메이트는 현재 미국외에도 유럽과 캐나다, 아시아, 중남미 지역은 파트너사와의 기술이전 계약을 통해 판매되고 있다. 유럽에서는 파트너사 안젤리니파마가 온투즈리라는 제품명으로 판매하고 있으며 아시아 지역은 임상3상시험이 진행 중이다. SK바이오팜은 지난해 1월 동아에스티와 라이선싱 계약을 체결했다. 동아에스티가 한국, 러시아, 터키, 호주, 남아프리카, 동남아시아 등 30개국에서 세노바메이트의 허가·생산·판매 권리를 확보하는 내용이다. 동아에스티는 SK바이오팜에 계약금 50억원을 지급했다.SK바이오팜은 성인 대상 전신 발작 임상3상, 소아/청소년 대상 부분발작 임상3상을 통해 세노바메이트의 적응증을 확장할 계획이다.한미약품이 개발한 신약 중 처음으로 미국 관문을 통과한 롤론티스도 성장세가 기대된다.롤론티스는 골수억제성 항암화학요법을 적용 받는 암환자에게 호중구감소증 치료 또는 예방 용도로 투여된다. 과립구(granulocyte)를 자극해 호중구 수를 증가시키는 'G-CSF'(과립구집락자극인자) 계열로 암젠의 블록버스터 약물 뉴라스타와 유사한 작용기전을 나타낸다.한미약품은 지난 2012년 스펙트럼에 롤론티스를 기술이전했고 2021년 9월 FDA로부터 롤베돈이라는 제품명으로 허가받았다. 미국 호중구감소증치료제 시장 규모는 연간 3조원에 달한다. 스펙트럼은 지난해 4월 중추신경계·통증·염증 전문 제약사 어썰티오홀딩스에 인수됐다. 롤베돈의 작년 3분기 미국 시장 매출은 1500만 달러(약 210억원)로 전년 동기 대비 87.5% 증가했다. 지난해 3분기 누적 매출은 4460만달러를 기록했다. 롤베돈은 2022년 4분기 미국에 출시된 이후 올린 누적 매출은 총 1억1030만 달러로 집계됐다.대웅제약의 보툴리눔독소제제 나보타의 미국 판매 확장도 전망된다. 미국에서 주보라는 제품명으로 판매 중인 나보타는 국내 개발 의약품 중 엑스코프리에 이어 미국에서 가장 많이 팔리는 제품이다.에볼루스의 작년 3분기 매출은 6110만 달러로 전년 동기 5000만 달러 대비 22.2% 늘었다. 지난해 3분기까지 총 1억8700만달러의 매출로 1년 전보다 32.6% 증가하며 성장세를 지속 중이다. 에볼루스의 매출 대부분은 나보타 판매 실적에서 나온다. 대웅제약은 에볼루스와 지난 2013년 나보타 공급 계약을 맺었고 에볼루스는 2020년 북미 시장에 나보타를 선보였다.나보타의 미국 사용 경험 축적으로 신뢰도가 축적된 데다 2019년부터 진행한 메디톡스와 균주 도용 소송이 종결된 이후 수출 실적이 급증하기 시작했다. 2021년 2월 메디톡스는 나보타(미국 상품명 주보) 미국 판매와 관련해 대웅제약 미국 파트너사 에볼루스, 애브비와 3자 합의 계약을 체결했다. 메디톡스와 애브비는 미국 내에서 주보의 지속적인 판매·유통 권리를 에볼루스에 부여하고 일정 금액의 대가를 받는 내용이 핵심이다.분기별 나보타 매출 추이(단위: 억원, 자료: 대웅제약) 대웅제약은 지난해 3분기 나보타의 매출 475억원을 기록했는데 수출이 차지하는 비중은 84.0%로 집계됐다. 작년 1분기부터 3분기 연속 수출이 80%를 상회하며 해외 판매 비중이 압도적이다.에볼루스는 지난해 6월 스페인에 나보타를 정식 출시하며 유럽 시장 확대도 모색하고 있다. 현재 유럽에서 나보타는 누시바라는 제품명으로 스페인을 비롯해 영국, 독일, 오스트리아, 이탈리아 등에 진출하며 미국에 이어 유럽시장 진출 국가가 지속적으로 확대했다. 나보타는 전 세계 68개 국에서 품목 허가를 획득하고 80여 개국과 파트너십을 체결했다.HK이노엔 케이캡 미국 시장 진출 예고...임상3상 막바지HK이노엔의 위식도역류질환 신약 케이캡은 미국 시장 진출 가능성이 제기된다.HK이노엔은 지난 2021년 12월 미국 제약사 세벨라의 자회사 브레인트리 래보라토리스와 케이캡의 기술수출 계약을 체결했다. 선급금으로 250만 달러를 수취하고, 임상·허가 및 매출에 따른 단계별 마일스톤으로 5억3750만 달러를 추가로 수령하는 조건이다.브레인트리 래보라토리스는 2022년 4월 케이캡의 임상1상시험을 완료했고 2022년 10월 미국 임상3상시험을 시작했다. 케이캡의 미국 임상시험은 ▲미란성 위식도역류질환 치료 및 치료효과 유지 ▲비미란성 위식도역류질환에 대해 테고프라잔과 PPI계열 간 유효성 및 안전성을 비교하는 2건이 진행 중이다. 비미란성식도염의 임상3상시험이 완료됐고, 미란성식도염 임상3상시험이 진행 중이다.케이캡은 미국과 중국을 포함한 45개국에 기술 수출이 완료됐고 케이캡은 수출 계약 이후 현지 허가 절차를 거쳐 중국, 필리핀, 몽골, 멕시코, 인도네시아, 싱가포르, 페루, 칠레, 콜롬비아 등 해외 9개국에 출시됐다.이미 케이캡은 국내 시장에서 상업성을 입증했다. 케이캡은 지난해 3분기 누계 처방실적이 1422억원을 기록했다. 케이캡은 기존 프로톤펌프억제제(PPI) 계열 제품보다 약효가 빠르게 나타나고, 식사 전후 상관 없이 복용이 가능한 점 등 장점을 앞세워 높은 성장세를 지속하고 있다. 케이캡은 출시 3년째인 2021년 처방액 1000억원을 돌파했고 지난해까지 4년 연속 1000억원을 넘어섰다.HLB의 항암신약 리보세라닙도 올해 미국 허가가 기대되는 약물이다. 리보세라닙은 종양 내 신생혈관 형성에 관여하는 혈관내피세포성장인자수용체2(VEGFR2) 억제제 계열 표적항암제다.HLB는 리보세라닙·캄렐리주맙 병용요법을 간암 1차 치료제로 FDA 품목허가(NDA)를 신청했지만 지난해 5월 보완요구서한(CRL)을 수령했다. CRL은 지적 사항을 보완해 다시 NDA를 다시 제출하라는 통지서다.HLB가 지목한 CRL 수령 원인은 캄렐리주맙 제조공정(CMC)과 바이오리서치 모니터링(BIMO) 실사 관련 문제다.FDA는 지난해 11월 리보세라닙과 캄렐리주맙 병용요법의 다국가 임상 3상을 진행한 임상병원에 대한 BIMO 실사를 진행한 결과 '보완할 사항이 없다'고 판정했다. BIMO는 FDA가 신약 승인 과정에서 임상을 진행한 주요 지역(site)를 확인하는 절차다.지난해 9월 HLB의 파트너사 항서제약이 CMC에 대한 모든 보완 업무를 마치고 간암신약 허가를 위한 재심사 신청서를 제출한 상태다. 리보세라닙·캄렐리주맙 병용요법이 FDA 허가를 받으면 렉라자에 이어 국내개발 항암신약 중 두 번째로 미국 시장에 진출하게 된다.2025-01-06 06:20:22천승현 -
![[데스크 시선] 장밋빛 R&D 비전과 발목 잡는 정부](https://pds.dailypharm.com/news_image/202501/319286_1.jpg) [데스크 시선] 장밋빛 R&D 비전과 발목 잡는 정부[데일리팜=천승현 기자] 올해는 국내 제약바이오기업의 연구개발(R&D) 성과가 유난히 기대되는 한해다. 유한양행의 렉라자가 국내개발 항암신약 중 최초로 미국과 유럽 시장에 출격한다. 녹십자가 오랜 기간 공들인 혈액제제가 본격적으로 미국 시장에서 경쟁력을 검증한다. SK바이오팜의 뇌전증신약 엑스코프리가 미국에서 어디까지 성장할지 지켜보는 것도 흥미로운 관전포인트다. 많은 제약바이오기업들이 그동안 축적한 R&D 역량이 글로벌 시장에서 경쟁력 시험대에 오른다.하지만 국내 상황을 돌아보면 기대보단 우려가 더욱 큰 실정이다. 많은 제약바이오기업들이 정부와 사활을 건 법정 다툼을 벌이고 있어서다.지난 몇 년간 제약사들은 다양한 분야에서 정부와 굵직한 행정소송을 펼쳐왔다.뇌기능개선제 콜린알포세레이트(콜린제제)는 효능 논란이 초대형 집단소송으로 이어졌다. 콜린제제의 효능 검증을 위한 임상재평가가 시작되자 돌연 보건당국은 제약사들과 '임상시험에 실패할 경우 처방액을 반환하라‘는 내용의 환수협상을 체결했다. 제약사들은 "적법한 절차를 거쳐 허가받고 판매 중인데도 임상재평가 실패시 처방액을 환수하는 것은 부당하다"라고 맞섰다.결국 제약사들은 콜린제제의 재평가 임상 실패로 적응증이 삭제되면 임상시험 계획서를 승인받은 날부터 삭제일까지 처방액의 20%를 건보공단에 돌려주겠다고 합의했다. 제약사들은 콜린제제의 환수협상 명령을 두고 총 5건의 집단 소송을 펼치고 있는데 임상시험과 소송 모두 고배를 들면 최악의 경우 수천억원 규모의 청구서를 받아들고 또 다시 대형 법정다툼으로 이어질 가능성이 크다.국내 보툴리눔독소제제 기업들은 절반 이상이 정부와 허가취소 처분에 대한 행정처분을 진행 중이다. 국내 제약바이오기업 7곳의 보툴리눔독소제제 16개 품목이 허가취소 처분이 예고됐다. 메디톡스, 휴젤, 파마리서치바이오, 제테마, 한국비엠아이, 한국비엔씨, 휴온스바이오파마 등 7개 업체가 보툴리눔독소제제의 허가취소 처분 등이 예고됐다. 대다수 제품들은 국가출하승인을 받지 않고 판매한 혐의로 허가취소 처분이 결정됐다.허가 취소가 예고된 보툴리눔독소제제 16개 제품의 작년 생산실적은 3284억원으로 국내 기업들의 전체 생산실적의 57.0%를 차지한다. 보툴리눔독소제제 업체들은 최근 식약처의 행정처분에 대한 행정소송에서 연승을 이어가며 식약처의 처분 부당성이 짙어지고 있지만 판결이 뒤집히면 치명적인 손실이 불가피한 상황이다.최근에는 ‘제조·품질관리기준(GMP) 원스트라이크 아웃’으로 소송전이 제약업계의 큰 이슈로 부상했다. 이 규제는 GMP 적합판정을 거짓·부정하게 받거나 반복적으로 의약품 제조·품질관리에 관한 기록을 거짓으로 작성해 판매한 사실이 적발된 경우 GMP 적합판정을 취소하는 강력한 처분이다. 지난해 처분 대상이 속속 등장하면서 이 규제를 둘러싼 논란이 확대됐다.제약사들은 GMP 적합판정 취소 처분 수위가 과도하다는 불만을 제기한다. 일부 제품의 위반 행위로 공장 전체를 문 닫게 하는 것은 처분 수위가 지나치게 강력하다는 이유에서다. 특정 업체의 행정처분이 위수탁 관례를 맺은 다른 업체에도 불똥이 튈 수 있다는 우려도 확산했다. 만약 제약사들이 GMP 적합판정 취소 처분에서 패소하면 국내 제약업계 전반으로 혼선이 확산할 수 있다는 우려가 나오는 실정이다.물론 기업이 잘못을 했으면 합당한 수준의 처분을 받는 것이 당연하다. 하지만 최근 정부의 일부 행정처분은 처분 결정 과정에서 꼼꼼하게 설계하고 결정했는지 의문이 들 때가 많다. 행정처분이 산업에 미치는 파장을 전혀 예측하지 못할 정도로 전문성이 결여된다는 눈초리도 많이 받는다.제약사들이 행정소송에서 승소하더라도 막대한 손실을 회피할 뿐 상처는 불가피하다. 제약사가 지난해 승소한 불순물 소송이 대표적이다.지난 2019년 10월 국민건강보험공단은 제약사들을 대상으로 구상금을 납부할 것을 요구했다. 불순물 발사르탄 파동 이후 환자들에게 기존 처방 중 잔여기간에 대해 교환해주면서 투입된 금액을 제약사들로부터 돌려받겠다는 후속 조치다. 제약사들은 “발사르탄 손해배상에 대한 책임이 없어 구상금 지급채무는 존재하지 않는다”는 취지로 건보공단을 상대로 채무부존재 소송을 제기했다. 1심에서 제약사 패소 판결이 나왔지만 2심부터 반전이 일어났다.서울고등법원은 건보공단이 소송 참여 업체들이 부담한 구상금 15억원 중 11개 업체의 2억원에 대해서만 채무 이행 의무가 있다며 1심 판결을 뒤집었다. 이어 대법원은 2심 판결을 확정했다. 재판부는 제약사들은 식약처의 판매중지 조치 이후 해당 의약품을 판매하지 않았기 때문에 건보공단에 손해배상 의무가 없다고 결론 내렸다. 재판부는 불순물 발사르탄 의약품의 결함은 인정하면서도 건보공단에 손해배상 책임은 없다고 봤다.이미 제약사들은 발사르탄제제 판매금지 이후 적잖은 손실을 감수했다. 여기에 5년에 걸친 소송을 겪으면서 최종 승소에도 불구하고 적잖은 내상을 입었다. 결과적으로 안 해도 되는 정책으로 정부와 제약사들은 지난 5년 동안 적잖은 시간만 낭비했지만 보건당국은 단 한번도 반성의 메시지를 내지 않았다.물론 정부의 모든 정책이 원했던 결과로 도출될 수는 없다. 다만 결과적으로 잘못된 정책이라는 판단이 나왔으면 그에 타당한 반성도 수반돼야 한다. 과거 잘못된 정책에 대해서는 분명히 책임을 따져야 한다. 정부는 늘 습관처럼 제약바이오산업 육성이라는 단어를 외친다. 제약바이오산업이 미래 성장동력이라는 구호도 익숙해진지 오래다.제약바이오기업 입장에선 산업 육성 의지를 크게 기대하지 않는 게 현실이다. 제약바이오산업 육성에 정부가 팔 걷어붙이는건 바라지도 않는다. 합리적인 규제 운영으로 납득할만한 정책만 펼쳐주기만을 바랄 뿐이다. 불합리한 규제로 기업 활동의 발목을 잡는 정부라면 산업 육성을 외칠 자격도 없다.2025-01-06 06:16:46천승현
[데스크 시선] 장밋빛 R&D 비전과 발목 잡는 정부[데일리팜=천승현 기자] 올해는 국내 제약바이오기업의 연구개발(R&D) 성과가 유난히 기대되는 한해다. 유한양행의 렉라자가 국내개발 항암신약 중 최초로 미국과 유럽 시장에 출격한다. 녹십자가 오랜 기간 공들인 혈액제제가 본격적으로 미국 시장에서 경쟁력을 검증한다. SK바이오팜의 뇌전증신약 엑스코프리가 미국에서 어디까지 성장할지 지켜보는 것도 흥미로운 관전포인트다. 많은 제약바이오기업들이 그동안 축적한 R&D 역량이 글로벌 시장에서 경쟁력 시험대에 오른다.하지만 국내 상황을 돌아보면 기대보단 우려가 더욱 큰 실정이다. 많은 제약바이오기업들이 정부와 사활을 건 법정 다툼을 벌이고 있어서다.지난 몇 년간 제약사들은 다양한 분야에서 정부와 굵직한 행정소송을 펼쳐왔다.뇌기능개선제 콜린알포세레이트(콜린제제)는 효능 논란이 초대형 집단소송으로 이어졌다. 콜린제제의 효능 검증을 위한 임상재평가가 시작되자 돌연 보건당국은 제약사들과 '임상시험에 실패할 경우 처방액을 반환하라‘는 내용의 환수협상을 체결했다. 제약사들은 "적법한 절차를 거쳐 허가받고 판매 중인데도 임상재평가 실패시 처방액을 환수하는 것은 부당하다"라고 맞섰다.결국 제약사들은 콜린제제의 재평가 임상 실패로 적응증이 삭제되면 임상시험 계획서를 승인받은 날부터 삭제일까지 처방액의 20%를 건보공단에 돌려주겠다고 합의했다. 제약사들은 콜린제제의 환수협상 명령을 두고 총 5건의 집단 소송을 펼치고 있는데 임상시험과 소송 모두 고배를 들면 최악의 경우 수천억원 규모의 청구서를 받아들고 또 다시 대형 법정다툼으로 이어질 가능성이 크다.국내 보툴리눔독소제제 기업들은 절반 이상이 정부와 허가취소 처분에 대한 행정처분을 진행 중이다. 국내 제약바이오기업 7곳의 보툴리눔독소제제 16개 품목이 허가취소 처분이 예고됐다. 메디톡스, 휴젤, 파마리서치바이오, 제테마, 한국비엠아이, 한국비엔씨, 휴온스바이오파마 등 7개 업체가 보툴리눔독소제제의 허가취소 처분 등이 예고됐다. 대다수 제품들은 국가출하승인을 받지 않고 판매한 혐의로 허가취소 처분이 결정됐다.허가 취소가 예고된 보툴리눔독소제제 16개 제품의 작년 생산실적은 3284억원으로 국내 기업들의 전체 생산실적의 57.0%를 차지한다. 보툴리눔독소제제 업체들은 최근 식약처의 행정처분에 대한 행정소송에서 연승을 이어가며 식약처의 처분 부당성이 짙어지고 있지만 판결이 뒤집히면 치명적인 손실이 불가피한 상황이다.최근에는 ‘제조·품질관리기준(GMP) 원스트라이크 아웃’으로 소송전이 제약업계의 큰 이슈로 부상했다. 이 규제는 GMP 적합판정을 거짓·부정하게 받거나 반복적으로 의약품 제조·품질관리에 관한 기록을 거짓으로 작성해 판매한 사실이 적발된 경우 GMP 적합판정을 취소하는 강력한 처분이다. 지난해 처분 대상이 속속 등장하면서 이 규제를 둘러싼 논란이 확대됐다.제약사들은 GMP 적합판정 취소 처분 수위가 과도하다는 불만을 제기한다. 일부 제품의 위반 행위로 공장 전체를 문 닫게 하는 것은 처분 수위가 지나치게 강력하다는 이유에서다. 특정 업체의 행정처분이 위수탁 관례를 맺은 다른 업체에도 불똥이 튈 수 있다는 우려도 확산했다. 만약 제약사들이 GMP 적합판정 취소 처분에서 패소하면 국내 제약업계 전반으로 혼선이 확산할 수 있다는 우려가 나오는 실정이다.물론 기업이 잘못을 했으면 합당한 수준의 처분을 받는 것이 당연하다. 하지만 최근 정부의 일부 행정처분은 처분 결정 과정에서 꼼꼼하게 설계하고 결정했는지 의문이 들 때가 많다. 행정처분이 산업에 미치는 파장을 전혀 예측하지 못할 정도로 전문성이 결여된다는 눈초리도 많이 받는다.제약사들이 행정소송에서 승소하더라도 막대한 손실을 회피할 뿐 상처는 불가피하다. 제약사가 지난해 승소한 불순물 소송이 대표적이다.지난 2019년 10월 국민건강보험공단은 제약사들을 대상으로 구상금을 납부할 것을 요구했다. 불순물 발사르탄 파동 이후 환자들에게 기존 처방 중 잔여기간에 대해 교환해주면서 투입된 금액을 제약사들로부터 돌려받겠다는 후속 조치다. 제약사들은 “발사르탄 손해배상에 대한 책임이 없어 구상금 지급채무는 존재하지 않는다”는 취지로 건보공단을 상대로 채무부존재 소송을 제기했다. 1심에서 제약사 패소 판결이 나왔지만 2심부터 반전이 일어났다.서울고등법원은 건보공단이 소송 참여 업체들이 부담한 구상금 15억원 중 11개 업체의 2억원에 대해서만 채무 이행 의무가 있다며 1심 판결을 뒤집었다. 이어 대법원은 2심 판결을 확정했다. 재판부는 제약사들은 식약처의 판매중지 조치 이후 해당 의약품을 판매하지 않았기 때문에 건보공단에 손해배상 의무가 없다고 결론 내렸다. 재판부는 불순물 발사르탄 의약품의 결함은 인정하면서도 건보공단에 손해배상 책임은 없다고 봤다.이미 제약사들은 발사르탄제제 판매금지 이후 적잖은 손실을 감수했다. 여기에 5년에 걸친 소송을 겪으면서 최종 승소에도 불구하고 적잖은 내상을 입었다. 결과적으로 안 해도 되는 정책으로 정부와 제약사들은 지난 5년 동안 적잖은 시간만 낭비했지만 보건당국은 단 한번도 반성의 메시지를 내지 않았다.물론 정부의 모든 정책이 원했던 결과로 도출될 수는 없다. 다만 결과적으로 잘못된 정책이라는 판단이 나왔으면 그에 타당한 반성도 수반돼야 한다. 과거 잘못된 정책에 대해서는 분명히 책임을 따져야 한다. 정부는 늘 습관처럼 제약바이오산업 육성이라는 단어를 외친다. 제약바이오산업이 미래 성장동력이라는 구호도 익숙해진지 오래다.제약바이오기업 입장에선 산업 육성 의지를 크게 기대하지 않는 게 현실이다. 제약바이오산업 육성에 정부가 팔 걷어붙이는건 바라지도 않는다. 합리적인 규제 운영으로 납득할만한 정책만 펼쳐주기만을 바랄 뿐이다. 불합리한 규제로 기업 활동의 발목을 잡는 정부라면 산업 육성을 외칠 자격도 없다.2025-01-06 06:16:46천승현
오늘의 TOP 10
- 1상장 바이오 추정 순이익 '껑충'...비교군 한미약품 '최다'
- 2고환율에 복잡한 약가인하...사업계획 엄두 못내는 제약사들
- 3완강한 약무정책과장..."플랫폼 도매 허용 동의 힘들어"
- 4"근무약사 연봉 1억"...창고형약국, 파격 급여 제시
- 5플랫폼 도매금지법 간담회, 편파운영 논란…"복지부 협박하나"
- 6'마운자로', 당뇨병 급여 적정성 확인…약가협상 시험대
- 7"웰컴"...K-약국, 해외관광객 소비건수 1년새 67% 증가
- 8[2025 결산] 급여재평가 희비...건보재정 적자터널 진입
- 9위더스, 장기지속형 탈모 주사제 공장 재조명…주가 급등
- 10사노피 '듀피젠트', 아토피피부염 넘어 천식 공략 눈앞
-
상품명최고최저평균
-
케토톱플라스타(34매)13,00013,00013,000
-
게보린(10정)4,0003,0003,620
-
노스카나겔(20g)22,00018,00020,703
-
베나치오에프액(75ml)1,0008001,000
-
비코그린에스(20정)5,0004,0004,417













![[리쥬올]리쥬올 PDRN 약국 1위 PDRN](https://cdn.platpharm.co.kr/2025/09/2509260220180000170.webp)
![[리쥬올]레티노 멜라세럼 저자극 레티놀](https://cdn.platpharm.co.kr/2025/09/2509260219360000145.webp)
![[SK케미칼] 트라스트패취 피록시캄 성분](https://cdn.platpharm.co.kr/2025/10/2510020656150002375.webp)
![[유한양행] 콘택콜드 걸렸구나 생각되면](https://cdn.platpharm.co.kr/2025/10/2510282252420008436.webp)
![[유한양행] 미녹펜겔 탈모스팟 집중케어](https://cdn.platpharm.co.kr/2025/09/2509220824180004563.webp)
![[종근당] 벤포벨에스 어른들의 피로회복제](https://cdn.platpharm.co.kr/2025/07/2507290841210004645.webp)
