총 1,275건
-
 GIFT 지정된 PBC 새로운 치료제 '셀라델파'리브델지(LivdelziⓇ, 성분명: 셀라델파, Seladelpar, Gilead Sciences)는 PPAR-δ(peroxisome proliferator-activated receptor-δ) 작용제로 2024년 미국 FDA, 2025년 유럽 EMA에서 우르소데옥시콜산(Ursodeoxycholic acid, UDCA)에 불내성이 있거나 기존 치료에 충분히 반응하지 않는 원발성 담즙성 담관염(Primary Biliary Cholangitis, PBC) 환자를 대상으로 가속 승인(accelerated approval)을 받았다.국내에서는 2025년 6월, ‘우르소데옥시콜산에 대한 반응이 부적절하거나 불내성인 성인의 원발성 담즙성 담관염(PBC) 치료제’로 글로벌 혁신제품 신속심사(GIFT, Global Innovative products on Fast Track) 대상에 지정됐다.PBC는 간 내 담관의 만성 염증과 파괴로 인해 담즙 정체 및 진행성 간 손상을 유발하며, 궁극적으로 간경변증과 간부전으로 이어질 수 있는 희귀 난치성 자가면역 질환이다. 현재 우르소데옥시콜산(UDCA)이 1차 치료제로 사용되고 있으나, 일부 환자에서는 치료 반응이 불충분하거나 내약성 문제로 인해 새로운 치료 전략에 대한 미충족 의료 수요가 지속적으로 제기돼 왔다.셀라델파는 과산화소체 증식 활성화 수용체(peroxisome proliferator-activated receptor, PPAR) 델타(PPAR-δ)를 선택적으로 활성화하는 경구 치료제로, PBC 환자에서 담즙 정체와 관련된 간 효소 수치(특히 ALP)를 개선하고 가려움증 완화를 목표로 한다.이 약제의 가속 승인은 3상 임상시험인 RESPONSE 연구 결과를 근거로 이뤄졌다. RESPONSE 연구는 12개월간 진행된 이중눈가림, 무작위배정, 위약 대조 임상시험으로, UDCA 치료에 반응하지 않거나 심각한 이상반응으로 치료 지속이 어려웠던 193명의 PBC 환자가 등록되었다. 대상자는 셀라델파 10mg 경구 투여군 또는 위약군으로 무작위 배정되어, 12개월 동안 하루 1회 투여를 받았다.1차 평가변수는 12개월 시점의 복합 생화학적 반응(composite biochemical response)이었다. 주요 2차 평가변수로는 알칼리성 인산분해효소(alkaline phosphatase, ALP)의 정상화 여부와, 6개월 시점에서 기저치 대비 가려움증 수치 평가 척도(pruritus numerical rating scale, NRS) 점수 변화가 포함되었다. ALP는 담즙 정체를 반영하는 대표적 지표로, 간이식 및 사망 위험을 예측하는 인자로 알려져 있다.연구 결과, 셀라델파 투여군의 62%가 12개월 차에 1차 평가변수인 복합 생화학적 반응(ALP 및 총 빌리루빈 수치 개선)에 도달해, 위약군의 20% 대비 통계적으로 유의미한 우월성을 입증하였다. 특히 셀라델파 투여군의 25%에서는 ALP 수치가 정상화되는 유의한 결과가 관찰되었다.주요 2차 평가변수였던 가려움증 개선에서도 셀라델파의 효과가 확인되었다. 연구 시작 시점 대비 6개월 차에 중등도–중증 가려움증을 호소하던 환자군에서, 셀라델파 치료군은 평균 3.2점의 가려움증 점수 감소를 보였으며, 이는 위약군의 1.7점 감소 대비 통계적으로 유의미한 개선 효과였다.이와 같이 RESPONSE 연구에서 셀라델파는 단독요법 또는 UDCA 병용요법으로 하루 1회 경구 투여 시, PBC의 주요 생화학적 지표를 개선하고 가려움증 완화에 기여하는 것으로 나타났다. 가장 흔하게 보고된 이상반응은 두통, 복통 및 복부 팽만, 오심, 어지럼증이었다.담즙산 대사 장애(Bile acid metabolism disorder)란 무엇인가?담즙산(bile acid)은 간에서 합성되는 콜레스테롤 유도체로, 양친매성 계면활성제이자 전신 내분비 호르몬으로 작용한다. 담즙산은 자체 합성과 장–간 순환을 조절할 뿐 아니라, 지질·탄수화물·단백질 등 다량 영양소 대사와 전신 염증–항염증 균형을 강력하게 조절하는 역할을 한다.담즙산 대사 장애는 담즙산의 합성, 변환, 수송, 분비 또는 재흡수 과정 중 하나 이상에 이상이 발생해 담즙산 항상성이 붕괴된 상태를 의미한다. 정상적으로 담즙산은 간에서 콜레스테롤로부터 합성된 후 담관을 통해 담즙으로 분비되며, 장 내에서 지방의 소화와 흡수를 돕는다. 이후 회장 말단에서 대부분 재흡수되어 다시 간으로 돌아오는 장–간 순환(enterohepatic circulation)을 유지한다.그러나 이러한 조절 과정에 이상이 발생하면 간 내 담즙산이 과도하게 축적되거나 담즙 배출이 저해되어 담즙정체(cholestasis)가 발생한다. 그 결과 간세포 및 담관 세포의 손상, 염증 반응, 산화 스트레스 증가, 섬유화가 유발될 수 있다.담즙산 대사 장애는 담즙산 합성의 과도한 증가 또는 감소, 담즙산 수송체 기능 이상, 담즙 분비 장애, 장–간 순환 이상 등 다양한 기전에 의해 발생하며, 이러한 변화는 단독 또는 복합적으로 나타날 수 있다. 임상적으로는 간효소 수치 이상, 황달, 소양감, 지방 흡수 장애 등의 증상이 동반되며, 장기적으로는 만성 간질환으로 진행할 수 있다.이러한 담즙산 대사 장애는 여러 간·담도 질환의 핵심적인 병태생리로 작용한다. 원발성 담즙성 담관염(primary biliary cholangitis, PBC)은 자가면역 기전에 의해 간 내 소담관이 점진적으로 파괴되면서 담즙 배출이 저해되는 질환으로, 담즙산 축적과 담즙정체가 질환의 중심 병태생리를 이룬다.원발성 경화성 담관염(Primary sclerosing cholangitis, PSC) 역시 담관의 만성 염증과 섬유화로 인해 담즙 흐름이 차단되며, 진행성 담즙정체와 담즙산 대사 장애가 특징적으로 나타난다. 또한 진행성 가족성 간내 담즙정체(progressive familial intrahepatic cholestasis, PFIC)는 담즙산 수송체 관련 유전자의 이상으로 발생하는 선천성 질환으로, 소아기부터 중증의 담즙산 대사 장애와 간 손상을 초래한다.이 외에도 담즙산 수송체나 담즙 분비 경로를 억제하는 특정 약물로 인한 약물 유발 담즙정체, 임신 중 호르몬 변화와 연관된 임신성 담즙정체, 담석이나 종양에 의한 담도 폐쇄, 비알코올성 지방간질환과 같은 대사성 간질환에서도 이차적으로 담즙산 대사 장애가 동반될 수 있다. 이처럼 담즙산 대사 장애는 단순한 담즙 분비 이상을 넘어, 다양한 간질환의 발생과 진행에 깊이 관여하는 핵심 병태생리로 인식되고 있다.원발성 담즙성 담관염(Primary Biliary Cholangitis, PBC)란 무엇인가?원발성 담즙성 담관염(Primary Biliary Cholangitis, PBC)은 담관에 만성 염증이 발생해 소구경 담관이 점진적으로 파괴되는 자가면역 질환이다. 과거에는 원발성 담즙성 간경변증(Primary Biliary Cirrhosis)으로 불렸으나, 질환의 초기 및 중기 단계에서는 간경변이 동반되지 않는 경우가 많아 현재는 원발성 담즙성 담관염이라는 명칭이 공식적으로 사용되고 있다.담즙은 간에서 생성되는 액체로, 지방의 소화와 지용성 비타민의 흡수를 돕고 콜레스테롤, 독소, 노화된 적혈구의 대사산물을 배출하는 역할을 한다. 간에 지속적인 염증이 발생하면 담관의 염증과 손상, 즉 담관염이 나타나며, 질환이 진행될 경우 간 조직에 영구적인 섬유화가 형성되어 간경변으로 이어질 수 있다. 심한 경우에는 간부전으로 진행하기도 한다(Figure 1).Figure 1. Primary Biliary Cholangitis(PBC)(출처: https://www.narayanahealth.org/blog/primary-biliary-cholangitis-causes-symptoms-diagnosis-and-treatment-options).PBC는 남녀 모두에서 발생할 수 있으나 여성에서 더 흔하게 나타난다. 자가면역 질환의 하나로, 면역 체계가 정상적인 담관 상피세포를 비정상적으로 공격하는 것이 특징이다. 현재까지의 연구에 따르면 유전적 소인과 환경적 요인이 복합적으로 작용해 발병하는 것으로 알려져 있다. 질환은 대체로 서서히 진행되며, 완치할 수 있는 치료법은 아직 없으나 조기에 진단하고 치료를 시작하면 약물 치료를 통해 간 손상의 진행 속도를 효과적으로 늦출 수 있다.PBC는 조기에 적절한 치료가 이루어지지 않을 경우 간경변 및 간부전으로 진행할 수 있다. 임상적으로는 알칼리성 인산분해효소(alkaline phosphatase, ALP)와 감마-글루타밀 전이효소(γ-glutamyl transferase, GGT)를 포함한 담즙정체성 간효소의 지속적인 상승과, 항미토콘드리아 항체(antimitochondrial antibody, AMA) 또는 PBC 특이 항핵항체인 anti-sp100 및 anti-gp210의 검출이 특징적이다.ALP와 GGT는 모두 담즙정체성 간질환에서 상승하는 혈청 효소로, 간·담도계 손상을 평가하는 데 널리 사용된다. 그러나 두 효소는 기원 조직과 생리적 역할, 임상적 활용 측면에서 차이를 보인다.ALP는 간 내 담관 상피세포와 조골세포에 풍부하게 존재하는 효소로, 인산에스터 결합의 가수분해에 관여한다. 담즙정체가 발생하면 담관 압력 상승과 담관 상피세포 손상으로 인해 혈청 ALP 수치가 현저히 증가한다. 이러한 특성으로 인해 ALP는 담즙정체의 정도를 반영하는 대표적인 생화학적 지표로 활용된다. 다만 ALP는 뼈, 태반, 소장 등 다양한 조직에서도 발현되므로, 수치 상승 시 간 유래 여부에 대한 감별이 필요하다.반면 GGT는 세포막에 결합된 효소로, 주로 간세포와 담관 세포의 미소체막에 존재하며 글루타티온 대사와 아미노산 수송에 관여한다. GGT는 뼈 조직에서는 발현되지 않기 때문에, ALP 상승이 간담도계 기원인지 여부를 판단하는 보조 지표로 유용하다. 담즙정체성 간질환에서 GGT 역시 상승하지만, 질환 특이성보다는 간담도계 침범의 존재를 확인하는 데 주로 활용된다.임상적으로 ALP와 GGT는 상호 보완적으로 해석된다. 혈청 ALP 상승과 함께 GGT가 동반 상승하는 경우 간담도계 기원의 담즙정체를 강하게 시사하는 반면, ALP만 상승하고 GGT가 정상인 경우에는 뼈 질환 등 비간성 원인을 고려해야 한다. 이러한 이유로 PBC를 포함한 만성 담즙정체성 간질환의 진단 및 치료 반응 평가에서 ALP는 주요 지표로, GGT는 감별 진단을 위한 보조 지표로 활용된다.또한 PBC의 특징적인 조직병리학적 소견인 만성 비화농성 파괴성 담관염(chronic nonsuppurative destructive cholangitis)은 소구경에서 중간구경의 소엽간 담관 상피에 대한 림프구 침윤과 담관 파괴를 특징으로 하며, 이는 궁극적으로 담관 소실(ductopenia)과 담즙정체로 이어진다.PBC에서 가려움증(pruritus)과 피로(fatigue)는 흔히 나타나는 증상이지만 질환 특이적이지 않아 초기에는 질환과의 연관성이 간과되기 쉽다. 그러나 이러한 증상과 더불어 쇼그렌 증후군과 같은 동반 자가면역 질환에서 나타나는 안구 및 구강 건조 증상은 환자의 건강 관련 삶의 질(health-related quality of life, HRQOL)을 현저히 저하시킬 수 있다. 따라서 임상의는 이러한 증상의 임상적 중요성을 인식하고 적극적으로 평가해야 한다.과산화소체 증식자 활성화 수용체-델타(Peroxisome proliferator-activated receptor delta, PPAR-δ)는 무엇인가?과산화소체 증식자 활성화 수용체-델타(peroxisome proliferator-activated receptor-δ, PPAR-δ)는 세포의 대사와 염증 반응을 조절하는 리간드 의존적 핵수용체의 한 아형이다.과산화소체(Peroxisome)는 세포 내에 존재하는 소형 소기관으로, 지방산 분해, 독성 물질 해독, 과산화수소(H₂O₂) 처리 등의 기능을 수행한다. 이러한 작용을 통해 과산화소체는 세포 대사 과정에서 생성되는 유해 물질을 제거하고 지방 대사를 조절하며, 세포의 대사 처리와 항상성 유지에 핵심적인 역할을 한다.과산화소체 증식자(Peroxisome proliferator)는 과산화소체의 수와 기능을 증가시키는 물질을 의미한다. 이들 물질이 세포 내로 유입되면 과산화소체의 형성이 촉진되고 지방산 분해 능력이 향상되며, 대사 관련 효소의 발현이 증가한다. 초기 연구에서는 이러한 물질이 과산화소체 증식을 유도한다는 현상이 관찰되었고, 이후 그 작용이 특정 수용체를 통해 매개된다는 사실이 밝혀졌다.이 수용체가 바로 과산화소체 증식자 활성화 수용체(peroxisome proliferator-activated receptor, PPAR)이다. PPAR는 과산화소체 증식자에 의해 활성화되는 리간드 의존적 핵수용체로, 주로 세포핵 내에서 전사 조절 인자로 기능한다. 간세포, 지방세포, 근육세포, 면역세포 등 다양한 조직에서 발현되며, 아형에 따라 조직 분포와 생리적 기능에 차이를 보인다. 이러한 특성으로 인해 PPAR는 전신 에너지 대사와 염증 반응 조절에 중요한 역할을 수행한다.PPAR는 내인성 지방산 및 지방산 유도체와 같은 생체 내 신호물질이나 합성 리간드와 결합해야 활성화된다. 리간드 결합 후 PPAR는 구조적 변화를 거쳐 활성화되며, 활성화된 PPAR는 retinoid X receptor(RXR)와 이합체(heterodimer)를 형성한다. 이 PPAR–RXR 이합체는 세포핵 내에서 표적 유전자의 프로모터 영역에 존재하는 PPAR response element(PPRE)에 결합해 유전자 전사의 활성 또는 억제를 조절한다(Figure 2).Figure 2. Pattern of PPARα Activity. RXR—Retinoid X Receptor, PPRE—Gene Promoter(출처: Biomolecules 2024, 14, 786).이러한 기전을 통해 PPAR는 지방산 산화, 포도당 대사, 에너지 소비, 염증 반응, 담즙산 대사와 관련된 다양한 유전자들의 발현을 전사 수준에서 조절한다. 특히 내인성 지방산 유도체는 세포의 대사 상태를 반영하는 신호 분자로 작용해 PPAR 활성도를 조절함으로써, 세포가 환경 변화에 적응하도록 돕는다.PPAR는 구조적·기능적 특성에 따라 PPAR-α, PPAR-γ, PPAR-δ(β/δ)의 세 가지 아형으로 구분된다. PPAR-α는 주로 간에서 지방산 β-산화를 촉진해 지질 대사를 조절하며, PPAR-γ는 지방조직에서 지방세포 분화와 인슐린 감수성 조절에 관여한다. 이에 비해 PPAR-δ는 다양한 조직에 광범위하게 발현되며, 에너지 대사 조절과 항염증 반응에 관여할 뿐 아니라 간 내 담즙산 항상성 유지와 담즙정체 관련 경로 조절에도 중요한 역할을 수행하는 것으로 보고되고 있다.최근 연구들에서는 PPAR-δ가 담즙산 합성 및 수송 경로 조절, 간 내 염증 반응 억제, 담관 손상 완화와 연관된 신호전달 경로에 관여함으로써 담즙산 항상성 유지와 담즙정체(cholestasis) 조절에 핵심적인 역할을 한다는 점이 제시되고 있다. 이러한 특성으로 인해 PPAR-δ는 원발성 담즙성 담관염(PBC)과 같은 만성 담즙정체성 간질환에서 유망한 치료 표적으로 주목받고 있다.이러한 생물학적 특성에 근거해, 셀라델파(seladelpar)는 PPAR 아형 중 PPAR-δ에 선택적으로 결합하는 경구용 작용제로 개발되었다. 셀라델파는 PPAR-δ 신호전달 경로를 활성화함으로써 담즙정체와 염증 반응을 조절하고, 간 내 대사 이상을 개선하는 것을 치료 전략의 핵심 기전으로 한다.PPAR(Peroxisome proliferator-activated receptor) 기능 저하의 원인은 무엇인가?PPAR는 정상적인 대사 항상성과 항염증 반응 유지에 중요한 전사 조절 인자이나, 다양한 병리적 조건에서 그 발현이나 활성도가 감소할 수 있다. 이러한 PPAR 기능 저하는 단일 기전에 의해 발생하기보다는, 여러 내·외적 요인이 복합적으로 작용한 결과로 나타난다.첫째, 만성 염증 상태는 PPAR 기능 저하의 주요 원인으로 알려져 있다. 염증성 사이토카인(예: TNF-α, IL-1β, IL-6)은 PPAR 유전자 발현을 억제하거나 PPAR의 전사 활성 능력을 감소시키는 신호전달 경로를 활성화한다. 특히 NF-κB와 같은 염증 신호 경로는 PPAR와 상호 억제 관계를 형성해, 염증이 지속될수록 PPAR의 항염증 기능이 점차 약화되는 악순환을 초래한다.둘째, 리간드 결핍 또는 리간드 환경의 변화 역시 PPAR 기능 저하에 기여한다. PPAR는 내인성 지방산 및 지방산 유도체와 결합해야 활성화되므로, 대사 이상이나 영양 상태 변화로 적절한 리간드 공급이 감소할 경우 PPAR 활성은 저하된다. 또한 산화 스트레스 환경에서는 정상적인 리간드가 변형돼 PPAR 결합 친화도가 감소할 수 있다.셋째, 산화 스트레스와 미토콘드리아 또는 과산화소체 기능 이상은 PPAR 신호 전달을 간접적으로 억제한다. 활성산소의 과도한 축적은 PPAR 단백질의 구조적 안정성을 저해하거나, 전사 공조절인자(coactivator)의 기능을 손상시켜 PPAR 매개 유전자 발현을 감소시킨다.넷째, 후성유전학적(Epigenetic) 조절 변화 역시 중요한 기전으로 제시된다. DNA 메틸화 증가, 히스톤 변형 변화, microRNA에 의한 억제 등은 PPAR 유전자 발현을 장기적으로 감소시킬 수 있으며, 이러한 변화는 만성 간질환이나 대사성 질환에서 흔히 관찰된다.다섯째, 질환 특이적 조직 손상도 PPAR 기능 저하와 밀접하게 연관된다. 예를 들어, 원발성 담즙성 담관염(PBC)과 같은 만성 담즙정체성 간질환에서는 담관 손상과 간세포 스트레스가 지속되며, 이로 인해 PPAR 발현 감소 또는 신호 전달 효율 저하가 동반되는 것으로 보고되고 있다. 이 경우 PPAR 기능 저하는 질환의 직접적인 원인이라기보다는 질병 진행 과정에서 나타나는 이차적 변화로 작용해, 담즙정체와 염증 반응을 더욱 악화시키는 요인이 될 수 있다.원발성 담즙성 담관염(PBC)의 기존 치료약제는 무엇인가?원발성 담즙성 담관염(PBC)의 치료는 질병의 진행을 억제하고 간 기능 악화를 지연시키는 것을 목표로 하며, 오랫동안 제한된 약물 옵션에 의존해 왔다. 현재까지 임상적으로 확립된 치료 전략의 중심에는 우르소데옥시콜산(UDCA)이 있다. UDCA는 모든 PBC 환자에서 1차 표준 치료제로 권고되며, 담즙의 친수성을 증가시켜 독성을 감소시키고 담즙 흐름을 개선함으로써 담관 상피세포 손상을 완화한다.다수의 장기 추적 연구에서 UDCA는 혈청 알칼리성 인산분해효소(ALP)와 빌리루빈 수치를 감소시키고, 간이식 없는 생존율을 향상시키는 것으로 입증되었다. 그러나 전체 환자의 약 30–40%에서는 UDCA 치료에도 불구하고 생화학적 반응이 불충분하거나, 위장관 증상 등의 부작용으로 인해 약물 내약성에 문제가 발생한다.이러한 UDCA 불충분 반응 또는 불내성 환자를 대상으로 개발된 대표적인 2차 치료제가 오베티콜산(obeticholic acid, OCA)이다. OCA는 파네소이드 X 수용체(farnesoid X receptor, FXR) 작용제로, 담즙산 합성을 억제하고 담즙정체를 완화하는 기전을 통해 ALP 감소 효과를 나타낸다. 임상시험에서 OCA는 UDCA 단독요법 대비 추가적인 생화학적 개선 효과를 입증했으며, 이를 근거로 UDCA 불충분 반응 환자에서 승인되었다.그러나 OCA는 소양증을 악화시키는 부작용이 흔하고, 비대상성 간경변 환자에서는 중대한 안전성 문제로 인해 사용이 제한되는 한계를 지닌다. 이러한 점은 실제 임상 현장에서 OCA의 활용을 제약하는 주요 요인으로 작용해 왔다.한편, 공식 허가 적응증은 아니지만 피브레이트 계열 약물이 오프라벨(off-label) 치료로 사용돼 왔다. 대표적으로 베자피브레이트(bezafibrate)와 페노피브레이트(fenofibrate)는 PPAR 계열 수용체를 활성화해 담즙산 대사와 염증 반응을 조절하는 것으로 알려져 있다. 여러 연구에서 UDCA 병용 시 ALP, GGT, 면역글로불린 M(IgM) 감소 효과가 보고됐으며, 일부 관찰 연구에서는 예후 개선 가능성도 제시되었다. 그러나 근육 독성, 신기능 악화 등의 안전성 우려와 함께 장기 임상 근거가 제한적이라는 점에서 표준 치료로 확립되지는 못했다.질병 조절 치료와는 별도로, PBC 환자의 삶의 질에 큰 영향을 미치는 소양증에 대한 대증 치료 역시 중요한 치료 축을 이뤄 왔다. 콜레스티라민(cholestyramine), 리팜피신(rifampicin), 날트렉손(naltrexone), 설트랄린(sertraline) 등은 담즙산 결합이나 신경전달 조절 등의 기전을 통해 소양증 완화에 사용돼 왔으나, 질병의 병태생리를 근본적으로 조절하지는 못한다는 한계를 지닌다.요약하면, PBC의 기존 치료는 UDCA를 중심으로 한 제한적인 치료 전략에 기반해 왔으며, UDCA 불충분 반응 환자에서는 OCA나 피브레이트 계열 약물이 보조적으로 사용돼 왔다. 그러나 이러한 치료제들은 효과의 한계와 안전성 문제를 동시에 안고 있어, 상당수 환자에서 미충족 의료 수요(unmet medical need)가 지속돼 왔다. 이러한 배경 속에서 PPAR 계열을 포함한 새로운 핵수용체 표적 치료제들이 등장하게 되었으며, 이는 기존 치료 패러다임을 보완하거나 대체할 가능성을 제시하고 있다.PPAR(Peroxisome proliferator-activated receptor) 작용제에는 어떤 약제들이 있는가?PPAR-α 작용제로는 페노피브레이트(fenofibrate)와 베자피브레이트(bezafibrate)와 같은 피브레이트 계열 약물이 있으며, 이들은 트리글리세리드(triglyceride, TG)와 유리 지방산(free fatty acid, FFA)을 감소시키고 고밀도 지단백(high-density lipoprotein, HDL) 수치를 증가시켜 이상지질혈증 치료에 사용된다.한편 PPAR-γ 작용제로는 로시글리타존(rosiglitazone)과 피오글리타존(pioglitazone) 등 티아졸리디네디온(thiazolidinedione, glitazone) 계열 약물이 대표적이다. 이들 약물은 인슐린 민감도를 개선하고 혈장 포도당, TG 및 FFA 수치를 감소시키는 동시에 HDL 수치를 증가시켜 제2형 당뇨병 치료에 활용되고 있다.이중 PPAR 작용제(dual PPAR agonists)는 두 가지 이상의 PPAR 아형을 동시에 활성화하도록 설계된 약제로, 주로 PPAR-α/γ 또는 PPAR-α/δ를 표적으로 하여 지질 대사, 에너지 대사 및 염증 반응을 복합적으로 조절하는 것을 목표로 개발돼 왔다. 이러한 약제는 각 PPAR 아형이 담당하는 생리적 기능을 동시에 활용함으로써, 단일 PPAR 작용제에 비해 보다 광범위한 대사 개선 효과를 기대할 수 있다는 이론적 장점을 지닌다. 기전적으로는 지방산 β-산화 촉진, 중성지방 감소, 에너지 소비 증가 및 항염증 효과를 동시에 유도해 전신 대사 항상성 조절에 기여한다.그러나 이중 PPAR 작용제 가운데 미국 FDA 승인을 받은 약제는 아직 제한적인 상황이며, 최근까지 임상적으로 의미 있는 성과를 보인 사례도 많지 않았다. 이러한 가운데 PPAR-α/δ 이중 작용제인 엘라피브라노르(elafibranor)가 원발성 담즙성 담관염(PBC)을 적응증으로 FDA 가속 승인을 받으면서, 이중 PPAR 작용제가 간질환 영역에서도 임상적 가치를 가질 수 있음을 보여주는 사례로 평가되고 있다. 엘라피브라노르는 PPAR-α를 통한 지질 대사 개선 효과와 PPAR-δ를 통한 항염증 및 담즙산 대사 조절 효과를 동시에 유도함으로써, 담즙정체와 간 내 염증을 완화하는 기전을 갖는 것으로 설명된다.반면 선택적 PPAR-δ 작용제는 PPAR 아형 중 PPAR-δ만을 표적으로 활성화하는 약제로, 보다 제한된 신호 경로를 정밀하게 조절하는 전략을 취한다. PPAR-δ는 다양한 조직에 광범위하게 발현되며 에너지 대사 촉진, 지방산 산화 증가, 항염증 반응 조절과 더불어 간 내 담즙산 항상성 유지 및 담즙정체 관련 경로 조절에 관여하는 것으로 알려져 있다. 이러한 특성을 바탕으로 선택적 PPAR-δ 작용제는 불필요한 대사 경로의 과도한 활성화를 최소화하면서 치료 효과를 유도하는 것을 목표로 개발돼 왔다.선택적 PPAR-δ 작용제의 대표적인 예로는 셀라델파(seladelpar)가 있으며, 이는 우르소데옥시콜산(UDCA)에 불충분한 반응을 보이거나 UDCA를 사용할 수 없는 PBC 환자를 대상으로 FDA 가속 승인을 받았다. 셀라델파는 담즙정체의 주요 생화학적 지표인 알칼리성 인산분해효소(ALP)를 감소시키고, 환자의 삶의 질을 저해하는 소양감을 완화하는 효과를 보여 PPAR-δ 선택적 활성화의 임상적 유용성을 입증했다.종합하면, 이중 PPAR 작용제는 두 가지 경로를 동시에 조절함으로써 보다 폭넓은 대사 및 항염증 효과를 기대할 수 있다는 장점을 지니는 반면, 활성화 범위가 넓은 만큼 안전성과 내약성에 대한 면밀한 평가가 요구된다. 이에 비해 선택적 PPAR-δ 작용제는 표적 특이성이 높아 비교적 안전성이 우수하며, 특히 담즙정체성 간질환과 같이 특정 병태생리를 중심으로 한 치료에 적합한 특성을 가진다.결론적으로 FDA 승인 사례를 기준으로 볼 때, 이중 PPAR 작용제는 아직 임상 적용이 제한적인 단계에 있으나 엘라피브라노르의 승인으로 그 가능성이 확장되고 있다. 동시에 선택적 PPAR-δ 작용제는 질환 특이적 기전을 정밀하게 표적하는 전략으로서, 원발성 담즙성 담관염과 같은 만성 담즙정체성 간질환에서 중요한 치료 옵션으로 자리매김하고 있다.셀라델파(Seladelpar)는 어떤 약제인가?원발성 담즙성 담관염(PBC)은 자가면역 기전에 의해 간 내 소담관이 점진적으로 파괴되는 만성 담즙정체성 간질환으로, 이로 인해 담즙 배설 장애, 간 내 담즙산 축적, 염증 반응 및 섬유화가 점차 진행된다. 현재 PBC의 표준 1차 치료는 우르소데옥시콜산(UDCA)이지만, 상당수 환자에서 불충분한 생화학적 반응을 보이거나 약물 불내성이 관찰돼 추가적인 치료 옵션에 대한 필요성이 지속적으로 제기돼 왔다.셀라델파(Seladelpar)는 선택적 PPAR-δ 작용제로, UDCA에 불충분한 반응을 보이는 성인 PBC 환자에서는 UDCA와의 병용요법으로, UDCA를 견딜 수 없는 환자에서는 단독요법으로 사용하도록 적응증이 승인되었다. 이 적응증은 알칼리성 인산분해효소(ALP) 감소를 근거로 승인되었으며, 현재까지 생존율 개선이나 간 대상부전 사건 예방에 대한 효과는 입증되지 않았다. 따라서 해당 적응증의 지속적인 승인은 확인 임상시험을 통해 임상적 유익성이 검증되고 충분히 설명되는 것을 조건으로 한다. 또한 비대상성 간경변, 즉 복수, 정맥류 출혈 또는 간성 뇌병증이 있거나 치료 중 이러한 상태가 발생한 환자에서는 셀라델파의 사용이 권장되지 않는다.임상시험 및 기전 연구에 따르면, 셀라델파는 PBC의 병태생리에 관여하는 여러 경로를 조절함으로써 치료 효과를 나타내는 것으로 보고되고 있다. 특히 셀라델파 투여 시 담즙정체와 관련된 주요 생화학적 지표가 유의하게 개선되며, ALP 감소와 함께 총 빌리루빈을 포함한 담즙정체 지표의 개선이 일관되게 관찰되었다. 이러한 생화학적 반응은 임상적 예후를 반영하는 대리지표(surrogate marker)로 간주돼 규제 당국의 승인 근거로 활용되었다.아울러 셀라델파는 PBC 환자에서 흔히 나타나며 삶의 질을 현저히 저해하는 증상인 소양감(pruritus)을 유의하게 완화시키는 효과를 보였다. 여러 임상 연구에서 셀라델파 투여군은 위약 대비 소양감 점수의 의미 있는 감소를 나타냈으며, 이는 단순한 간수치 개선을 넘어 증상 조절 측면에서도 임상적 가치를 지님을 시사한다.기전적으로 PPAR-δ의 활성화는 항염증 및 면역조절 작용과 더불어 담즙산 대사 경로 조절에 관여하는 것으로 알려져 있다. 선행 연구 및 문헌 고찰에 따르면, PPAR-δ 활성화는 섬유아세포 성장인자 21(fibroblast growth factor 21, FGF21)에 의존적인 방식으로 담즙산 합성의 핵심 효소인 cholesterol 7α-hydroxylase(CYP7A1)를 포함한 관련 경로의 발현을 조절한다. 이를 통해 간 내 담즙산 축적을 완화하고, 담즙정체로 인한 간세포 손상을 감소시키는 것으로 제안된다. 이러한 다면적 작용 기전은 셀라델파가 PBC의 핵심 병태생리인 담즙정체, 염증 반응 및 증상 부담을 동시에 조절할 수 있는 치료제로 주목받는 근거가 된다(Figure 2).Figure 2. Mechanism of Seladelpar(출처: https://www.youtube.com/watch?v=T8yBWcvWD00)셀라델파(LIVDELZIⓇ)의 허가임상은 어떻게 진행되었나?LIVDELZI의 유효성은 12개월 동안 진행된 무작위배정, 이중눈가림, 위약 대조 임상시험인 Trial 1 (NCT04620733)에서 평가되었다. 이 연구에는 우르소데옥시콜산(UDCA)에 대해 반응이 불충분하거나 내약성이 없는 원발성 담즙성 담관염(PBC) 성인 환자 193명이 포함되었다.환자는 알칼리성 인산분해효소(ALP)가 정상 상한치(ULN)의 1.67배 이상이고, 총 빌리루빈(TB)이 ULN의 2배 이하인 경우에만 시험에 포함되었다. 다른 만성 간질환이 있거나, 합병증을 동반한 문맥고혈압을 포함한 임상적으로 중요한 간 대상부전이 있는 경우, 또는 합병증을 동반한 간경변(예: 말기 간질환 평가 점수[Model for End Stage Liver Disease, MELD]가 12 이상이거나, 식도정맥류가 알려져 있거나 정맥류 출혈 병력이 있는 경우, 간신증후군 병력 등)이 있는 환자는 시험에서 제외되었다.환자들은 LIVDELZI 10 mg군(N=128) 또는 위약군(N=65)으로 무작위 배정되어 12개월 동안 1일 1회 투여받았다. 시험 기간 동안 181명(94%)의 환자는 UDCA와 병용하여 LIVDELZI 또는 위약을 투여받았으며, UDCA를 견딜 수 없는 12명(6%)의 환자는 단독요법으로 LIVDELZI 또는 위약을 투여받았다.<기저 인구통계학적 특성 및 임상적 특성>환자들의 평균 연령은 57세(범위: 28~75세)였으며, 95%가 여성이었다. 인종 분포는 백인 88%, 아시아인 6%, 흑인 또는 아프리카계 미국인 2%, 아메리칸 인디언 또는 알래스카 원주민 3%였다. 전체 환자의 29%가 히스패닉/라티노로 확인되었으며, LIVDELZI 10 mg 투여군에서는 23%, 위약군에서는 42%였다. 전체 환자의 32%가 미국에서 등록되었고, LIVDELZI 10 mg군에서는 38%, 위약군에서는 20%였다.기저 시점에서 LIVDELZI 투여 환자 18명(14%)과 위약 투여 환자 9명(14%)가 다음 기준 중 최소 하나를 충족하였다: FibroScan 결과가 16.9 kPa 초과 / 과거 생검 또는 영상의학적 검사에서 간경변을 시사하는 소견 / 혈소판 수가 140,000/μL 미만이면서 혈청 알부민 < 3.5 g/dL, 국제정상화비율(INR) > 1.3, 또는 총 빌리루빈(TB) > ULN의 1배 초과 중 최소 하나의 추가 검사 이상 소견이 있는 경우 / 연구자가 임상적으로 간경변으로 판단한 경우기저 시점의 평균 알칼리성 인산분해효소(ALP) 농도는 리터당 314 단위(U/L)(범위: 161~786)로, 정상 상한치(ULN)의 2.7배에 해당하였다. 평균 총 빌리루빈(TB) 농도는 0.8 mg/dL(범위: 0.3~1.9)이었으며, 환자의 87%에서 ULN 이하였다. 기타 간 생화학 검사 수치의 기저 평균값은 알라닌 아미노전이효소(ALT) 48 U/L(범위: 9~115), 아스파르테이트 아미노전이효소(AST) 40 U/L(범위: 16~94)였다.<생화학적 결과>1차 평가변수는 12개월 시점의 생화학적 반응으로, 생화학적 반응은 다음 세 가지 기준을 모두 충족하는 것으로 정의되었다:- ALP가 정상 상한치(ULN)의 1.67배 미만일 것- 기저치 대비 ALP가 15% 이상 감소할 것- 총 빌리루빈(TB)이 ULN 이하일 것12개월 시점에서의 ALP 정상화(즉, ALP가 ULN 이하)는 주요 2차 평가변수였다. ALP의 ULN는 116 U/L로 정의되었고, TB의 ULN는 1.1 mg/dL로 정의되었다.Table 3에는 12개월 시점에서 생화학적 반응을 달성한 환자의 비율, 생화학적 반응을 구성하는 각 요소를 달성한 비율, 그리고 ALP 정상화를 달성한 비율에 대한 결과가 제시되어 있다. LIVDELZI는 위약과 비교하여 12개월 시점에서 생화학적 반응과 ALP 정상화 모두에서 더 큰 개선 효과를 보였다.전체 환자의 87%는 기저 시점에서 TB 농도가 ULN 이하였으므로, 12개월 시점의 생화학적 반응률 결과는 주로 ALP 개선에 의해 좌우되었다.Figure 1은 12개월 동안의 ALP 평균값(95% 신뢰구간)을 보여준다. 1개월 시점부터 12개월 시점까지, LIVDELZI 투여군에서 위약군에 비해 ALP 수치가 더 낮은 경향이 지속적으로 관찰되었다.LIVDELZI 단독요법과 위약을 비교한 3개월 시점의 생화학적 반응은, Trial 1과 유사한 환자군을 대상으로 한 또 다른 무작위배정, 이중눈가림, 위약 대조 임상시험에서 선별된 환자 하위집단을 통합(pooled) 분석하여 평가되었다. 그 결과, 3개월 시점에서 LIVDELZI 단독요법군은 위약군에 비해 생화학적 반응의 개선 경향을 보였다.<소양증(Pruritus)>Trial 1에서는 단일 항목 환자 보고 결과(patient-reported outcome, PRO) 지표인 소양증 수치평가척도(pruritus Numerical Rating Scale, NRS)를 사용하여 환자의 일일 최대 가려움 강도를 평가하였다. 소양증 NRS는 0점(“가려움 없음”)부터 10점(“상상할 수 있는 가장 심한 가려움”)까지의 11점 척도로 구성되었다. 이 평가는 무작위 배정 이전 14일간의 런인(run-in) 기간부터 6개월 시점까지 매일 시행되었다.Table 4에는 기저 평균 소양증 점수가 4점 이상인 환자들을 대상으로, 6개월 시점에서 기저 대비 소양증 점수 변화에 대해 LIVDELZI와 위약을 비교한 주요 2차 평가변수의 결과가 제시되어 있다. 각 환자의 기저 평균 소양증 점수는 런인 기간 동안과 치료 시작 전 1일차(Day 1)에 측정된 소양증 NRS 점수의 평균으로 산출되었다. 6개월 시점의 소양증 점수는 해당 월의 마지막 1주일 동안 측정된 소양증 NRS 점수의 평균으로 계산되었다. LIVDELZI로 치료받은 환자들은 위약군에 비해 소양증에서 더 큰 개선을 보였다.셀라델파는 추후 어떤 쟁점이 예상되는가?셀라델파(Seladelpar)는 선택적 PPAR-δ 작용제로서 원발성 담즙성 담관염(PBC) 치료 분야에서 새로운 기전 기반 치료제로 주목받고 있다. 특히 알칼리성 인산분해효소(ALP)의 유의한 감소와 소양증 개선 효과를 근거로 가속 승인을 획득하며, 기존 치료 옵션이 제한적이었던 PBC 영역에서 중요한 치료적 진전을 제시했다. 그러나 이러한 성과에도 불구하고 셀라델파의 장기적인 임상적 위치를 확립하기 위해서는 여전히 해결해야 할 여러 쟁점이 남아 있다.가장 핵심적인 쟁점은 임상적 유익성의 최종 입증 여부이다. 현재 셀라델파의 승인 근거는 ALP 감소라는 대리지표에 기반하고 있으며, 이는 질병 활성도와 예후를 반영하는 중요한 생화학적 지표이지만 환자의 생존율 개선이나 간 대상부전 발생 감소와 같은 직접적인 임상 결과를 대변하지는 않는다.따라서 향후 확증 임상시험에서 간이식 필요성 감소, 간 대상부전 예방, 장기 생존 개선과 같은 하드 엔드포인트에 대한 효과가 입증되지 않을 경우, 적응증의 유지 또는 확대에 제한이 발생할 가능성이 있다. 이는 가속 승인 제도의 본질적인 한계이자, 셀라델파가 반드시 넘어야 할 가장 중요한 관문이라 할 수 있다.또 다른 중요한 과제는 장기 안전성이다. PBC는 만성적이고 진행성인 질환으로, 환자들은 수년에서 수십 년에 걸쳐 지속적인 약물 치료가 필요하다. PPAR-δ는 간뿐 아니라 다양한 조직에서 발현되는 핵수용체이므로, 장기간의 지속적 활성화가 지질 대사, 근육 대사, 심혈관계 또는 종양 발생 위험에 어떠한 영향을 미칠 수 있는지에 대해서는 아직 충분한 장기 데이터가 축적되지 않았다. 특히 현재 진행 중인 장기 안전성 연구의 결과는 셀라델파가 실제 임상에서 신뢰할 수 있는 만성 치료제로 자리매김할 수 있는지를 판단하는 데 중요한 근거가 될 것이다.간경변 환자에서의 사용 범위 또한 중요한 논점이다. 현재 셀라델파는 비대상성 간경변 환자에서 사용이 권장되지 않으며, 이는 주로 안전성 우려에 따른 제한이다. 그러나 실제 임상 현장에서는 보상성 간경변과 비대상성 간경변의 경계에 있는 환자들이 적지 않으며, 이러한 환자군에서 셀라델파를 어느 시점까지 사용할 수 있는지에 대한 명확한 기준은 아직 확립되지 않았다. 향후 보상성 간경변 환자를 대상으로 한 추가 임상 연구 결과에 따라 사용 범위가 확대되거나, 반대로 제한이 강화될 가능성도 존재한다.치료 전략 내에서의 위치 설정 역시 향후 중요한 쟁점으로 남아 있다. 셀라델파는 대부분의 임상시험에서 UDCA와의 병용요법으로 평가되었으며, UDCA 불내성 환자에서는 단독요법이라는 잠재적 장점을 가진다. 그러나 단독요법 환자군의 규모는 제한적이었고, 장기적인 효과와 안전성에 대한 근거는 상대적으로 부족하다. 이에 따라 UDCA 불내성 환자에서 셀라델파가 표준 치료로 자리 잡을 수 있을지는 추가적인 임상 근거의 축적에 달려 있다.한편 셀라델파의 차별적 강점으로 평가되는 소양증 개선 효과의 지속성 또한 중요한 평가 대상이다. 소양증은 PBC 환자의 삶의 질을 현저히 저하시키는 주요 증상으로, 기존 치료제들이 충분히 해결하지 못한 영역이었다. 셀라델파가 보여준 소양증 개선 효과가 장기적으로 유지되는지, 그리고 다른 치료제 대비 임상적으로 의미 있는 우월성을 지속적으로 입증할 수 있는지는 실제 처방 환경에서 약물 선택에 중요한 영향을 미칠 것이다.마지막으로 기전적 측면에서도 아직 해결되지 않은 과제가 존재한다. 셀라델파는 FGF21 유도를 통한 담즙산 합성 억제, 항염증 및 면역조절 효과를 통해 PBC의 병태생리에 관여하는 것으로 제시되고 있으나, 담관 상피세포 사멸 과정이나 자가면역 반응의 핵심 단계에서 PPAR-δ가 수행하는 직접적인 역할은 아직 명확히 규명되지 않았다. 이러한 기전적 불확실성은 향후 기초 및 중개 연구를 통해 보완돼야 할 영역이다.종합하면, 셀라델파는 PBC 치료에서 유망한 치료제로 부상했으나, 그 장기적 가치는 ALP 감소를 넘어 실제 환자 예후를 개선할 수 있는지, 장기간 안전하게 사용 가능한지, 그리고 기존 치료 옵션 대비 명확한 임상적 우위를 확보할 수 있는지에 의해 최종적으로 결정될 것이다. 이러한 쟁점들에 대한 답은 현재 진행 중인 확증 임상시험과 장기 안전성 연구의 결과를 통해 점진적으로 명확해질 것으로 기대된다.참고문헌1. Anna Skoczy ´nska et al. “PPARs in Clinical Experimental Medicine after 35 Years of Worldwide Scientific Investigations and Medical Experiments” Biomolecules 2024, 14, 786). 2. Tetsuya Kouno et al. “Selective PPARδ agonist seladelpar suppresses bile acid synthesis by reducing hepatocyte CYP7A1 via the fibroblast growth factor 21 signaling pathway” J. Biol. Chem. (2022) 298(7) 102056.3. Chang Yin “The Potential of Bile Acids as Biomarkers for Metabolic Disorders” Int. J. Mol. Sci. 2023, 24, 12123.4. Abigail Medford “Emerging Therapeutic Strategies in The Fight Against Primary Biliary Cholangitis” Journal of Clinical and Translational Hepatology 2023 vol. 11(4) | 949–957.5. Ji Hye Roh and Jeong-Hyun Yoon “Bile Acids and the Metabolic Disorders” Korean J Clin Pharm, Vol. 28, No. 4, 2018.6. 6. 기타 인터넷 자료(보도 자료, 제품 설명서 등.2026-01-02 06:00:53최병철 박사
GIFT 지정된 PBC 새로운 치료제 '셀라델파'리브델지(LivdelziⓇ, 성분명: 셀라델파, Seladelpar, Gilead Sciences)는 PPAR-δ(peroxisome proliferator-activated receptor-δ) 작용제로 2024년 미국 FDA, 2025년 유럽 EMA에서 우르소데옥시콜산(Ursodeoxycholic acid, UDCA)에 불내성이 있거나 기존 치료에 충분히 반응하지 않는 원발성 담즙성 담관염(Primary Biliary Cholangitis, PBC) 환자를 대상으로 가속 승인(accelerated approval)을 받았다.국내에서는 2025년 6월, ‘우르소데옥시콜산에 대한 반응이 부적절하거나 불내성인 성인의 원발성 담즙성 담관염(PBC) 치료제’로 글로벌 혁신제품 신속심사(GIFT, Global Innovative products on Fast Track) 대상에 지정됐다.PBC는 간 내 담관의 만성 염증과 파괴로 인해 담즙 정체 및 진행성 간 손상을 유발하며, 궁극적으로 간경변증과 간부전으로 이어질 수 있는 희귀 난치성 자가면역 질환이다. 현재 우르소데옥시콜산(UDCA)이 1차 치료제로 사용되고 있으나, 일부 환자에서는 치료 반응이 불충분하거나 내약성 문제로 인해 새로운 치료 전략에 대한 미충족 의료 수요가 지속적으로 제기돼 왔다.셀라델파는 과산화소체 증식 활성화 수용체(peroxisome proliferator-activated receptor, PPAR) 델타(PPAR-δ)를 선택적으로 활성화하는 경구 치료제로, PBC 환자에서 담즙 정체와 관련된 간 효소 수치(특히 ALP)를 개선하고 가려움증 완화를 목표로 한다.이 약제의 가속 승인은 3상 임상시험인 RESPONSE 연구 결과를 근거로 이뤄졌다. RESPONSE 연구는 12개월간 진행된 이중눈가림, 무작위배정, 위약 대조 임상시험으로, UDCA 치료에 반응하지 않거나 심각한 이상반응으로 치료 지속이 어려웠던 193명의 PBC 환자가 등록되었다. 대상자는 셀라델파 10mg 경구 투여군 또는 위약군으로 무작위 배정되어, 12개월 동안 하루 1회 투여를 받았다.1차 평가변수는 12개월 시점의 복합 생화학적 반응(composite biochemical response)이었다. 주요 2차 평가변수로는 알칼리성 인산분해효소(alkaline phosphatase, ALP)의 정상화 여부와, 6개월 시점에서 기저치 대비 가려움증 수치 평가 척도(pruritus numerical rating scale, NRS) 점수 변화가 포함되었다. ALP는 담즙 정체를 반영하는 대표적 지표로, 간이식 및 사망 위험을 예측하는 인자로 알려져 있다.연구 결과, 셀라델파 투여군의 62%가 12개월 차에 1차 평가변수인 복합 생화학적 반응(ALP 및 총 빌리루빈 수치 개선)에 도달해, 위약군의 20% 대비 통계적으로 유의미한 우월성을 입증하였다. 특히 셀라델파 투여군의 25%에서는 ALP 수치가 정상화되는 유의한 결과가 관찰되었다.주요 2차 평가변수였던 가려움증 개선에서도 셀라델파의 효과가 확인되었다. 연구 시작 시점 대비 6개월 차에 중등도–중증 가려움증을 호소하던 환자군에서, 셀라델파 치료군은 평균 3.2점의 가려움증 점수 감소를 보였으며, 이는 위약군의 1.7점 감소 대비 통계적으로 유의미한 개선 효과였다.이와 같이 RESPONSE 연구에서 셀라델파는 단독요법 또는 UDCA 병용요법으로 하루 1회 경구 투여 시, PBC의 주요 생화학적 지표를 개선하고 가려움증 완화에 기여하는 것으로 나타났다. 가장 흔하게 보고된 이상반응은 두통, 복통 및 복부 팽만, 오심, 어지럼증이었다.담즙산 대사 장애(Bile acid metabolism disorder)란 무엇인가?담즙산(bile acid)은 간에서 합성되는 콜레스테롤 유도체로, 양친매성 계면활성제이자 전신 내분비 호르몬으로 작용한다. 담즙산은 자체 합성과 장–간 순환을 조절할 뿐 아니라, 지질·탄수화물·단백질 등 다량 영양소 대사와 전신 염증–항염증 균형을 강력하게 조절하는 역할을 한다.담즙산 대사 장애는 담즙산의 합성, 변환, 수송, 분비 또는 재흡수 과정 중 하나 이상에 이상이 발생해 담즙산 항상성이 붕괴된 상태를 의미한다. 정상적으로 담즙산은 간에서 콜레스테롤로부터 합성된 후 담관을 통해 담즙으로 분비되며, 장 내에서 지방의 소화와 흡수를 돕는다. 이후 회장 말단에서 대부분 재흡수되어 다시 간으로 돌아오는 장–간 순환(enterohepatic circulation)을 유지한다.그러나 이러한 조절 과정에 이상이 발생하면 간 내 담즙산이 과도하게 축적되거나 담즙 배출이 저해되어 담즙정체(cholestasis)가 발생한다. 그 결과 간세포 및 담관 세포의 손상, 염증 반응, 산화 스트레스 증가, 섬유화가 유발될 수 있다.담즙산 대사 장애는 담즙산 합성의 과도한 증가 또는 감소, 담즙산 수송체 기능 이상, 담즙 분비 장애, 장–간 순환 이상 등 다양한 기전에 의해 발생하며, 이러한 변화는 단독 또는 복합적으로 나타날 수 있다. 임상적으로는 간효소 수치 이상, 황달, 소양감, 지방 흡수 장애 등의 증상이 동반되며, 장기적으로는 만성 간질환으로 진행할 수 있다.이러한 담즙산 대사 장애는 여러 간·담도 질환의 핵심적인 병태생리로 작용한다. 원발성 담즙성 담관염(primary biliary cholangitis, PBC)은 자가면역 기전에 의해 간 내 소담관이 점진적으로 파괴되면서 담즙 배출이 저해되는 질환으로, 담즙산 축적과 담즙정체가 질환의 중심 병태생리를 이룬다.원발성 경화성 담관염(Primary sclerosing cholangitis, PSC) 역시 담관의 만성 염증과 섬유화로 인해 담즙 흐름이 차단되며, 진행성 담즙정체와 담즙산 대사 장애가 특징적으로 나타난다. 또한 진행성 가족성 간내 담즙정체(progressive familial intrahepatic cholestasis, PFIC)는 담즙산 수송체 관련 유전자의 이상으로 발생하는 선천성 질환으로, 소아기부터 중증의 담즙산 대사 장애와 간 손상을 초래한다.이 외에도 담즙산 수송체나 담즙 분비 경로를 억제하는 특정 약물로 인한 약물 유발 담즙정체, 임신 중 호르몬 변화와 연관된 임신성 담즙정체, 담석이나 종양에 의한 담도 폐쇄, 비알코올성 지방간질환과 같은 대사성 간질환에서도 이차적으로 담즙산 대사 장애가 동반될 수 있다. 이처럼 담즙산 대사 장애는 단순한 담즙 분비 이상을 넘어, 다양한 간질환의 발생과 진행에 깊이 관여하는 핵심 병태생리로 인식되고 있다.원발성 담즙성 담관염(Primary Biliary Cholangitis, PBC)란 무엇인가?원발성 담즙성 담관염(Primary Biliary Cholangitis, PBC)은 담관에 만성 염증이 발생해 소구경 담관이 점진적으로 파괴되는 자가면역 질환이다. 과거에는 원발성 담즙성 간경변증(Primary Biliary Cirrhosis)으로 불렸으나, 질환의 초기 및 중기 단계에서는 간경변이 동반되지 않는 경우가 많아 현재는 원발성 담즙성 담관염이라는 명칭이 공식적으로 사용되고 있다.담즙은 간에서 생성되는 액체로, 지방의 소화와 지용성 비타민의 흡수를 돕고 콜레스테롤, 독소, 노화된 적혈구의 대사산물을 배출하는 역할을 한다. 간에 지속적인 염증이 발생하면 담관의 염증과 손상, 즉 담관염이 나타나며, 질환이 진행될 경우 간 조직에 영구적인 섬유화가 형성되어 간경변으로 이어질 수 있다. 심한 경우에는 간부전으로 진행하기도 한다(Figure 1).Figure 1. Primary Biliary Cholangitis(PBC)(출처: https://www.narayanahealth.org/blog/primary-biliary-cholangitis-causes-symptoms-diagnosis-and-treatment-options).PBC는 남녀 모두에서 발생할 수 있으나 여성에서 더 흔하게 나타난다. 자가면역 질환의 하나로, 면역 체계가 정상적인 담관 상피세포를 비정상적으로 공격하는 것이 특징이다. 현재까지의 연구에 따르면 유전적 소인과 환경적 요인이 복합적으로 작용해 발병하는 것으로 알려져 있다. 질환은 대체로 서서히 진행되며, 완치할 수 있는 치료법은 아직 없으나 조기에 진단하고 치료를 시작하면 약물 치료를 통해 간 손상의 진행 속도를 효과적으로 늦출 수 있다.PBC는 조기에 적절한 치료가 이루어지지 않을 경우 간경변 및 간부전으로 진행할 수 있다. 임상적으로는 알칼리성 인산분해효소(alkaline phosphatase, ALP)와 감마-글루타밀 전이효소(γ-glutamyl transferase, GGT)를 포함한 담즙정체성 간효소의 지속적인 상승과, 항미토콘드리아 항체(antimitochondrial antibody, AMA) 또는 PBC 특이 항핵항체인 anti-sp100 및 anti-gp210의 검출이 특징적이다.ALP와 GGT는 모두 담즙정체성 간질환에서 상승하는 혈청 효소로, 간·담도계 손상을 평가하는 데 널리 사용된다. 그러나 두 효소는 기원 조직과 생리적 역할, 임상적 활용 측면에서 차이를 보인다.ALP는 간 내 담관 상피세포와 조골세포에 풍부하게 존재하는 효소로, 인산에스터 결합의 가수분해에 관여한다. 담즙정체가 발생하면 담관 압력 상승과 담관 상피세포 손상으로 인해 혈청 ALP 수치가 현저히 증가한다. 이러한 특성으로 인해 ALP는 담즙정체의 정도를 반영하는 대표적인 생화학적 지표로 활용된다. 다만 ALP는 뼈, 태반, 소장 등 다양한 조직에서도 발현되므로, 수치 상승 시 간 유래 여부에 대한 감별이 필요하다.반면 GGT는 세포막에 결합된 효소로, 주로 간세포와 담관 세포의 미소체막에 존재하며 글루타티온 대사와 아미노산 수송에 관여한다. GGT는 뼈 조직에서는 발현되지 않기 때문에, ALP 상승이 간담도계 기원인지 여부를 판단하는 보조 지표로 유용하다. 담즙정체성 간질환에서 GGT 역시 상승하지만, 질환 특이성보다는 간담도계 침범의 존재를 확인하는 데 주로 활용된다.임상적으로 ALP와 GGT는 상호 보완적으로 해석된다. 혈청 ALP 상승과 함께 GGT가 동반 상승하는 경우 간담도계 기원의 담즙정체를 강하게 시사하는 반면, ALP만 상승하고 GGT가 정상인 경우에는 뼈 질환 등 비간성 원인을 고려해야 한다. 이러한 이유로 PBC를 포함한 만성 담즙정체성 간질환의 진단 및 치료 반응 평가에서 ALP는 주요 지표로, GGT는 감별 진단을 위한 보조 지표로 활용된다.또한 PBC의 특징적인 조직병리학적 소견인 만성 비화농성 파괴성 담관염(chronic nonsuppurative destructive cholangitis)은 소구경에서 중간구경의 소엽간 담관 상피에 대한 림프구 침윤과 담관 파괴를 특징으로 하며, 이는 궁극적으로 담관 소실(ductopenia)과 담즙정체로 이어진다.PBC에서 가려움증(pruritus)과 피로(fatigue)는 흔히 나타나는 증상이지만 질환 특이적이지 않아 초기에는 질환과의 연관성이 간과되기 쉽다. 그러나 이러한 증상과 더불어 쇼그렌 증후군과 같은 동반 자가면역 질환에서 나타나는 안구 및 구강 건조 증상은 환자의 건강 관련 삶의 질(health-related quality of life, HRQOL)을 현저히 저하시킬 수 있다. 따라서 임상의는 이러한 증상의 임상적 중요성을 인식하고 적극적으로 평가해야 한다.과산화소체 증식자 활성화 수용체-델타(Peroxisome proliferator-activated receptor delta, PPAR-δ)는 무엇인가?과산화소체 증식자 활성화 수용체-델타(peroxisome proliferator-activated receptor-δ, PPAR-δ)는 세포의 대사와 염증 반응을 조절하는 리간드 의존적 핵수용체의 한 아형이다.과산화소체(Peroxisome)는 세포 내에 존재하는 소형 소기관으로, 지방산 분해, 독성 물질 해독, 과산화수소(H₂O₂) 처리 등의 기능을 수행한다. 이러한 작용을 통해 과산화소체는 세포 대사 과정에서 생성되는 유해 물질을 제거하고 지방 대사를 조절하며, 세포의 대사 처리와 항상성 유지에 핵심적인 역할을 한다.과산화소체 증식자(Peroxisome proliferator)는 과산화소체의 수와 기능을 증가시키는 물질을 의미한다. 이들 물질이 세포 내로 유입되면 과산화소체의 형성이 촉진되고 지방산 분해 능력이 향상되며, 대사 관련 효소의 발현이 증가한다. 초기 연구에서는 이러한 물질이 과산화소체 증식을 유도한다는 현상이 관찰되었고, 이후 그 작용이 특정 수용체를 통해 매개된다는 사실이 밝혀졌다.이 수용체가 바로 과산화소체 증식자 활성화 수용체(peroxisome proliferator-activated receptor, PPAR)이다. PPAR는 과산화소체 증식자에 의해 활성화되는 리간드 의존적 핵수용체로, 주로 세포핵 내에서 전사 조절 인자로 기능한다. 간세포, 지방세포, 근육세포, 면역세포 등 다양한 조직에서 발현되며, 아형에 따라 조직 분포와 생리적 기능에 차이를 보인다. 이러한 특성으로 인해 PPAR는 전신 에너지 대사와 염증 반응 조절에 중요한 역할을 수행한다.PPAR는 내인성 지방산 및 지방산 유도체와 같은 생체 내 신호물질이나 합성 리간드와 결합해야 활성화된다. 리간드 결합 후 PPAR는 구조적 변화를 거쳐 활성화되며, 활성화된 PPAR는 retinoid X receptor(RXR)와 이합체(heterodimer)를 형성한다. 이 PPAR–RXR 이합체는 세포핵 내에서 표적 유전자의 프로모터 영역에 존재하는 PPAR response element(PPRE)에 결합해 유전자 전사의 활성 또는 억제를 조절한다(Figure 2).Figure 2. Pattern of PPARα Activity. RXR—Retinoid X Receptor, PPRE—Gene Promoter(출처: Biomolecules 2024, 14, 786).이러한 기전을 통해 PPAR는 지방산 산화, 포도당 대사, 에너지 소비, 염증 반응, 담즙산 대사와 관련된 다양한 유전자들의 발현을 전사 수준에서 조절한다. 특히 내인성 지방산 유도체는 세포의 대사 상태를 반영하는 신호 분자로 작용해 PPAR 활성도를 조절함으로써, 세포가 환경 변화에 적응하도록 돕는다.PPAR는 구조적·기능적 특성에 따라 PPAR-α, PPAR-γ, PPAR-δ(β/δ)의 세 가지 아형으로 구분된다. PPAR-α는 주로 간에서 지방산 β-산화를 촉진해 지질 대사를 조절하며, PPAR-γ는 지방조직에서 지방세포 분화와 인슐린 감수성 조절에 관여한다. 이에 비해 PPAR-δ는 다양한 조직에 광범위하게 발현되며, 에너지 대사 조절과 항염증 반응에 관여할 뿐 아니라 간 내 담즙산 항상성 유지와 담즙정체 관련 경로 조절에도 중요한 역할을 수행하는 것으로 보고되고 있다.최근 연구들에서는 PPAR-δ가 담즙산 합성 및 수송 경로 조절, 간 내 염증 반응 억제, 담관 손상 완화와 연관된 신호전달 경로에 관여함으로써 담즙산 항상성 유지와 담즙정체(cholestasis) 조절에 핵심적인 역할을 한다는 점이 제시되고 있다. 이러한 특성으로 인해 PPAR-δ는 원발성 담즙성 담관염(PBC)과 같은 만성 담즙정체성 간질환에서 유망한 치료 표적으로 주목받고 있다.이러한 생물학적 특성에 근거해, 셀라델파(seladelpar)는 PPAR 아형 중 PPAR-δ에 선택적으로 결합하는 경구용 작용제로 개발되었다. 셀라델파는 PPAR-δ 신호전달 경로를 활성화함으로써 담즙정체와 염증 반응을 조절하고, 간 내 대사 이상을 개선하는 것을 치료 전략의 핵심 기전으로 한다.PPAR(Peroxisome proliferator-activated receptor) 기능 저하의 원인은 무엇인가?PPAR는 정상적인 대사 항상성과 항염증 반응 유지에 중요한 전사 조절 인자이나, 다양한 병리적 조건에서 그 발현이나 활성도가 감소할 수 있다. 이러한 PPAR 기능 저하는 단일 기전에 의해 발생하기보다는, 여러 내·외적 요인이 복합적으로 작용한 결과로 나타난다.첫째, 만성 염증 상태는 PPAR 기능 저하의 주요 원인으로 알려져 있다. 염증성 사이토카인(예: TNF-α, IL-1β, IL-6)은 PPAR 유전자 발현을 억제하거나 PPAR의 전사 활성 능력을 감소시키는 신호전달 경로를 활성화한다. 특히 NF-κB와 같은 염증 신호 경로는 PPAR와 상호 억제 관계를 형성해, 염증이 지속될수록 PPAR의 항염증 기능이 점차 약화되는 악순환을 초래한다.둘째, 리간드 결핍 또는 리간드 환경의 변화 역시 PPAR 기능 저하에 기여한다. PPAR는 내인성 지방산 및 지방산 유도체와 결합해야 활성화되므로, 대사 이상이나 영양 상태 변화로 적절한 리간드 공급이 감소할 경우 PPAR 활성은 저하된다. 또한 산화 스트레스 환경에서는 정상적인 리간드가 변형돼 PPAR 결합 친화도가 감소할 수 있다.셋째, 산화 스트레스와 미토콘드리아 또는 과산화소체 기능 이상은 PPAR 신호 전달을 간접적으로 억제한다. 활성산소의 과도한 축적은 PPAR 단백질의 구조적 안정성을 저해하거나, 전사 공조절인자(coactivator)의 기능을 손상시켜 PPAR 매개 유전자 발현을 감소시킨다.넷째, 후성유전학적(Epigenetic) 조절 변화 역시 중요한 기전으로 제시된다. DNA 메틸화 증가, 히스톤 변형 변화, microRNA에 의한 억제 등은 PPAR 유전자 발현을 장기적으로 감소시킬 수 있으며, 이러한 변화는 만성 간질환이나 대사성 질환에서 흔히 관찰된다.다섯째, 질환 특이적 조직 손상도 PPAR 기능 저하와 밀접하게 연관된다. 예를 들어, 원발성 담즙성 담관염(PBC)과 같은 만성 담즙정체성 간질환에서는 담관 손상과 간세포 스트레스가 지속되며, 이로 인해 PPAR 발현 감소 또는 신호 전달 효율 저하가 동반되는 것으로 보고되고 있다. 이 경우 PPAR 기능 저하는 질환의 직접적인 원인이라기보다는 질병 진행 과정에서 나타나는 이차적 변화로 작용해, 담즙정체와 염증 반응을 더욱 악화시키는 요인이 될 수 있다.원발성 담즙성 담관염(PBC)의 기존 치료약제는 무엇인가?원발성 담즙성 담관염(PBC)의 치료는 질병의 진행을 억제하고 간 기능 악화를 지연시키는 것을 목표로 하며, 오랫동안 제한된 약물 옵션에 의존해 왔다. 현재까지 임상적으로 확립된 치료 전략의 중심에는 우르소데옥시콜산(UDCA)이 있다. UDCA는 모든 PBC 환자에서 1차 표준 치료제로 권고되며, 담즙의 친수성을 증가시켜 독성을 감소시키고 담즙 흐름을 개선함으로써 담관 상피세포 손상을 완화한다.다수의 장기 추적 연구에서 UDCA는 혈청 알칼리성 인산분해효소(ALP)와 빌리루빈 수치를 감소시키고, 간이식 없는 생존율을 향상시키는 것으로 입증되었다. 그러나 전체 환자의 약 30–40%에서는 UDCA 치료에도 불구하고 생화학적 반응이 불충분하거나, 위장관 증상 등의 부작용으로 인해 약물 내약성에 문제가 발생한다.이러한 UDCA 불충분 반응 또는 불내성 환자를 대상으로 개발된 대표적인 2차 치료제가 오베티콜산(obeticholic acid, OCA)이다. OCA는 파네소이드 X 수용체(farnesoid X receptor, FXR) 작용제로, 담즙산 합성을 억제하고 담즙정체를 완화하는 기전을 통해 ALP 감소 효과를 나타낸다. 임상시험에서 OCA는 UDCA 단독요법 대비 추가적인 생화학적 개선 효과를 입증했으며, 이를 근거로 UDCA 불충분 반응 환자에서 승인되었다.그러나 OCA는 소양증을 악화시키는 부작용이 흔하고, 비대상성 간경변 환자에서는 중대한 안전성 문제로 인해 사용이 제한되는 한계를 지닌다. 이러한 점은 실제 임상 현장에서 OCA의 활용을 제약하는 주요 요인으로 작용해 왔다.한편, 공식 허가 적응증은 아니지만 피브레이트 계열 약물이 오프라벨(off-label) 치료로 사용돼 왔다. 대표적으로 베자피브레이트(bezafibrate)와 페노피브레이트(fenofibrate)는 PPAR 계열 수용체를 활성화해 담즙산 대사와 염증 반응을 조절하는 것으로 알려져 있다. 여러 연구에서 UDCA 병용 시 ALP, GGT, 면역글로불린 M(IgM) 감소 효과가 보고됐으며, 일부 관찰 연구에서는 예후 개선 가능성도 제시되었다. 그러나 근육 독성, 신기능 악화 등의 안전성 우려와 함께 장기 임상 근거가 제한적이라는 점에서 표준 치료로 확립되지는 못했다.질병 조절 치료와는 별도로, PBC 환자의 삶의 질에 큰 영향을 미치는 소양증에 대한 대증 치료 역시 중요한 치료 축을 이뤄 왔다. 콜레스티라민(cholestyramine), 리팜피신(rifampicin), 날트렉손(naltrexone), 설트랄린(sertraline) 등은 담즙산 결합이나 신경전달 조절 등의 기전을 통해 소양증 완화에 사용돼 왔으나, 질병의 병태생리를 근본적으로 조절하지는 못한다는 한계를 지닌다.요약하면, PBC의 기존 치료는 UDCA를 중심으로 한 제한적인 치료 전략에 기반해 왔으며, UDCA 불충분 반응 환자에서는 OCA나 피브레이트 계열 약물이 보조적으로 사용돼 왔다. 그러나 이러한 치료제들은 효과의 한계와 안전성 문제를 동시에 안고 있어, 상당수 환자에서 미충족 의료 수요(unmet medical need)가 지속돼 왔다. 이러한 배경 속에서 PPAR 계열을 포함한 새로운 핵수용체 표적 치료제들이 등장하게 되었으며, 이는 기존 치료 패러다임을 보완하거나 대체할 가능성을 제시하고 있다.PPAR(Peroxisome proliferator-activated receptor) 작용제에는 어떤 약제들이 있는가?PPAR-α 작용제로는 페노피브레이트(fenofibrate)와 베자피브레이트(bezafibrate)와 같은 피브레이트 계열 약물이 있으며, 이들은 트리글리세리드(triglyceride, TG)와 유리 지방산(free fatty acid, FFA)을 감소시키고 고밀도 지단백(high-density lipoprotein, HDL) 수치를 증가시켜 이상지질혈증 치료에 사용된다.한편 PPAR-γ 작용제로는 로시글리타존(rosiglitazone)과 피오글리타존(pioglitazone) 등 티아졸리디네디온(thiazolidinedione, glitazone) 계열 약물이 대표적이다. 이들 약물은 인슐린 민감도를 개선하고 혈장 포도당, TG 및 FFA 수치를 감소시키는 동시에 HDL 수치를 증가시켜 제2형 당뇨병 치료에 활용되고 있다.이중 PPAR 작용제(dual PPAR agonists)는 두 가지 이상의 PPAR 아형을 동시에 활성화하도록 설계된 약제로, 주로 PPAR-α/γ 또는 PPAR-α/δ를 표적으로 하여 지질 대사, 에너지 대사 및 염증 반응을 복합적으로 조절하는 것을 목표로 개발돼 왔다. 이러한 약제는 각 PPAR 아형이 담당하는 생리적 기능을 동시에 활용함으로써, 단일 PPAR 작용제에 비해 보다 광범위한 대사 개선 효과를 기대할 수 있다는 이론적 장점을 지닌다. 기전적으로는 지방산 β-산화 촉진, 중성지방 감소, 에너지 소비 증가 및 항염증 효과를 동시에 유도해 전신 대사 항상성 조절에 기여한다.그러나 이중 PPAR 작용제 가운데 미국 FDA 승인을 받은 약제는 아직 제한적인 상황이며, 최근까지 임상적으로 의미 있는 성과를 보인 사례도 많지 않았다. 이러한 가운데 PPAR-α/δ 이중 작용제인 엘라피브라노르(elafibranor)가 원발성 담즙성 담관염(PBC)을 적응증으로 FDA 가속 승인을 받으면서, 이중 PPAR 작용제가 간질환 영역에서도 임상적 가치를 가질 수 있음을 보여주는 사례로 평가되고 있다. 엘라피브라노르는 PPAR-α를 통한 지질 대사 개선 효과와 PPAR-δ를 통한 항염증 및 담즙산 대사 조절 효과를 동시에 유도함으로써, 담즙정체와 간 내 염증을 완화하는 기전을 갖는 것으로 설명된다.반면 선택적 PPAR-δ 작용제는 PPAR 아형 중 PPAR-δ만을 표적으로 활성화하는 약제로, 보다 제한된 신호 경로를 정밀하게 조절하는 전략을 취한다. PPAR-δ는 다양한 조직에 광범위하게 발현되며 에너지 대사 촉진, 지방산 산화 증가, 항염증 반응 조절과 더불어 간 내 담즙산 항상성 유지 및 담즙정체 관련 경로 조절에 관여하는 것으로 알려져 있다. 이러한 특성을 바탕으로 선택적 PPAR-δ 작용제는 불필요한 대사 경로의 과도한 활성화를 최소화하면서 치료 효과를 유도하는 것을 목표로 개발돼 왔다.선택적 PPAR-δ 작용제의 대표적인 예로는 셀라델파(seladelpar)가 있으며, 이는 우르소데옥시콜산(UDCA)에 불충분한 반응을 보이거나 UDCA를 사용할 수 없는 PBC 환자를 대상으로 FDA 가속 승인을 받았다. 셀라델파는 담즙정체의 주요 생화학적 지표인 알칼리성 인산분해효소(ALP)를 감소시키고, 환자의 삶의 질을 저해하는 소양감을 완화하는 효과를 보여 PPAR-δ 선택적 활성화의 임상적 유용성을 입증했다.종합하면, 이중 PPAR 작용제는 두 가지 경로를 동시에 조절함으로써 보다 폭넓은 대사 및 항염증 효과를 기대할 수 있다는 장점을 지니는 반면, 활성화 범위가 넓은 만큼 안전성과 내약성에 대한 면밀한 평가가 요구된다. 이에 비해 선택적 PPAR-δ 작용제는 표적 특이성이 높아 비교적 안전성이 우수하며, 특히 담즙정체성 간질환과 같이 특정 병태생리를 중심으로 한 치료에 적합한 특성을 가진다.결론적으로 FDA 승인 사례를 기준으로 볼 때, 이중 PPAR 작용제는 아직 임상 적용이 제한적인 단계에 있으나 엘라피브라노르의 승인으로 그 가능성이 확장되고 있다. 동시에 선택적 PPAR-δ 작용제는 질환 특이적 기전을 정밀하게 표적하는 전략으로서, 원발성 담즙성 담관염과 같은 만성 담즙정체성 간질환에서 중요한 치료 옵션으로 자리매김하고 있다.셀라델파(Seladelpar)는 어떤 약제인가?원발성 담즙성 담관염(PBC)은 자가면역 기전에 의해 간 내 소담관이 점진적으로 파괴되는 만성 담즙정체성 간질환으로, 이로 인해 담즙 배설 장애, 간 내 담즙산 축적, 염증 반응 및 섬유화가 점차 진행된다. 현재 PBC의 표준 1차 치료는 우르소데옥시콜산(UDCA)이지만, 상당수 환자에서 불충분한 생화학적 반응을 보이거나 약물 불내성이 관찰돼 추가적인 치료 옵션에 대한 필요성이 지속적으로 제기돼 왔다.셀라델파(Seladelpar)는 선택적 PPAR-δ 작용제로, UDCA에 불충분한 반응을 보이는 성인 PBC 환자에서는 UDCA와의 병용요법으로, UDCA를 견딜 수 없는 환자에서는 단독요법으로 사용하도록 적응증이 승인되었다. 이 적응증은 알칼리성 인산분해효소(ALP) 감소를 근거로 승인되었으며, 현재까지 생존율 개선이나 간 대상부전 사건 예방에 대한 효과는 입증되지 않았다. 따라서 해당 적응증의 지속적인 승인은 확인 임상시험을 통해 임상적 유익성이 검증되고 충분히 설명되는 것을 조건으로 한다. 또한 비대상성 간경변, 즉 복수, 정맥류 출혈 또는 간성 뇌병증이 있거나 치료 중 이러한 상태가 발생한 환자에서는 셀라델파의 사용이 권장되지 않는다.임상시험 및 기전 연구에 따르면, 셀라델파는 PBC의 병태생리에 관여하는 여러 경로를 조절함으로써 치료 효과를 나타내는 것으로 보고되고 있다. 특히 셀라델파 투여 시 담즙정체와 관련된 주요 생화학적 지표가 유의하게 개선되며, ALP 감소와 함께 총 빌리루빈을 포함한 담즙정체 지표의 개선이 일관되게 관찰되었다. 이러한 생화학적 반응은 임상적 예후를 반영하는 대리지표(surrogate marker)로 간주돼 규제 당국의 승인 근거로 활용되었다.아울러 셀라델파는 PBC 환자에서 흔히 나타나며 삶의 질을 현저히 저해하는 증상인 소양감(pruritus)을 유의하게 완화시키는 효과를 보였다. 여러 임상 연구에서 셀라델파 투여군은 위약 대비 소양감 점수의 의미 있는 감소를 나타냈으며, 이는 단순한 간수치 개선을 넘어 증상 조절 측면에서도 임상적 가치를 지님을 시사한다.기전적으로 PPAR-δ의 활성화는 항염증 및 면역조절 작용과 더불어 담즙산 대사 경로 조절에 관여하는 것으로 알려져 있다. 선행 연구 및 문헌 고찰에 따르면, PPAR-δ 활성화는 섬유아세포 성장인자 21(fibroblast growth factor 21, FGF21)에 의존적인 방식으로 담즙산 합성의 핵심 효소인 cholesterol 7α-hydroxylase(CYP7A1)를 포함한 관련 경로의 발현을 조절한다. 이를 통해 간 내 담즙산 축적을 완화하고, 담즙정체로 인한 간세포 손상을 감소시키는 것으로 제안된다. 이러한 다면적 작용 기전은 셀라델파가 PBC의 핵심 병태생리인 담즙정체, 염증 반응 및 증상 부담을 동시에 조절할 수 있는 치료제로 주목받는 근거가 된다(Figure 2).Figure 2. Mechanism of Seladelpar(출처: https://www.youtube.com/watch?v=T8yBWcvWD00)셀라델파(LIVDELZIⓇ)의 허가임상은 어떻게 진행되었나?LIVDELZI의 유효성은 12개월 동안 진행된 무작위배정, 이중눈가림, 위약 대조 임상시험인 Trial 1 (NCT04620733)에서 평가되었다. 이 연구에는 우르소데옥시콜산(UDCA)에 대해 반응이 불충분하거나 내약성이 없는 원발성 담즙성 담관염(PBC) 성인 환자 193명이 포함되었다.환자는 알칼리성 인산분해효소(ALP)가 정상 상한치(ULN)의 1.67배 이상이고, 총 빌리루빈(TB)이 ULN의 2배 이하인 경우에만 시험에 포함되었다. 다른 만성 간질환이 있거나, 합병증을 동반한 문맥고혈압을 포함한 임상적으로 중요한 간 대상부전이 있는 경우, 또는 합병증을 동반한 간경변(예: 말기 간질환 평가 점수[Model for End Stage Liver Disease, MELD]가 12 이상이거나, 식도정맥류가 알려져 있거나 정맥류 출혈 병력이 있는 경우, 간신증후군 병력 등)이 있는 환자는 시험에서 제외되었다.환자들은 LIVDELZI 10 mg군(N=128) 또는 위약군(N=65)으로 무작위 배정되어 12개월 동안 1일 1회 투여받았다. 시험 기간 동안 181명(94%)의 환자는 UDCA와 병용하여 LIVDELZI 또는 위약을 투여받았으며, UDCA를 견딜 수 없는 12명(6%)의 환자는 단독요법으로 LIVDELZI 또는 위약을 투여받았다.<기저 인구통계학적 특성 및 임상적 특성>환자들의 평균 연령은 57세(범위: 28~75세)였으며, 95%가 여성이었다. 인종 분포는 백인 88%, 아시아인 6%, 흑인 또는 아프리카계 미국인 2%, 아메리칸 인디언 또는 알래스카 원주민 3%였다. 전체 환자의 29%가 히스패닉/라티노로 확인되었으며, LIVDELZI 10 mg 투여군에서는 23%, 위약군에서는 42%였다. 전체 환자의 32%가 미국에서 등록되었고, LIVDELZI 10 mg군에서는 38%, 위약군에서는 20%였다.기저 시점에서 LIVDELZI 투여 환자 18명(14%)과 위약 투여 환자 9명(14%)가 다음 기준 중 최소 하나를 충족하였다: FibroScan 결과가 16.9 kPa 초과 / 과거 생검 또는 영상의학적 검사에서 간경변을 시사하는 소견 / 혈소판 수가 140,000/μL 미만이면서 혈청 알부민 < 3.5 g/dL, 국제정상화비율(INR) > 1.3, 또는 총 빌리루빈(TB) > ULN의 1배 초과 중 최소 하나의 추가 검사 이상 소견이 있는 경우 / 연구자가 임상적으로 간경변으로 판단한 경우기저 시점의 평균 알칼리성 인산분해효소(ALP) 농도는 리터당 314 단위(U/L)(범위: 161~786)로, 정상 상한치(ULN)의 2.7배에 해당하였다. 평균 총 빌리루빈(TB) 농도는 0.8 mg/dL(범위: 0.3~1.9)이었으며, 환자의 87%에서 ULN 이하였다. 기타 간 생화학 검사 수치의 기저 평균값은 알라닌 아미노전이효소(ALT) 48 U/L(범위: 9~115), 아스파르테이트 아미노전이효소(AST) 40 U/L(범위: 16~94)였다.<생화학적 결과>1차 평가변수는 12개월 시점의 생화학적 반응으로, 생화학적 반응은 다음 세 가지 기준을 모두 충족하는 것으로 정의되었다:- ALP가 정상 상한치(ULN)의 1.67배 미만일 것- 기저치 대비 ALP가 15% 이상 감소할 것- 총 빌리루빈(TB)이 ULN 이하일 것12개월 시점에서의 ALP 정상화(즉, ALP가 ULN 이하)는 주요 2차 평가변수였다. ALP의 ULN는 116 U/L로 정의되었고, TB의 ULN는 1.1 mg/dL로 정의되었다.Table 3에는 12개월 시점에서 생화학적 반응을 달성한 환자의 비율, 생화학적 반응을 구성하는 각 요소를 달성한 비율, 그리고 ALP 정상화를 달성한 비율에 대한 결과가 제시되어 있다. LIVDELZI는 위약과 비교하여 12개월 시점에서 생화학적 반응과 ALP 정상화 모두에서 더 큰 개선 효과를 보였다.전체 환자의 87%는 기저 시점에서 TB 농도가 ULN 이하였으므로, 12개월 시점의 생화학적 반응률 결과는 주로 ALP 개선에 의해 좌우되었다.Figure 1은 12개월 동안의 ALP 평균값(95% 신뢰구간)을 보여준다. 1개월 시점부터 12개월 시점까지, LIVDELZI 투여군에서 위약군에 비해 ALP 수치가 더 낮은 경향이 지속적으로 관찰되었다.LIVDELZI 단독요법과 위약을 비교한 3개월 시점의 생화학적 반응은, Trial 1과 유사한 환자군을 대상으로 한 또 다른 무작위배정, 이중눈가림, 위약 대조 임상시험에서 선별된 환자 하위집단을 통합(pooled) 분석하여 평가되었다. 그 결과, 3개월 시점에서 LIVDELZI 단독요법군은 위약군에 비해 생화학적 반응의 개선 경향을 보였다.<소양증(Pruritus)>Trial 1에서는 단일 항목 환자 보고 결과(patient-reported outcome, PRO) 지표인 소양증 수치평가척도(pruritus Numerical Rating Scale, NRS)를 사용하여 환자의 일일 최대 가려움 강도를 평가하였다. 소양증 NRS는 0점(“가려움 없음”)부터 10점(“상상할 수 있는 가장 심한 가려움”)까지의 11점 척도로 구성되었다. 이 평가는 무작위 배정 이전 14일간의 런인(run-in) 기간부터 6개월 시점까지 매일 시행되었다.Table 4에는 기저 평균 소양증 점수가 4점 이상인 환자들을 대상으로, 6개월 시점에서 기저 대비 소양증 점수 변화에 대해 LIVDELZI와 위약을 비교한 주요 2차 평가변수의 결과가 제시되어 있다. 각 환자의 기저 평균 소양증 점수는 런인 기간 동안과 치료 시작 전 1일차(Day 1)에 측정된 소양증 NRS 점수의 평균으로 산출되었다. 6개월 시점의 소양증 점수는 해당 월의 마지막 1주일 동안 측정된 소양증 NRS 점수의 평균으로 계산되었다. LIVDELZI로 치료받은 환자들은 위약군에 비해 소양증에서 더 큰 개선을 보였다.셀라델파는 추후 어떤 쟁점이 예상되는가?셀라델파(Seladelpar)는 선택적 PPAR-δ 작용제로서 원발성 담즙성 담관염(PBC) 치료 분야에서 새로운 기전 기반 치료제로 주목받고 있다. 특히 알칼리성 인산분해효소(ALP)의 유의한 감소와 소양증 개선 효과를 근거로 가속 승인을 획득하며, 기존 치료 옵션이 제한적이었던 PBC 영역에서 중요한 치료적 진전을 제시했다. 그러나 이러한 성과에도 불구하고 셀라델파의 장기적인 임상적 위치를 확립하기 위해서는 여전히 해결해야 할 여러 쟁점이 남아 있다.가장 핵심적인 쟁점은 임상적 유익성의 최종 입증 여부이다. 현재 셀라델파의 승인 근거는 ALP 감소라는 대리지표에 기반하고 있으며, 이는 질병 활성도와 예후를 반영하는 중요한 생화학적 지표이지만 환자의 생존율 개선이나 간 대상부전 발생 감소와 같은 직접적인 임상 결과를 대변하지는 않는다.따라서 향후 확증 임상시험에서 간이식 필요성 감소, 간 대상부전 예방, 장기 생존 개선과 같은 하드 엔드포인트에 대한 효과가 입증되지 않을 경우, 적응증의 유지 또는 확대에 제한이 발생할 가능성이 있다. 이는 가속 승인 제도의 본질적인 한계이자, 셀라델파가 반드시 넘어야 할 가장 중요한 관문이라 할 수 있다.또 다른 중요한 과제는 장기 안전성이다. PBC는 만성적이고 진행성인 질환으로, 환자들은 수년에서 수십 년에 걸쳐 지속적인 약물 치료가 필요하다. PPAR-δ는 간뿐 아니라 다양한 조직에서 발현되는 핵수용체이므로, 장기간의 지속적 활성화가 지질 대사, 근육 대사, 심혈관계 또는 종양 발생 위험에 어떠한 영향을 미칠 수 있는지에 대해서는 아직 충분한 장기 데이터가 축적되지 않았다. 특히 현재 진행 중인 장기 안전성 연구의 결과는 셀라델파가 실제 임상에서 신뢰할 수 있는 만성 치료제로 자리매김할 수 있는지를 판단하는 데 중요한 근거가 될 것이다.간경변 환자에서의 사용 범위 또한 중요한 논점이다. 현재 셀라델파는 비대상성 간경변 환자에서 사용이 권장되지 않으며, 이는 주로 안전성 우려에 따른 제한이다. 그러나 실제 임상 현장에서는 보상성 간경변과 비대상성 간경변의 경계에 있는 환자들이 적지 않으며, 이러한 환자군에서 셀라델파를 어느 시점까지 사용할 수 있는지에 대한 명확한 기준은 아직 확립되지 않았다. 향후 보상성 간경변 환자를 대상으로 한 추가 임상 연구 결과에 따라 사용 범위가 확대되거나, 반대로 제한이 강화될 가능성도 존재한다.치료 전략 내에서의 위치 설정 역시 향후 중요한 쟁점으로 남아 있다. 셀라델파는 대부분의 임상시험에서 UDCA와의 병용요법으로 평가되었으며, UDCA 불내성 환자에서는 단독요법이라는 잠재적 장점을 가진다. 그러나 단독요법 환자군의 규모는 제한적이었고, 장기적인 효과와 안전성에 대한 근거는 상대적으로 부족하다. 이에 따라 UDCA 불내성 환자에서 셀라델파가 표준 치료로 자리 잡을 수 있을지는 추가적인 임상 근거의 축적에 달려 있다.한편 셀라델파의 차별적 강점으로 평가되는 소양증 개선 효과의 지속성 또한 중요한 평가 대상이다. 소양증은 PBC 환자의 삶의 질을 현저히 저하시키는 주요 증상으로, 기존 치료제들이 충분히 해결하지 못한 영역이었다. 셀라델파가 보여준 소양증 개선 효과가 장기적으로 유지되는지, 그리고 다른 치료제 대비 임상적으로 의미 있는 우월성을 지속적으로 입증할 수 있는지는 실제 처방 환경에서 약물 선택에 중요한 영향을 미칠 것이다.마지막으로 기전적 측면에서도 아직 해결되지 않은 과제가 존재한다. 셀라델파는 FGF21 유도를 통한 담즙산 합성 억제, 항염증 및 면역조절 효과를 통해 PBC의 병태생리에 관여하는 것으로 제시되고 있으나, 담관 상피세포 사멸 과정이나 자가면역 반응의 핵심 단계에서 PPAR-δ가 수행하는 직접적인 역할은 아직 명확히 규명되지 않았다. 이러한 기전적 불확실성은 향후 기초 및 중개 연구를 통해 보완돼야 할 영역이다.종합하면, 셀라델파는 PBC 치료에서 유망한 치료제로 부상했으나, 그 장기적 가치는 ALP 감소를 넘어 실제 환자 예후를 개선할 수 있는지, 장기간 안전하게 사용 가능한지, 그리고 기존 치료 옵션 대비 명확한 임상적 우위를 확보할 수 있는지에 의해 최종적으로 결정될 것이다. 이러한 쟁점들에 대한 답은 현재 진행 중인 확증 임상시험과 장기 안전성 연구의 결과를 통해 점진적으로 명확해질 것으로 기대된다.참고문헌1. Anna Skoczy ´nska et al. “PPARs in Clinical Experimental Medicine after 35 Years of Worldwide Scientific Investigations and Medical Experiments” Biomolecules 2024, 14, 786). 2. Tetsuya Kouno et al. “Selective PPARδ agonist seladelpar suppresses bile acid synthesis by reducing hepatocyte CYP7A1 via the fibroblast growth factor 21 signaling pathway” J. Biol. Chem. (2022) 298(7) 102056.3. Chang Yin “The Potential of Bile Acids as Biomarkers for Metabolic Disorders” Int. J. Mol. Sci. 2023, 24, 12123.4. Abigail Medford “Emerging Therapeutic Strategies in The Fight Against Primary Biliary Cholangitis” Journal of Clinical and Translational Hepatology 2023 vol. 11(4) | 949–957.5. Ji Hye Roh and Jeong-Hyun Yoon “Bile Acids and the Metabolic Disorders” Korean J Clin Pharm, Vol. 28, No. 4, 2018.6. 6. 기타 인터넷 자료(보도 자료, 제품 설명서 등.2026-01-02 06:00:53최병철 박사 -
![[신년사] 식품의약품안전처 오유경 처장](https://vod.dailypharm.com/new_dailypharm/editor/content/2025/12/31/c10b0431-4765-40d1-8f6d-07facf93e518.jpg) [신년사] 식품의약품안전처 오유경 처장[데일리팜=이탁순 기자] 병오년(丙午年) 새해가 밝았습니다.지난 한 해 보내 주신 따뜻한 격려와 응원에 감사드리며, 국민의 생명과 안전을 지키기 위해 각자의 자리에서 소임을 다해주신 모든 분들께 감사의 말씀을 드립니다.2025년 이재명 정부 출범 이후 우리 처는 ‘소통’과 ‘속도’를 핵심 기치로 새 정부 국정과제 구현을 위한 규제 설계와 혁신에 모든 노력을 기울여 왔습니다.유전자변형식품 완전표시제의 제도적 기반 마련으로 소비자 알 권리와 선택권을 넓히고, 체계적인 식음료 안전관리로 아시아태평양경제협력체(APEC) 정상회의의 성공적 개최를 지원했습니다.「바이오의약품 위탁개발생산기업 규제지원 특별법」 제정으로 K-바이오의 글로벌 도약 기반을 구축하며, 신약을 시작으로 하는 의약품 허가·심사 혁신을 이어가고 있습니다.아울러 세계보건기구(WHO) 의약품 우수규제기관 목록 전(全) 기능 등재와 한–UAE 바이오 분야 포괄적 양해각서 체결 등 우리 기업의 해외 진출을 뒷받침하는 성과도 거두었습니다.2026년에는 이러한 노력과 성과를 바탕으로 더 나은 안전을 고민해 나가면서, 국민께 안심 주고 산업에 힘이 되는 세계 속의 식‧의약 규제기관으로 우뚝 서고자 합니다. 이를 위해 금년에는 ‘국민 안전, 안심 일상, 성장 견인’의 세 가지 핵심 전략에 우리 처의 역량을 집중하겠습니다.첫째, 기본이 단단한 국민 안전을 이루겠습니다.AI 기반의 수입식품 위험예측과 식육 이물 검출로 식품 안전관리의 효율성과 정확도를 높이고, 담배 유해성분을 과학적으로 분석해 투명하게 공개하겠습니다.온라인 AI 캅스를 활용해 의료용 마약류의 불법유통을 신속히 차단하고, AI를 활용한 가짜 의·약사 광고를 전면 금지하는 등 온라인 불법 광고 관리도 한층 강화하겠습니다.둘째, 모두가 함께 누리는 안심 일상을 만들겠습니다.전국 모든 시·군·구의 노인·장애인 사회복지시설에 급식안전을 지원하고, 시·청각장애인을 위한 식품 정보 수어·음성 제공을 확대하겠습니다.희귀·난치질환 치료제의 정부 직접 공급과 필수의약품 공공 생산 강화를 통해 환자의 치료기회도 넓히겠습니다.특히, 현장과 정책을 잇는 새로운 소통 모델을 운영하여 현장의 목소리는 잘 듣고, 필요한 정책은 신속히 바꾸며 추진 정책은 국민께 상세히 알리고 살피겠습니다.셋째, 식의약 안전 혁신으로 성장을 이끌겠습니다.420일이 걸리던 바이오시밀러 등의 허가‧심사를 세계에서 가장 빠른 240일 이내로 대폭 단축하고, AI 기반 허가·심사 지원 시스템을 도입하여 심사 효율도 높이겠습니다.식품 할랄 인증 지원, 바이오의약품 위탁개발생산, 화장품 안전성 평가 등 글로벌 기준에 부합하는 규제 설계를 통해 K-푸드, K-바이오, K-뷰티의 세계 진출도 뒷받침하겠습니다.존경하는 국민 여러분!불의 기운을 지닌 병오년(丙午年) 말의 해는 ‘머무름’이 아닌 ‘움직임’을 상징합니다.쉼 없는 노력과 끊임없는 고민으로 국민들께서 체감할 수 있는 식‧의약 안전의 성과를 만들어 나가고자 합니다. 안전에 혁신을 더하여 국민께 안심을, 성장에 힘을 더하는 식품의약품안전처로 거듭나겠습니다.국민 여러분의 일상에 활력과 희망, 그리고 굳건한 안전이 함께하시기를 진심으로 기원합니다.새해 복 많이 받으십시오.2026-01-01 00:01:15데일리팜
[신년사] 식품의약품안전처 오유경 처장[데일리팜=이탁순 기자] 병오년(丙午年) 새해가 밝았습니다.지난 한 해 보내 주신 따뜻한 격려와 응원에 감사드리며, 국민의 생명과 안전을 지키기 위해 각자의 자리에서 소임을 다해주신 모든 분들께 감사의 말씀을 드립니다.2025년 이재명 정부 출범 이후 우리 처는 ‘소통’과 ‘속도’를 핵심 기치로 새 정부 국정과제 구현을 위한 규제 설계와 혁신에 모든 노력을 기울여 왔습니다.유전자변형식품 완전표시제의 제도적 기반 마련으로 소비자 알 권리와 선택권을 넓히고, 체계적인 식음료 안전관리로 아시아태평양경제협력체(APEC) 정상회의의 성공적 개최를 지원했습니다.「바이오의약품 위탁개발생산기업 규제지원 특별법」 제정으로 K-바이오의 글로벌 도약 기반을 구축하며, 신약을 시작으로 하는 의약품 허가·심사 혁신을 이어가고 있습니다.아울러 세계보건기구(WHO) 의약품 우수규제기관 목록 전(全) 기능 등재와 한–UAE 바이오 분야 포괄적 양해각서 체결 등 우리 기업의 해외 진출을 뒷받침하는 성과도 거두었습니다.2026년에는 이러한 노력과 성과를 바탕으로 더 나은 안전을 고민해 나가면서, 국민께 안심 주고 산업에 힘이 되는 세계 속의 식‧의약 규제기관으로 우뚝 서고자 합니다. 이를 위해 금년에는 ‘국민 안전, 안심 일상, 성장 견인’의 세 가지 핵심 전략에 우리 처의 역량을 집중하겠습니다.첫째, 기본이 단단한 국민 안전을 이루겠습니다.AI 기반의 수입식품 위험예측과 식육 이물 검출로 식품 안전관리의 효율성과 정확도를 높이고, 담배 유해성분을 과학적으로 분석해 투명하게 공개하겠습니다.온라인 AI 캅스를 활용해 의료용 마약류의 불법유통을 신속히 차단하고, AI를 활용한 가짜 의·약사 광고를 전면 금지하는 등 온라인 불법 광고 관리도 한층 강화하겠습니다.둘째, 모두가 함께 누리는 안심 일상을 만들겠습니다.전국 모든 시·군·구의 노인·장애인 사회복지시설에 급식안전을 지원하고, 시·청각장애인을 위한 식품 정보 수어·음성 제공을 확대하겠습니다.희귀·난치질환 치료제의 정부 직접 공급과 필수의약품 공공 생산 강화를 통해 환자의 치료기회도 넓히겠습니다.특히, 현장과 정책을 잇는 새로운 소통 모델을 운영하여 현장의 목소리는 잘 듣고, 필요한 정책은 신속히 바꾸며 추진 정책은 국민께 상세히 알리고 살피겠습니다.셋째, 식의약 안전 혁신으로 성장을 이끌겠습니다.420일이 걸리던 바이오시밀러 등의 허가‧심사를 세계에서 가장 빠른 240일 이내로 대폭 단축하고, AI 기반 허가·심사 지원 시스템을 도입하여 심사 효율도 높이겠습니다.식품 할랄 인증 지원, 바이오의약품 위탁개발생산, 화장품 안전성 평가 등 글로벌 기준에 부합하는 규제 설계를 통해 K-푸드, K-바이오, K-뷰티의 세계 진출도 뒷받침하겠습니다.존경하는 국민 여러분!불의 기운을 지닌 병오년(丙午年) 말의 해는 ‘머무름’이 아닌 ‘움직임’을 상징합니다.쉼 없는 노력과 끊임없는 고민으로 국민들께서 체감할 수 있는 식‧의약 안전의 성과를 만들어 나가고자 합니다. 안전에 혁신을 더하여 국민께 안심을, 성장에 힘을 더하는 식품의약품안전처로 거듭나겠습니다.국민 여러분의 일상에 활력과 희망, 그리고 굳건한 안전이 함께하시기를 진심으로 기원합니다.새해 복 많이 받으십시오.2026-01-01 00:01:15데일리팜 -
![[신년사] 한국의약품수출입협회 류형선 회장](https://vod.dailypharm.com/new_dailypharm/editor/content/2025/12/27/46fdfc24-ac40-4314-9414-93ed0d180da2.jpg) [신년사] 한국의약품수출입협회 류형선 회장존경하는 회원사 여러분, 2026년 새해를 맞아 여러분의 건승과 가정의 평안을 기원합니다.지난 한 해 우리나라 제약바이오 무역은 미국의 약가 및 관세 정책 변화, 보호무역 심화, 글로벌 공급망 불안이라는 난기류 속에서도 의약품 수출이 사상 최고치인 100억 달러를 경신하는 눈부신 성과를 달성했습니다.이는 우리 기업들이 축적해 온 기술 경쟁력과 품질 관리, 그리고 글로벌 시장에서 형성된 신뢰가 만들어낸 결과라 하겠습니다. 각자의 자리에서 흔들림 없이 노력해 주신 회원사 여러분께 깊이 감사드립니다.2026년은 이러한 성과를 유지하는 것을 넘어, 의약품 무역 경쟁의 기준이 바뀌는 국면에서 주도권을 선점하는 해가 되어야 합니다. 세계 의약품 무역은 보건안보와 산업 전략이 결합되면서 새로운 질서로 재편되고 있기 때문입니다.미국과 유럽은 의약품을 전략 물자로 분류하며 생산기반 확충, 조달 안전성, 규제 일관성을 정책의 핵심 축으로 운용하고 있고, OECD와 WHO는 의약품의 접근성과 공급 안정성을 각국 보건·산업 거버넌스의 핵심 성과 지표로 설정하고 있습니다.이에 따라 시장의 평가 방식이 달라지고 있습니다. 거래 규모만으로 경쟁력을 설명하기 어렵습니다. 규제 대응의 완성도, 임상·허가·데이터 관리의 정합성, 제조시설의 신뢰 수준, 원료 확보의 연속성까지 함께 검증받는 총합 경쟁력의 시대로 접어들었습니다.이러한 환경 속에서 회원사들의 해외 진출 전략도 새롭게 설계되어야 합니다. 해외 사업은 ‘판매’에서 끝나지 않습니다. 현지 등록과 허가, 유통 경로, 마케팅 운영까지 이어지는 현지 정착형 사업 흐름을 만들어가야 합니다.동시에 신약, 유전자 치료제 및 CDMO와 같은 차세대 영역을 중심으로, 등록·허가 운영과 원료 확보까지 아우르는 사업 밸류체인 전반의 동시 확장을 추진하여야 합니다. 이제 기업의 신뢰는 단일 제품이 아니라, 회사 전체의 운영 신뢰도로 평가받기 때문입니다.글로벌 사우스와 유망 신흥국은 향후 수요 증가와 제도 정비가 병행되는 핵심 지역입니다. 중장기 시야로 시장 조건, 규제 여건, 유통 환경을 함께 정밀 검토해 단기 거래에 그치지 않고, 지속 가능한 매출 기반을 구축하는 방식으로 접근해야 합니다. 한마디로 지금 우리 기업들에게 필요한 것은 부분적인 개선이 아니라, 혁고정신(革故鼎新), 즉, 무역의 틀을 다시 짜는 결단이라고 봅니다.이 같은 대내외 경영환경 변화에 대응해 우리 협회도 그에 걸맞는 역할을 분명히 하겠습니다. 먼저, 전시회·사절단·바이어 연계·인허가 정보·사후관리 과정을 하나의 흐름으로 묶어, 의약품 종합 무역 플랫폼으로 거듭나겠습니다. 글로벌 사우스(Global South)와 신흥국을 전략 지역으로 설정하고, 지원사업의 우선순위를 명확히 해 운영하겠습니다.다음으로, 국제 규제 변화와 제도 개편 흐름을 회원사가 사전에 활용할 수 있도록 규제 정보의 조기 경보 체계를 정교화하겠습니다. 정부와의 협력을 통해 변화의 방향을 조기에 공유하고, 기업의 대응 부담을 구조적으로 낮추도록 노력하겠습니다.아울러 회원사의 글로벌화 지원을 위해 우리 협회가 지난해 체결한 한·중·일 MOU와 같이 글로벌 협력 네트워크를 더욱 강화해 CDMO 및 원료 조달 연계 모델이 실질적으로 가동될 수 있도록 힘쓰겠습니다. 생산과 조달의 연속성을 높여 공급 리스크를 줄이고, 역내 협업을 통해 글로벌 확장 가능성을 넓히겠습니다.또한 한국의약품시험연구원의 시험·평가·품질 역량을 국가 신뢰를 형성하는 핵심 인프라 수준으로 끌어올려, 우리 기업들의 대외무역 신용도를 높이는 토대로 다지도록 하겠습니다.마지막으로 이를 뒷받침하기 위해 협회 운영을 지속적으로 혁신하겠습니다. 의사결정 속도와 책임성을 높이고, 현장 대응이 가능한 조직으로 재정비해 회원사가 필요할 때 즉시 도움을 받을 수 있는 기동력 있는 체제로 거듭나겠습니다.2026년은 한국 제약바이오의 경쟁력과 신뢰가 국제 시장에서 본격적으로 평가받는 해가 될 것입니다. 회원사 여러분의 도전이 더 큰 성과로 이어지도록, 우리 협회는 정부·시장·네트워크를 잇는 실질적 파트너로서 역할을 다하겠습니다.회원사 여러분의 한 해에 더 큰 도약과 결실이 함께하시기를 기원합니다. 감사합니다.2026-01-01 00:00:01데일리팜
[신년사] 한국의약품수출입협회 류형선 회장존경하는 회원사 여러분, 2026년 새해를 맞아 여러분의 건승과 가정의 평안을 기원합니다.지난 한 해 우리나라 제약바이오 무역은 미국의 약가 및 관세 정책 변화, 보호무역 심화, 글로벌 공급망 불안이라는 난기류 속에서도 의약품 수출이 사상 최고치인 100억 달러를 경신하는 눈부신 성과를 달성했습니다.이는 우리 기업들이 축적해 온 기술 경쟁력과 품질 관리, 그리고 글로벌 시장에서 형성된 신뢰가 만들어낸 결과라 하겠습니다. 각자의 자리에서 흔들림 없이 노력해 주신 회원사 여러분께 깊이 감사드립니다.2026년은 이러한 성과를 유지하는 것을 넘어, 의약품 무역 경쟁의 기준이 바뀌는 국면에서 주도권을 선점하는 해가 되어야 합니다. 세계 의약품 무역은 보건안보와 산업 전략이 결합되면서 새로운 질서로 재편되고 있기 때문입니다.미국과 유럽은 의약품을 전략 물자로 분류하며 생산기반 확충, 조달 안전성, 규제 일관성을 정책의 핵심 축으로 운용하고 있고, OECD와 WHO는 의약품의 접근성과 공급 안정성을 각국 보건·산업 거버넌스의 핵심 성과 지표로 설정하고 있습니다.이에 따라 시장의 평가 방식이 달라지고 있습니다. 거래 규모만으로 경쟁력을 설명하기 어렵습니다. 규제 대응의 완성도, 임상·허가·데이터 관리의 정합성, 제조시설의 신뢰 수준, 원료 확보의 연속성까지 함께 검증받는 총합 경쟁력의 시대로 접어들었습니다.이러한 환경 속에서 회원사들의 해외 진출 전략도 새롭게 설계되어야 합니다. 해외 사업은 ‘판매’에서 끝나지 않습니다. 현지 등록과 허가, 유통 경로, 마케팅 운영까지 이어지는 현지 정착형 사업 흐름을 만들어가야 합니다.동시에 신약, 유전자 치료제 및 CDMO와 같은 차세대 영역을 중심으로, 등록·허가 운영과 원료 확보까지 아우르는 사업 밸류체인 전반의 동시 확장을 추진하여야 합니다. 이제 기업의 신뢰는 단일 제품이 아니라, 회사 전체의 운영 신뢰도로 평가받기 때문입니다.글로벌 사우스와 유망 신흥국은 향후 수요 증가와 제도 정비가 병행되는 핵심 지역입니다. 중장기 시야로 시장 조건, 규제 여건, 유통 환경을 함께 정밀 검토해 단기 거래에 그치지 않고, 지속 가능한 매출 기반을 구축하는 방식으로 접근해야 합니다. 한마디로 지금 우리 기업들에게 필요한 것은 부분적인 개선이 아니라, 혁고정신(革故鼎新), 즉, 무역의 틀을 다시 짜는 결단이라고 봅니다.이 같은 대내외 경영환경 변화에 대응해 우리 협회도 그에 걸맞는 역할을 분명히 하겠습니다. 먼저, 전시회·사절단·바이어 연계·인허가 정보·사후관리 과정을 하나의 흐름으로 묶어, 의약품 종합 무역 플랫폼으로 거듭나겠습니다. 글로벌 사우스(Global South)와 신흥국을 전략 지역으로 설정하고, 지원사업의 우선순위를 명확히 해 운영하겠습니다.다음으로, 국제 규제 변화와 제도 개편 흐름을 회원사가 사전에 활용할 수 있도록 규제 정보의 조기 경보 체계를 정교화하겠습니다. 정부와의 협력을 통해 변화의 방향을 조기에 공유하고, 기업의 대응 부담을 구조적으로 낮추도록 노력하겠습니다.아울러 회원사의 글로벌화 지원을 위해 우리 협회가 지난해 체결한 한·중·일 MOU와 같이 글로벌 협력 네트워크를 더욱 강화해 CDMO 및 원료 조달 연계 모델이 실질적으로 가동될 수 있도록 힘쓰겠습니다. 생산과 조달의 연속성을 높여 공급 리스크를 줄이고, 역내 협업을 통해 글로벌 확장 가능성을 넓히겠습니다.또한 한국의약품시험연구원의 시험·평가·품질 역량을 국가 신뢰를 형성하는 핵심 인프라 수준으로 끌어올려, 우리 기업들의 대외무역 신용도를 높이는 토대로 다지도록 하겠습니다.마지막으로 이를 뒷받침하기 위해 협회 운영을 지속적으로 혁신하겠습니다. 의사결정 속도와 책임성을 높이고, 현장 대응이 가능한 조직으로 재정비해 회원사가 필요할 때 즉시 도움을 받을 수 있는 기동력 있는 체제로 거듭나겠습니다.2026년은 한국 제약바이오의 경쟁력과 신뢰가 국제 시장에서 본격적으로 평가받는 해가 될 것입니다. 회원사 여러분의 도전이 더 큰 성과로 이어지도록, 우리 협회는 정부·시장·네트워크를 잇는 실질적 파트너로서 역할을 다하겠습니다.회원사 여러분의 한 해에 더 큰 도약과 결실이 함께하시기를 기원합니다. 감사합니다.2026-01-01 00:00:01데일리팜 -
 새해 달라지는 약국 경영·제도 '이것만은 꼭'[데일리팜=강신국 기자] 새해 달라지는 약국 경영, 제도는 무엇이 있을까?비대면 진료 제도화부터 대체조제 사후통보 간소화까지 2026년 크고 작은 변화들이 기다리고 있다.◆조제료 인상(1월 1일) = 올해 약국 환산지수, 즉 상대가치점수당 단가는 올해 102.1원에서 105.5원으로 3.4원 오른다.이에 3일치 약국 조제료는 7020원으로 올해 대비 220원 인상된다. 91일 이상 조제료는 2만310원에서 2만990원으로 680원 인상된다.1일분 조제수가를 항목별로 살펴보면 ▲약국관리료 790원(30원↑) ▲조제기본료 1720원(60원↑) ▲복약지도료 1150원(30원↑) ▲조제료 1810원(50원↑) ▲의약품관리료 680원(20원↑)으로 각각 오른다.◆최저임금 인상(1월 1일) = 최저임금이 시간급 1만 320원으로 인상된다. 일급으로 환산하면 8시간 기준 8만 2560원, 주 근로시간 40시간 기준 월 환산액은 215만 6880원(월 환산 기준시간 수 209시간, 주당 유급주휴 8시간 포함)이 된다.최저임금은 모든 사업장에 동일하게, 근로기준법상 근로자라면 고용형태나 국적에 관계없이 모두 적용된다.다만 수습 중에 있는 근로자로서 수습을 시작한 날부터 3개월 이내인 사람은 최저임금액의 10%를 감액할 수 있다.다만 1년 미만 근로계약 체결, 단순노무업무로 고용노동부장관이 정해 고시한 직종에 종사하는 근로자라면 수습 사용중 이라도 감액적용이 불가하다.매월 1회 이상 지급되는 임금이 최저임금에 산입되며, 매월 지급하는 상여금 및 식비, 숙박비, 교통비 등 근로자의 생활보조 또는 복리후생을 위한 성질의 임금도 최저임금에 전부 산입된다.그러나 통화 이외의 것(현물)으로 지급하는 임금, 소정근로시간 또는 소정의 근로일에 대해 지급하는 임금 외의 임금은 최저임금에 산입되지 않는다.◆통합고용세액공제 개편(1월 1일) = 통합고용세액공제가 전면 개편되면서 약국도 신규 직원의 근무 연차에 따라 세액공제 혜택이 확대된다. 또 고용 감소 시 공제액을 추징하지 않기로 하고, 고용 증가 중 감소분에 한정해 공제를 배제하는 방식으로 바뀐다.신규 직원의 연속 근무에 초점을 두고 1~3년차 구간 차등을 신설했다.기존에는 청년(만 34세 이하), 장애인, 60세 이상, 경력단절여성 등을 신규 채용할 경우 1인당 공제액은 수도권 1450만원, 지방 1550만원이었다.통합고용세액공제 공제액 구조 개편하지만 내년부터는 ▲1년차 수도권 700만원 비수도권 1000만원 ▲2년차 수도권 1600만원 지방 1900만원 ▲3년차 1700만원 지방 2000만원으로 변경된다.그동안 고용 감소 시 공제액 상당분을 추징하고, 감소한 과세연도부터 전액 공제에서 배제했다.◆약무직 수당 인상(1월 2일) = 약무직 공무원의 특수업무수당은 1월 2일부터 기존 월 7만원에서 월 14만원으로 40년 만에 두 배 인상된다. 공무원 수당 등에 관한 규정 개정이 이뤄졌는데, 의무직, 간호직, 수의직 등은 꾸준히 인상돼 왔으나, 약무직은 39년간 동결돼 처우 개선 요구가 지속돼 왔다.이번 인상은 공직 약사 지원 확대와 사기 진작을 위한 조치로, 타 전문직과의 형평성 제고에도 의미가 있는 것으로 평가된다.◆대체조제 사후통보 간소화(2월 2일) = 개정된 약사법 시행규칙에 근거해 약사는 의사가 처방한 의약품을 동일 성분·제형·용량의 약으로 대체조제할 때 전화, 팩스, 정보통신 등의 방식으로 의료기관에 직접 사후통보하지 않고 심평원 정보시스템에 사후통보할 수 있게 된다.복지부는 심평원 내부에 사후통보 활성화 전담 조직을 신설하고 1월 정보시스템 테스트 오픈 절차를 거쳐 제도 연착륙을 지원한다는 계획이다.아울러 약사 대체조제 사후통보 방식을 보건복지부·건강보험심사평가원 정보시스템까지 확대하는 약사법 개정안도 공포돼, 4월 12일 시행된다.◆의료·요양·돌봄 통합서비스 전국 시행(3월 27일) = 의료·요양 등 지역 돌봄의 통합지원에 관한 법률 사행에 따라 수요자 중심의 의료·요양·돌봄서비스 통합서비스가 시작된다.노쇠·장애·질병·사고 등으로 일상생활 유지에 어려움이 있어 복합적인 지원을 필요로 하는 노인·장애인 등이 대상자이며, 보건의료, 건강관리, 장기요양, 일상생활, 가족지원 등 돌봄서비스 확대 및 연계를 지원한다.약사도 '약사법 제2조제2호에 따른 약사가 약국 및 통합지원 대상자의 가정과 사회복지시설에서 제공하는 복약지도'를 할 수 있도록 법에 명문화 돼 있어 약사 서비스가 통합돌봄의 중요한 축이될 여지를 남겨 놓았다.◆약국 명칭 등 규제(상반기 시행 예정) = 약국의 표시와 광고에서 '최대', '최고' 등 절대적이고 배타적인 표현이나 '창고형', '할인' 등 소비자를 유인하고 오남용을 유발할 가능성이 있는 명칭 사용이 제한된다. 복지부는 1월 7일까지 약사법 시행령과 시행규칙 개정안에 대한 의견을 받고 있는데 해당 조항은 공포후 즉시 발효되기 때문에 상반기 중 시행될 예정이다.즉 객관적인 근거 없이 '최대, 최고, 최초, 제일 큰' 등 배타성을 띤 절대적 표현의 용어를 사용해 소비자를 오인시킬 우려가 있는 표시 광고와 '창고형, 마트형, 성지, 특가, 할인 등의 용어를 사용해 객관적인 근거 없이 다른 약국보다 자기 약국이 제품의 다양성 및 가격 경쟁력이 우월하거나 유리하다고 나타내거나 암시하는 표시ㆍ광고를 할 수 없게 된다.◆동물병원 전문약 판매 보고 의무화(6월 21일) = 동물병원에 전문의약품을 판매하는 약국의 보고 의무가 신설된다.약국 개설자는 판매 다음달 말까지 동물병원 정보, 의약품 정보, 판매일 등을 의약품관리종합정보센터에 전산 보고해야 하며, 기한 내 미보고 또는 거짓 보고 시 100만 원의 과태료가 부과된다. 이는 6월 21일 시행되는 약사법 개정안의 위임사항을 구체화한 조치다. ◆비대면 진료와 제한적 약 배송(12월24일) = 재진 환자·의원급 의료기관 중심 허용, 전자처방전·마약류 DUR 의무화, 처방약 제한적 약국 외 전달 허용 등을 주요 내용으로 한 비대면진료가 시행된다.즉 ▲대면진료 원칙, ▲의원급 의료기관 중심, ▲재진환자 중심, ▲전담기관 금지 등 안전성 측면에서 의료계와 합의한 4대 원칙을 고려하면서, 기술 발전을 고려한 제도화가 완성됐다.비대면 진료 제도화 주요 내용아울러 처방전 위·변조 등을 방지하고 안전하고 편리하게 처방전을 전달할 수 있도록 전자처방전 전달시스템 도입 근거도 마련됐고 섬·벽지 거주자, 장기요양 수급자, 등록 장애인, 감염병 확진자, 희귀질환자 등에 대한 약 배송의 법적 근거를 마련해 취약지 거주자·취약계층 등 필요한 환자는 비대면진료 후 처방약을 편리하게 수령할 수 있도록 했고 대상자 특성에 맞게 약 배송 지역을 정할 수 있도록 했다.다만 비대면 진료 플랫폼의 의약품 도매업체 금지는 국회 본회의 심사를 앞두고 계류됐다.2025-12-31 12:07:28강신국 기자
새해 달라지는 약국 경영·제도 '이것만은 꼭'[데일리팜=강신국 기자] 새해 달라지는 약국 경영, 제도는 무엇이 있을까?비대면 진료 제도화부터 대체조제 사후통보 간소화까지 2026년 크고 작은 변화들이 기다리고 있다.◆조제료 인상(1월 1일) = 올해 약국 환산지수, 즉 상대가치점수당 단가는 올해 102.1원에서 105.5원으로 3.4원 오른다.이에 3일치 약국 조제료는 7020원으로 올해 대비 220원 인상된다. 91일 이상 조제료는 2만310원에서 2만990원으로 680원 인상된다.1일분 조제수가를 항목별로 살펴보면 ▲약국관리료 790원(30원↑) ▲조제기본료 1720원(60원↑) ▲복약지도료 1150원(30원↑) ▲조제료 1810원(50원↑) ▲의약품관리료 680원(20원↑)으로 각각 오른다.◆최저임금 인상(1월 1일) = 최저임금이 시간급 1만 320원으로 인상된다. 일급으로 환산하면 8시간 기준 8만 2560원, 주 근로시간 40시간 기준 월 환산액은 215만 6880원(월 환산 기준시간 수 209시간, 주당 유급주휴 8시간 포함)이 된다.최저임금은 모든 사업장에 동일하게, 근로기준법상 근로자라면 고용형태나 국적에 관계없이 모두 적용된다.다만 수습 중에 있는 근로자로서 수습을 시작한 날부터 3개월 이내인 사람은 최저임금액의 10%를 감액할 수 있다.다만 1년 미만 근로계약 체결, 단순노무업무로 고용노동부장관이 정해 고시한 직종에 종사하는 근로자라면 수습 사용중 이라도 감액적용이 불가하다.매월 1회 이상 지급되는 임금이 최저임금에 산입되며, 매월 지급하는 상여금 및 식비, 숙박비, 교통비 등 근로자의 생활보조 또는 복리후생을 위한 성질의 임금도 최저임금에 전부 산입된다.그러나 통화 이외의 것(현물)으로 지급하는 임금, 소정근로시간 또는 소정의 근로일에 대해 지급하는 임금 외의 임금은 최저임금에 산입되지 않는다.◆통합고용세액공제 개편(1월 1일) = 통합고용세액공제가 전면 개편되면서 약국도 신규 직원의 근무 연차에 따라 세액공제 혜택이 확대된다. 또 고용 감소 시 공제액을 추징하지 않기로 하고, 고용 증가 중 감소분에 한정해 공제를 배제하는 방식으로 바뀐다.신규 직원의 연속 근무에 초점을 두고 1~3년차 구간 차등을 신설했다.기존에는 청년(만 34세 이하), 장애인, 60세 이상, 경력단절여성 등을 신규 채용할 경우 1인당 공제액은 수도권 1450만원, 지방 1550만원이었다.통합고용세액공제 공제액 구조 개편하지만 내년부터는 ▲1년차 수도권 700만원 비수도권 1000만원 ▲2년차 수도권 1600만원 지방 1900만원 ▲3년차 1700만원 지방 2000만원으로 변경된다.그동안 고용 감소 시 공제액 상당분을 추징하고, 감소한 과세연도부터 전액 공제에서 배제했다.◆약무직 수당 인상(1월 2일) = 약무직 공무원의 특수업무수당은 1월 2일부터 기존 월 7만원에서 월 14만원으로 40년 만에 두 배 인상된다. 공무원 수당 등에 관한 규정 개정이 이뤄졌는데, 의무직, 간호직, 수의직 등은 꾸준히 인상돼 왔으나, 약무직은 39년간 동결돼 처우 개선 요구가 지속돼 왔다.이번 인상은 공직 약사 지원 확대와 사기 진작을 위한 조치로, 타 전문직과의 형평성 제고에도 의미가 있는 것으로 평가된다.◆대체조제 사후통보 간소화(2월 2일) = 개정된 약사법 시행규칙에 근거해 약사는 의사가 처방한 의약품을 동일 성분·제형·용량의 약으로 대체조제할 때 전화, 팩스, 정보통신 등의 방식으로 의료기관에 직접 사후통보하지 않고 심평원 정보시스템에 사후통보할 수 있게 된다.복지부는 심평원 내부에 사후통보 활성화 전담 조직을 신설하고 1월 정보시스템 테스트 오픈 절차를 거쳐 제도 연착륙을 지원한다는 계획이다.아울러 약사 대체조제 사후통보 방식을 보건복지부·건강보험심사평가원 정보시스템까지 확대하는 약사법 개정안도 공포돼, 4월 12일 시행된다.◆의료·요양·돌봄 통합서비스 전국 시행(3월 27일) = 의료·요양 등 지역 돌봄의 통합지원에 관한 법률 사행에 따라 수요자 중심의 의료·요양·돌봄서비스 통합서비스가 시작된다.노쇠·장애·질병·사고 등으로 일상생활 유지에 어려움이 있어 복합적인 지원을 필요로 하는 노인·장애인 등이 대상자이며, 보건의료, 건강관리, 장기요양, 일상생활, 가족지원 등 돌봄서비스 확대 및 연계를 지원한다.약사도 '약사법 제2조제2호에 따른 약사가 약국 및 통합지원 대상자의 가정과 사회복지시설에서 제공하는 복약지도'를 할 수 있도록 법에 명문화 돼 있어 약사 서비스가 통합돌봄의 중요한 축이될 여지를 남겨 놓았다.◆약국 명칭 등 규제(상반기 시행 예정) = 약국의 표시와 광고에서 '최대', '최고' 등 절대적이고 배타적인 표현이나 '창고형', '할인' 등 소비자를 유인하고 오남용을 유발할 가능성이 있는 명칭 사용이 제한된다. 복지부는 1월 7일까지 약사법 시행령과 시행규칙 개정안에 대한 의견을 받고 있는데 해당 조항은 공포후 즉시 발효되기 때문에 상반기 중 시행될 예정이다.즉 객관적인 근거 없이 '최대, 최고, 최초, 제일 큰' 등 배타성을 띤 절대적 표현의 용어를 사용해 소비자를 오인시킬 우려가 있는 표시 광고와 '창고형, 마트형, 성지, 특가, 할인 등의 용어를 사용해 객관적인 근거 없이 다른 약국보다 자기 약국이 제품의 다양성 및 가격 경쟁력이 우월하거나 유리하다고 나타내거나 암시하는 표시ㆍ광고를 할 수 없게 된다.◆동물병원 전문약 판매 보고 의무화(6월 21일) = 동물병원에 전문의약품을 판매하는 약국의 보고 의무가 신설된다.약국 개설자는 판매 다음달 말까지 동물병원 정보, 의약품 정보, 판매일 등을 의약품관리종합정보센터에 전산 보고해야 하며, 기한 내 미보고 또는 거짓 보고 시 100만 원의 과태료가 부과된다. 이는 6월 21일 시행되는 약사법 개정안의 위임사항을 구체화한 조치다. ◆비대면 진료와 제한적 약 배송(12월24일) = 재진 환자·의원급 의료기관 중심 허용, 전자처방전·마약류 DUR 의무화, 처방약 제한적 약국 외 전달 허용 등을 주요 내용으로 한 비대면진료가 시행된다.즉 ▲대면진료 원칙, ▲의원급 의료기관 중심, ▲재진환자 중심, ▲전담기관 금지 등 안전성 측면에서 의료계와 합의한 4대 원칙을 고려하면서, 기술 발전을 고려한 제도화가 완성됐다.비대면 진료 제도화 주요 내용아울러 처방전 위·변조 등을 방지하고 안전하고 편리하게 처방전을 전달할 수 있도록 전자처방전 전달시스템 도입 근거도 마련됐고 섬·벽지 거주자, 장기요양 수급자, 등록 장애인, 감염병 확진자, 희귀질환자 등에 대한 약 배송의 법적 근거를 마련해 취약지 거주자·취약계층 등 필요한 환자는 비대면진료 후 처방약을 편리하게 수령할 수 있도록 했고 대상자 특성에 맞게 약 배송 지역을 정할 수 있도록 했다.다만 비대면 진료 플랫폼의 의약품 도매업체 금지는 국회 본회의 심사를 앞두고 계류됐다.2025-12-31 12:07:28강신국 기자 -
 일반약 10년새 8천개↓·건기식 2만5천개↑...양극화 심화[데일리팜=천승현 기자] 국내 등록된 건강기능식품과 일반의약품 품목 수 격차가 크게 벌어졌다. 건강기능식품은 지난 10년간 2배 이상 증가하면서 일반의약품을 추월한지 9년 만에 품목 수가 5배에 달했다. 일반의약품은 10년간 절반 수준으로 감소하며 시장 진입 움직임이 크게 위축된 양상이다. 일반의약품 허가 제품 2개 중 1개는 생산실적이 없는 개점휴업으로 나타났다. 31일 식품의약품안전처의 ‘2025년 식품의약품통계연보’에 따르면 지난해 일반의약품 품목 수는 8630개로 집계됐다. 2023년 9120개에서 1년 만에 490개 감소했다. 국내 허가받은 일반의약품 품목 수는 감소 추세가 계속되는 흐름이다. 지난 2014년 1만6717개에서 10년 동안 절반 수준으로 쪼그라들었다. 일반의약품 품목 수는 지난 2018년 1만4175개에서 2019년 8378개로 5797개 감소한 이후 2020년 다시 1만개를 회복했지만 2021년부터 내리막이 계속됐다. 일반의약품 품목 수는 2022년 8813개에서 이듬해 9120개로 307개 늘었지만 1년 만에 감소세로 돌아섰다. 연도별 국내 등록 일반의약품과 건강기능식품 품목 수(단위: 개, 자료: 식품의약품안전처)국내 일반의약품 시장에서 신규 진출 제품보다 철수한 제품이 훨씬 많았다는 얘기다. 의약품 시장은 지속적으로 품목 허가 갱신과 같은 안전관리 제도로 많은 제품이 사라진다. 의약품 품목 갱신제는 보건당국서 허가 받은 의약품은 5년 마다 효능·안전성을 재입증해야 허가가 유지되는 내용이 핵심이다. 상당수 제품은 유효기간 만료시 시장성이 떨어진다고 판단되면 갱신을 포기하고 시장에서 철수하기도 한다. 건강기능식품이 매년 지속적으로 증가하는 것과 대조적인 현상이다. 지난해 건강기능식품 제조 품목 수는 4만1896개로 1년 전보다 4622개 증가했다. 건강기능식품 품목 수는 지난 2014년 1만6632개에서 10년 동안 2만5264개 증가하며 2.5배 가량 확대됐다. 건강기능식품은 지난 2014년에는 일반의약품보다 품목 수가 85개 적었다. 2015년 건강기능식품 품목 수가 1만8956개로 일반의약품 1만4892개를 4064개 차이로 추월했고 이후 격차가 점차적으로 확대됐다. 지난해 건강기능식품 품목 수는 일반의약품보다 5배 가량 많은 것으로 나타났다. 생산실적이 있는 일반의약품과의 격차는 더욱 커진다. 지난해 생산실적이 있는 일반의약품은 4631개로 2023년 4873개로 나타났다. 식약처 허가를 유지 중인 일반의약품 중 절반 가량은 생산실적이 없다느 얘기다. 생산실적이 있는 일반약 품목 수는 2014년 6075개에서 10년 동안 1444개 감소했다. 건강기능식품 시장 규모가 지속적으로 커지는데다 시장 진입 장벽도 일반의약품보다 상대적으로 낮아 신규 진출 움직임이 활발한 것으로 분석된다. 지난해 건강기능식품 시장은 4조131억원으로 전년보다 1.9% 줄었다. 2022년 4조1695억원에서 2년 연속 감소했다. 업계에서는 건강기능식품의 신규 진출 활발로 저가 경쟁이 치열해지면서 시장 규모 축소에도 영향을 미친 것으로 분석한다. 다만 2014년 2조4130억원과 비교하면 146.1% 확대되면서 최근 시장 규모는 급증했다. 연도별 건강기능식품 시장 규모와 일반의약품 생산실적(단위: 억원, 자료: 식품의약품안전처)지난 2003년 건강기능식품에 관한 법률이 제정되면서 본격적으로 건강기능식품 제도가 시행됐다. 건강기능식품의 안전성 확보 및 품질 향상과 건전한 유통·판매를 도모함으로써 국민의 건강 증진과 소비자 보호에 기여하겠다는 게 건강기능식품법의 도입 취지다. 국내 건강기능식품 시장은 2010년 처음으로 1조원을 넘어섰고 2016년에는 2조원을 돌파했다. 건강기능식품 시장 규모는 2020년 3조원대로 성장했고 2021년부터 4조원 이상을 형성하고 있다. 일반의약품은 품목 수는 감소 추세가 계속됐지만 생산실적은 반짝 상승세를 나타냈다. 지난해 일반약 생산 규모는 4조2357억원으로 전년대비 9.9% 증가했다. 작년 일반약 생산액은 역대 최대 규모다. 일반약 생산액은 2020년 3조1779억원에서 2021년 3조692억원으로 감소했지만 2022년부터 상승세로 돌아섰다. 지난 2022년 일반약 생산실적은 3조5848억원으로 전년보다 16.8% 늘었고 2023년에는 전년대비 7.5% 증가한 3조8554억원을 기록했다. 지난해 일반약 생산규모는 2021년과 비교하면 3년 새 38.0% 증가하며 처음으로 4조원을 넘어섰다. 최근 일반약 생산실적 확대는 코로나19 팬데믹과 엔데믹이 가장 큰 영향을 미친 것으로 분석된다. 2021년 말부터 코로나19 확진자가 많으면 하루에 수십만명 쏟아지면서 코로나19 증상 완화 용도로 사용되는 해열진통제나 감기약 판매가 크게 늘었다. 2023년부터 코로나19 엔데믹 이후 독감이나 감기환자가 급증하면서 일반약 시장 호황이 계속된 것으로 분석된다.2025-12-31 12:07:24천승현 기자
일반약 10년새 8천개↓·건기식 2만5천개↑...양극화 심화[데일리팜=천승현 기자] 국내 등록된 건강기능식품과 일반의약품 품목 수 격차가 크게 벌어졌다. 건강기능식품은 지난 10년간 2배 이상 증가하면서 일반의약품을 추월한지 9년 만에 품목 수가 5배에 달했다. 일반의약품은 10년간 절반 수준으로 감소하며 시장 진입 움직임이 크게 위축된 양상이다. 일반의약품 허가 제품 2개 중 1개는 생산실적이 없는 개점휴업으로 나타났다. 31일 식품의약품안전처의 ‘2025년 식품의약품통계연보’에 따르면 지난해 일반의약품 품목 수는 8630개로 집계됐다. 2023년 9120개에서 1년 만에 490개 감소했다. 국내 허가받은 일반의약품 품목 수는 감소 추세가 계속되는 흐름이다. 지난 2014년 1만6717개에서 10년 동안 절반 수준으로 쪼그라들었다. 일반의약품 품목 수는 지난 2018년 1만4175개에서 2019년 8378개로 5797개 감소한 이후 2020년 다시 1만개를 회복했지만 2021년부터 내리막이 계속됐다. 일반의약품 품목 수는 2022년 8813개에서 이듬해 9120개로 307개 늘었지만 1년 만에 감소세로 돌아섰다. 연도별 국내 등록 일반의약품과 건강기능식품 품목 수(단위: 개, 자료: 식품의약품안전처)국내 일반의약품 시장에서 신규 진출 제품보다 철수한 제품이 훨씬 많았다는 얘기다. 의약품 시장은 지속적으로 품목 허가 갱신과 같은 안전관리 제도로 많은 제품이 사라진다. 의약품 품목 갱신제는 보건당국서 허가 받은 의약품은 5년 마다 효능·안전성을 재입증해야 허가가 유지되는 내용이 핵심이다. 상당수 제품은 유효기간 만료시 시장성이 떨어진다고 판단되면 갱신을 포기하고 시장에서 철수하기도 한다. 건강기능식품이 매년 지속적으로 증가하는 것과 대조적인 현상이다. 지난해 건강기능식품 제조 품목 수는 4만1896개로 1년 전보다 4622개 증가했다. 건강기능식품 품목 수는 지난 2014년 1만6632개에서 10년 동안 2만5264개 증가하며 2.5배 가량 확대됐다. 건강기능식품은 지난 2014년에는 일반의약품보다 품목 수가 85개 적었다. 2015년 건강기능식품 품목 수가 1만8956개로 일반의약품 1만4892개를 4064개 차이로 추월했고 이후 격차가 점차적으로 확대됐다. 지난해 건강기능식품 품목 수는 일반의약품보다 5배 가량 많은 것으로 나타났다. 생산실적이 있는 일반의약품과의 격차는 더욱 커진다. 지난해 생산실적이 있는 일반의약품은 4631개로 2023년 4873개로 나타났다. 식약처 허가를 유지 중인 일반의약품 중 절반 가량은 생산실적이 없다느 얘기다. 생산실적이 있는 일반약 품목 수는 2014년 6075개에서 10년 동안 1444개 감소했다. 건강기능식품 시장 규모가 지속적으로 커지는데다 시장 진입 장벽도 일반의약품보다 상대적으로 낮아 신규 진출 움직임이 활발한 것으로 분석된다. 지난해 건강기능식품 시장은 4조131억원으로 전년보다 1.9% 줄었다. 2022년 4조1695억원에서 2년 연속 감소했다. 업계에서는 건강기능식품의 신규 진출 활발로 저가 경쟁이 치열해지면서 시장 규모 축소에도 영향을 미친 것으로 분석한다. 다만 2014년 2조4130억원과 비교하면 146.1% 확대되면서 최근 시장 규모는 급증했다. 연도별 건강기능식품 시장 규모와 일반의약품 생산실적(단위: 억원, 자료: 식품의약품안전처)지난 2003년 건강기능식품에 관한 법률이 제정되면서 본격적으로 건강기능식품 제도가 시행됐다. 건강기능식품의 안전성 확보 및 품질 향상과 건전한 유통·판매를 도모함으로써 국민의 건강 증진과 소비자 보호에 기여하겠다는 게 건강기능식품법의 도입 취지다. 국내 건강기능식품 시장은 2010년 처음으로 1조원을 넘어섰고 2016년에는 2조원을 돌파했다. 건강기능식품 시장 규모는 2020년 3조원대로 성장했고 2021년부터 4조원 이상을 형성하고 있다. 일반의약품은 품목 수는 감소 추세가 계속됐지만 생산실적은 반짝 상승세를 나타냈다. 지난해 일반약 생산 규모는 4조2357억원으로 전년대비 9.9% 증가했다. 작년 일반약 생산액은 역대 최대 규모다. 일반약 생산액은 2020년 3조1779억원에서 2021년 3조692억원으로 감소했지만 2022년부터 상승세로 돌아섰다. 지난 2022년 일반약 생산실적은 3조5848억원으로 전년보다 16.8% 늘었고 2023년에는 전년대비 7.5% 증가한 3조8554억원을 기록했다. 지난해 일반약 생산규모는 2021년과 비교하면 3년 새 38.0% 증가하며 처음으로 4조원을 넘어섰다. 최근 일반약 생산실적 확대는 코로나19 팬데믹과 엔데믹이 가장 큰 영향을 미친 것으로 분석된다. 2021년 말부터 코로나19 확진자가 많으면 하루에 수십만명 쏟아지면서 코로나19 증상 완화 용도로 사용되는 해열진통제나 감기약 판매가 크게 늘었다. 2023년부터 코로나19 엔데믹 이후 독감이나 감기환자가 급증하면서 일반약 시장 호황이 계속된 것으로 분석된다.2025-12-31 12:07:24천승현 기자 -
 "편의점약 품목수 확대...주기적인 재분류 필요"[데일리팜=강혜경 기자]상황과 수요를 반영하지 못하는 안전상비의약품 제도를 즉각 개정해 품목 수 지정 조문은 삭제하고, 주기적인 재분류에 대한 강제성을 부여하기 위해 법률에서 언급할 필요가 있다는 제언이 도출됐다.최근 발간된 '일반의약품 및 약국외 판매의약품 확대방안' 국회미래연구원 보고서.건강보험 재정 효율화와 의료접근성 향상, 자가투약 활성화 관점에서 수동적으로 운용되고 있는 의약품 재분류 역시 안전성·유효성·실사용 데이터에 기반한 상시·주기적 재평가 체계로 전환이 필요하다는 연구가 국회미래연구원 보고서에 실렸다.인구센터 허종호 연구위원은 '일반의약품 및 약국외 판매의약품 확대 방안' 보고서에서 안전상비약과 재분류 한계를 지적했다. 일반약 가운데 '안전상비약' 13개 품목이 편의점 판매 대상으로 운영되고 있으나, 품목 지정 후 10년 넘게 품목 수의 변동이 이뤄진 바 없어 변화된 상황과 수요를 반영하지 못하고 있다고 지적했다.또한 주요 선진국이 처방의약품에서 비처방의약품으로의 전환과 자가투약 확대를 통해 의료비·약품비 압력을 완화하고 있음에도 우리나라 재분류는 2020년, 2012년, 2021년 세 차례에 그치며 매우 수동적으로 운용되고 있다는 지적이다.약품비 매년 증가…인구 고령화에 따른 약품비 부담 심화허종호 연구위원은 연구 배경 및 필요성에서 "의약품의 합리적인 분류는 국민 보건 향상에 기여할 뿐만 아니라 의료보험 재정에도 영향을 미치는 정책"이라며 "선진국은 일종 요건을 충족하는 처방의약품을 비처방의약품(일반의약품 및 약국 외 판매의약품)으로 전환하는 방식으로 비처방의약품을 통한 자가투약을 점진적으로 확대·활성화하는 방향이 뚜렷한 데 반해 국내 의약품 (재)분류 시스템은 건강보험 재정 효율성 측면은 물론 의약품 접근성과 자가투약 측면에서도 매우 미흡하다"고 꼬집었다.연구진은 의약분업 이후 진행된 분류 변경이 2차례에 불과하다고 지적했다.2000년 의약분업을 위한 분류 이후 2012년 8월에야 대규모 재분류 작업이 한 차례 실시됐으나 그 이후 13년이 지난 현재까지 재분류가 이뤄진 바 없으며, 전문의약품과 일반의약품 간의 (재)분류 뿐만 아니라 (재)분류 규정 내에 약국외 판매의약품에 대한 논의 자체는 아예 배제돼 있다는 것이다.때문에 해열·진통제, 감기약, 소화제, 파스 등 13개 품목이 편의점 판매 대상으로 운영되고 있으나 품목 지정 후 10년이 넘게 지나도록 품목 수의 변동이 이뤄진 바 없어 변화된 상황과 수요를 반영하지 못하고 있는 것 또한 문제라는 것.연구진은 급증하는 건강보험 약품비 지출을 감안하면 약품 재분류의 필요성은 더욱 커지고 있다고 강조했다.2011년 총진료비는 47.4조원에서 2024년 119.2조원으로 매년 꾸준히 증가하고 있으며, 특히 65세 이상 노인 인구의 약품 청구액은 2011년 5.2조원에서 2024년 14.0조원으로 증가하는 등 노인 약품비 청구 비중은 2011년 39.7%에서 2024년 51.7%로 꾸준히 상승했다는 설명이다.미국·일본 셀프메디케이션 강조…의료비 절감 효과 뚜렷연구진은 미국을 비롯한 선진국의 경우 일반의약품의 비율이 매우 높고 일반의약품 슈퍼판매 제도 등 소비자의 접근성을 강화하는 방향으로 진행되고 있어 환자의 자가투약과 관련된 의약품 영역이 점점 넓어지고 있다고 판단했다.미국의 경우 라타딘, 세티리진, 페폭사티딘 등 2세대 항히스타민제를 슈퍼·드럭스토어에서 OTC로 구매할 수 있다. 해외 선진국에서는 안전성 및 효능에 대한 자료가 확립된 품목의 경우 허가·승인 절차를 간소화함으로써 일반의약품의 시장 진출을 용이하게 하고 있다.일본 역시 급속한 고령화와 이에 따른 의료비 증가에 대응하기 위해 셀프메디케이션을 중요한 보건의료 정책 수단으로 도입, 의료용 의약품을 단계적으로 일반용 의약품으로 전환하는 Switch OTC 제도를 운영하고 있다.또한 2017년부터 셀프 메디케이션 세제(Self-Medication Tax System) 제도를 도입해 건강검진이나 예방접종 등을 통해 건강유지·증진활동을 수행한 납세자가 Rx-to-OTC Switch 의약품 및 일부 일반용 의약품을 연간 1만2000엔 이상 초과 구입한 경우 초과분(최대 8만8000엔)을 종합소득세에서 공제받을 수 있도록 함으로써 개인의 자가투약을 촉진하고 공적 의료보험 재정의 지속가능성을 제고하는 재정적 인센티브로 기능한다는 평가다.프랑스는 외래 급여 의약품에 대해 최초 등재 후 5년 마다 정기적인 재평가를 법적으로 의무화한 대표적인 국가로, 재평가를 통해 보험 급여 유지 여부와 급여율을 체계적으로 조정하고 있다.약제의 의료적 가치와 기존 치료 대비 추가적 의료적 가치를 평가해 '불충분'으로 판정된 약제는 원칙적으로 외래 급여 목록에서 제외되며, '약함'으로 평가된 약제에 대해서도 급여율 인하나 급여 범위 제한이 이뤄진다. 이러한 과정에서 급여에서 제외된 약제는 가격 규제에서 벗어나 자유 가격제로 전환되고, 상당수 품목이 일반의약품으로 소비자의 자가구매 영역에서 취급되면서 공적 보험 재정 부담에서 점진적으로 이탈하게 된다는 것.3분류 체계 정리, 일반의약품·약국외 판매의약품 확대보고서에 소개된 정책적 개선 방안.정책적 개선 방안에서 연구진은 3분류 체계 정리를 선행 조건으로 제시했다. 약사법 개정 등을 통해 전문의약품, 일반의약품, 약국외 판매 의약품의 세 가지 분류를 법률 차원에서 명확하고 일관되게 규정할 필요가 있다는 주장이다.현재 각 분류에 대한 정의와 기준은 법령과 행정규칙에 산발적으로 흩어져 있어 규범 체계의 예측 가능성과 투명성을 저해하는 만큼 각 분류의 기본 원칙과 범위를 일관되고 연속성 있게 법률에서 명시할 필요가 있다는 것이다.이 때 분류 체계의 기준을 '처방 필요 여부'와 '판매 가능 장소'로 이원화해 보다 직관적인 구조로 개설계할 필요가 있으며, 감기약·소화제·소염진통제 등 일반약으로도 충분한 경증질환에 대해 건강보험이 적용되는 처방약은 비급여화를 통해 처방의존성을 낮추고 불필요한 외래 방문을 줄여 재정 비효율을 줄일 수 있다는 기대다.특히 품목명 20개로 고정돼 있으면서 10년 동안 한 번도 개정되지 않은 약국외 판매의약품에 대해서는 즉각적인 법 개정이 필요한데 구체적으로는 안전상비의약품의 품목 수 지정 조문은 삭제하고, 주기적인 재분류에 대한 강제성을 부여하기 위해 법률에서 언급할 필요가 있다는 설명이다.주기적인 재평가 및 재분류 범위 확대를 통한 일반의약품, 약국외 판매의약품 확대도 제시됐다.현재처럼 이의 제기 시에만 작동하는 수동적 구조에서 벗어나 보건의료 환경 변화에 능동적으로 대응하는 상시·주기적 시스템으로 전환될 필요가 있다는 주장이다.아울러 향후 인구구조 변화로 인한 인구소멸지역이나 지방 농촌지역의 경우 약국을 통한 의약품 접근성에 한계가 있을 것으로 예상할 수 있는 바, 이런 경우를 대비해서도 약국외 판매 의약품 확대는 검토돼야 할 부분이라는 설명이다.다만 자가투약 확대가 안전성 저하로 이어지지 않도록 재분류 과정에서 복약지도가 특히 중요한 질환·약제는 약사 상담을 전제로 한 비처방군(약국 전용 비처방의약품)으로 관리하는 등 세분화된 분류와 위험기반 관리가 병행돼야 한다는 것이다.연구진은 정책 부작용을 최소화하기 위한 보완적 정책 시행 필요성도 강조했다.정책적 관점에서 자가투약은 분명한 이점과 잠재적 위험을 동시에 내포하는 만큼 체계적인 보완 장치가 요구된다는 것이다. 특히 항생제나 강력한 진통제와 같은 고위험 의약품에 대해서는 오남용 관리체계와 더불어 명료한 라벨과 이해하기 쉬운 환자용 설명서 제공, 약사의 복약상담 의무화, 대중광고·온라인 마케팅에 대한 엄격한 규제가 필수적으로 수반될 필요가 있다는 견해다.궁극적으로는 이러한 안전장치를 포함한 제도·교육·규제 패키지를 설계함으로써 자가투약이 기존 의료체계를 대체하는 것이 아니라 상호보완적으로 작동하도록 유도해야 한다고 덧붙였다.2025-12-31 12:07:20강혜경 기자
"편의점약 품목수 확대...주기적인 재분류 필요"[데일리팜=강혜경 기자]상황과 수요를 반영하지 못하는 안전상비의약품 제도를 즉각 개정해 품목 수 지정 조문은 삭제하고, 주기적인 재분류에 대한 강제성을 부여하기 위해 법률에서 언급할 필요가 있다는 제언이 도출됐다.최근 발간된 '일반의약품 및 약국외 판매의약품 확대방안' 국회미래연구원 보고서.건강보험 재정 효율화와 의료접근성 향상, 자가투약 활성화 관점에서 수동적으로 운용되고 있는 의약품 재분류 역시 안전성·유효성·실사용 데이터에 기반한 상시·주기적 재평가 체계로 전환이 필요하다는 연구가 국회미래연구원 보고서에 실렸다.인구센터 허종호 연구위원은 '일반의약품 및 약국외 판매의약품 확대 방안' 보고서에서 안전상비약과 재분류 한계를 지적했다. 일반약 가운데 '안전상비약' 13개 품목이 편의점 판매 대상으로 운영되고 있으나, 품목 지정 후 10년 넘게 품목 수의 변동이 이뤄진 바 없어 변화된 상황과 수요를 반영하지 못하고 있다고 지적했다.또한 주요 선진국이 처방의약품에서 비처방의약품으로의 전환과 자가투약 확대를 통해 의료비·약품비 압력을 완화하고 있음에도 우리나라 재분류는 2020년, 2012년, 2021년 세 차례에 그치며 매우 수동적으로 운용되고 있다는 지적이다.약품비 매년 증가…인구 고령화에 따른 약품비 부담 심화허종호 연구위원은 연구 배경 및 필요성에서 "의약품의 합리적인 분류는 국민 보건 향상에 기여할 뿐만 아니라 의료보험 재정에도 영향을 미치는 정책"이라며 "선진국은 일종 요건을 충족하는 처방의약품을 비처방의약품(일반의약품 및 약국 외 판매의약품)으로 전환하는 방식으로 비처방의약품을 통한 자가투약을 점진적으로 확대·활성화하는 방향이 뚜렷한 데 반해 국내 의약품 (재)분류 시스템은 건강보험 재정 효율성 측면은 물론 의약품 접근성과 자가투약 측면에서도 매우 미흡하다"고 꼬집었다.연구진은 의약분업 이후 진행된 분류 변경이 2차례에 불과하다고 지적했다.2000년 의약분업을 위한 분류 이후 2012년 8월에야 대규모 재분류 작업이 한 차례 실시됐으나 그 이후 13년이 지난 현재까지 재분류가 이뤄진 바 없으며, 전문의약품과 일반의약품 간의 (재)분류 뿐만 아니라 (재)분류 규정 내에 약국외 판매의약품에 대한 논의 자체는 아예 배제돼 있다는 것이다.때문에 해열·진통제, 감기약, 소화제, 파스 등 13개 품목이 편의점 판매 대상으로 운영되고 있으나 품목 지정 후 10년이 넘게 지나도록 품목 수의 변동이 이뤄진 바 없어 변화된 상황과 수요를 반영하지 못하고 있는 것 또한 문제라는 것.연구진은 급증하는 건강보험 약품비 지출을 감안하면 약품 재분류의 필요성은 더욱 커지고 있다고 강조했다.2011년 총진료비는 47.4조원에서 2024년 119.2조원으로 매년 꾸준히 증가하고 있으며, 특히 65세 이상 노인 인구의 약품 청구액은 2011년 5.2조원에서 2024년 14.0조원으로 증가하는 등 노인 약품비 청구 비중은 2011년 39.7%에서 2024년 51.7%로 꾸준히 상승했다는 설명이다.미국·일본 셀프메디케이션 강조…의료비 절감 효과 뚜렷연구진은 미국을 비롯한 선진국의 경우 일반의약품의 비율이 매우 높고 일반의약품 슈퍼판매 제도 등 소비자의 접근성을 강화하는 방향으로 진행되고 있어 환자의 자가투약과 관련된 의약품 영역이 점점 넓어지고 있다고 판단했다.미국의 경우 라타딘, 세티리진, 페폭사티딘 등 2세대 항히스타민제를 슈퍼·드럭스토어에서 OTC로 구매할 수 있다. 해외 선진국에서는 안전성 및 효능에 대한 자료가 확립된 품목의 경우 허가·승인 절차를 간소화함으로써 일반의약품의 시장 진출을 용이하게 하고 있다.일본 역시 급속한 고령화와 이에 따른 의료비 증가에 대응하기 위해 셀프메디케이션을 중요한 보건의료 정책 수단으로 도입, 의료용 의약품을 단계적으로 일반용 의약품으로 전환하는 Switch OTC 제도를 운영하고 있다.또한 2017년부터 셀프 메디케이션 세제(Self-Medication Tax System) 제도를 도입해 건강검진이나 예방접종 등을 통해 건강유지·증진활동을 수행한 납세자가 Rx-to-OTC Switch 의약품 및 일부 일반용 의약품을 연간 1만2000엔 이상 초과 구입한 경우 초과분(최대 8만8000엔)을 종합소득세에서 공제받을 수 있도록 함으로써 개인의 자가투약을 촉진하고 공적 의료보험 재정의 지속가능성을 제고하는 재정적 인센티브로 기능한다는 평가다.프랑스는 외래 급여 의약품에 대해 최초 등재 후 5년 마다 정기적인 재평가를 법적으로 의무화한 대표적인 국가로, 재평가를 통해 보험 급여 유지 여부와 급여율을 체계적으로 조정하고 있다.약제의 의료적 가치와 기존 치료 대비 추가적 의료적 가치를 평가해 '불충분'으로 판정된 약제는 원칙적으로 외래 급여 목록에서 제외되며, '약함'으로 평가된 약제에 대해서도 급여율 인하나 급여 범위 제한이 이뤄진다. 이러한 과정에서 급여에서 제외된 약제는 가격 규제에서 벗어나 자유 가격제로 전환되고, 상당수 품목이 일반의약품으로 소비자의 자가구매 영역에서 취급되면서 공적 보험 재정 부담에서 점진적으로 이탈하게 된다는 것.3분류 체계 정리, 일반의약품·약국외 판매의약품 확대보고서에 소개된 정책적 개선 방안.정책적 개선 방안에서 연구진은 3분류 체계 정리를 선행 조건으로 제시했다. 약사법 개정 등을 통해 전문의약품, 일반의약품, 약국외 판매 의약품의 세 가지 분류를 법률 차원에서 명확하고 일관되게 규정할 필요가 있다는 주장이다.현재 각 분류에 대한 정의와 기준은 법령과 행정규칙에 산발적으로 흩어져 있어 규범 체계의 예측 가능성과 투명성을 저해하는 만큼 각 분류의 기본 원칙과 범위를 일관되고 연속성 있게 법률에서 명시할 필요가 있다는 것이다.이 때 분류 체계의 기준을 '처방 필요 여부'와 '판매 가능 장소'로 이원화해 보다 직관적인 구조로 개설계할 필요가 있으며, 감기약·소화제·소염진통제 등 일반약으로도 충분한 경증질환에 대해 건강보험이 적용되는 처방약은 비급여화를 통해 처방의존성을 낮추고 불필요한 외래 방문을 줄여 재정 비효율을 줄일 수 있다는 기대다.특히 품목명 20개로 고정돼 있으면서 10년 동안 한 번도 개정되지 않은 약국외 판매의약품에 대해서는 즉각적인 법 개정이 필요한데 구체적으로는 안전상비의약품의 품목 수 지정 조문은 삭제하고, 주기적인 재분류에 대한 강제성을 부여하기 위해 법률에서 언급할 필요가 있다는 설명이다.주기적인 재평가 및 재분류 범위 확대를 통한 일반의약품, 약국외 판매의약품 확대도 제시됐다.현재처럼 이의 제기 시에만 작동하는 수동적 구조에서 벗어나 보건의료 환경 변화에 능동적으로 대응하는 상시·주기적 시스템으로 전환될 필요가 있다는 주장이다.아울러 향후 인구구조 변화로 인한 인구소멸지역이나 지방 농촌지역의 경우 약국을 통한 의약품 접근성에 한계가 있을 것으로 예상할 수 있는 바, 이런 경우를 대비해서도 약국외 판매 의약품 확대는 검토돼야 할 부분이라는 설명이다.다만 자가투약 확대가 안전성 저하로 이어지지 않도록 재분류 과정에서 복약지도가 특히 중요한 질환·약제는 약사 상담을 전제로 한 비처방군(약국 전용 비처방의약품)으로 관리하는 등 세분화된 분류와 위험기반 관리가 병행돼야 한다는 것이다.연구진은 정책 부작용을 최소화하기 위한 보완적 정책 시행 필요성도 강조했다.정책적 관점에서 자가투약은 분명한 이점과 잠재적 위험을 동시에 내포하는 만큼 체계적인 보완 장치가 요구된다는 것이다. 특히 항생제나 강력한 진통제와 같은 고위험 의약품에 대해서는 오남용 관리체계와 더불어 명료한 라벨과 이해하기 쉬운 환자용 설명서 제공, 약사의 복약상담 의무화, 대중광고·온라인 마케팅에 대한 엄격한 규제가 필수적으로 수반될 필요가 있다는 견해다.궁극적으로는 이러한 안전장치를 포함한 제도·교육·규제 패키지를 설계함으로써 자가투약이 기존 의료체계를 대체하는 것이 아니라 상호보완적으로 작동하도록 유도해야 한다고 덧붙였다.2025-12-31 12:07:20강혜경 기자 -
 '빔젤릭스' 염증질환 적응증 확대…생물의약품 경쟁 본격화[데일리팜=손형민 기자] '휴미라(아달리무맙)', '코센틱스(세쿠키누맙)' 등 주요 생물학적제제가 주도해 온 염증질환 치료 시장에 변화의 조짐이 나타나고 있다. 생물학적제제는 물론 야누스 키나제(JAK) 억제제, 차세대 표적 치료제들이 잇달아 적응증 확대에 나서면서 경쟁 구도가 한층 심화되고 있다.유씨비제약 '빔젤릭스'30일 관련 업계에 따르면 식품의약품안전처는 지난 24일 '빔젤릭스(비메키주맙)'를 ▲건선성 관절염 ▲축성 척추관절염 ▲화농성 한선염 등 3개 적응증으로 추가 허가했다. 빔젤릭스는 인터루킨-17A와 17F를 동시에 억제하는 최초이자 유일한 이중 억제제로, 지난해 8월 판상 건선 치료제로 국내 허가를 받은 바 있다.이번 건선성 관절염 적응증 승인은 두 건의 3상 임상 결과를 근거로 이뤄졌다. 생물학적제제 치료 경험이 없는 환자를 대상으로 한 BE OPTIMAL 연구와, TNF-α 억제제 치료에 실패하거나 내약성이 부족했던 환자를 대상으로 한 BE COMPLETE 연구다.BE OPTIMAL 연구에서 빔젤릭스 투여군의 44%가 16주차에 1차 평가변수인 ACR50에 도달해 위약군(10%) 대비 유의한 개선을 보였다. BE COMPLETE 연구에서도 빔젤릭스군의 43%가 ACR50, 27%가 ACR70에 도달했다. 두 연구 모두에서 새로운 안전성 신호는 관찰되지 않았다.축성 척추관절염 적응증은 비방사선학적 환자를 대상으로 한 BE MOBILE 1, 방사선학적 환자를 대상으로 한 BE MOBILE 2 두 건의 병렬 3상 임상 결과를 근거로 허가됐다.두 연구에서 빔젤릭스군의 16주차 ASAS40 도달률은 각각 48%, 45%로, 위약군(21%, 23%) 대비 유의미하게 높았다. 특히 첫 투여 후 1~2주 이내부터 반응이 나타났으며, 24주차까지 반응률이 지속적으로 증가했다. 위약에서 빔젤릭스로 전환한 환자군에서도 24주차에 유사한 반응률을 보였다. 안전성 측면에서도 새로운 이상반응은 확인되지 않았다.화농성 한선염 적응증은 중등도~중증 환자를 대상으로 한 BE HEARD 1·2 두 건의 3상 임상을 근거로 승인됐다. 16주차에 HiSCR50을 달성한 비율은 빔젤릭스군에서 각각 48%, 52%로, 위약군(29%, 32%) 대비 유의하게 높았다.보다 엄격한 기준인 HiSCR75 역시 빔젤릭스군에서 33%, 36%로 위약 대비 우월했다. 이러한 반응은 48주까지 유지되거나 추가 개선되는 경향을 보였으며, DLQI 등 삶의 질 지표에서도 임상적으로 의미 있는 개선이 확인됐다. 장기 연장 연구 통합 분석에서도 2년간 유효성과 안전성이 유지된 것으로 나타났다.후발주자도 가세…TYK2 표적 신약 가능성 주목빔젤릭스의 적응증 확대로 생물학적제제, 야누스 키나제 억제제(JAK) 등과의 경쟁이 불가피해졌다. 현재 빔젤릭스와 유사한 적응증을 갖고 있는 건 노바티스의 ‘코센틱스’, 애브비의 ‘휴미라’, ‘린버크(유파다시티닙)’, 존슨앤드존슨의 ‘스텔라라(우스테키누맙)’ 등 주요 생물학적제제, JAK 억제제가 시장을 선점하고 있다. BMS '소틱투'여기에 TYK2 계열 신약들의 약진도 눈여겨볼만 하다. 현재 BMS의 '소틱투(듀크라바시티닙)'는 국내에서 판상 건선 적응증만 확보한 상황이다. BMS는 건선성 관절염 임상을 마치고 미국에서 허가 심사를 기다리고 있다. TYK2 억제제는 JAK 억제제와 달리 TYK2 단백질을 선택적으로 억제해 IL-12, IL-23, Type I 인터페론 경로의 신호전달만 차단하고, 면역 반응 조절과 함께 보다 안전한 치료가 가능하다는 점에서 주목받고 있다.기존 생물학적제제 중 IL-17 억제제의 경우 궤양성대장염이나 크론병과 같은 염증성장질환 악화와 경구 칸디다증에 대한 우려가 제기되기도 했다. IL-23 억제제는 두드러지는 이상반응은 없었지만 주사 부위에 통증이나 불편감과 상기도 감염에 대한 우려가 있다. 새로운 치료 옵션이 부각되는 이유 중 하나다.후발주자와의 추가적인 경쟁도 불가피한 상황이다. 다케다의 자소시티닙은 소틱투에 이어 가장 상용화에 가깝다고 평가받는다. 지난해 의학전문지 ‘JAMA’에 게재된 임상2b상에서 자소시티닙의 상용화 가능성이 확인됐다.이 연구는 259명의 참가자를 무작위로 배정하여 12주 동안 자소시티닙의 네 가지 일일 경구 용량(2mg, 5mg, 15mg 또는 30mg) 중 하나 또는 위약을 투여했다.임상 결과 자소시티닙은 용량 의존적 반응을 보였으며, 각 용량군에서 건선 중증도 지수(PASI) 75(피부 개선율 75% 이상)에 도달한 환자의 비율은 18%, 44%, 68%, 67%로 위약군 6%에 비해 높았다. 또 이 연구에서는 중대한 안전성 문제는 보고되지 않아 자소시티닙은 양호한 안전성 프로파일을 보였다.다케다는 건선 외 다른 적응증으로도 자소시티닙을 적극적으로 개발하고 있으며, 건선성 관절염 적응증 확보도 모색하고 있다. 또 다케다는 중등증에서 중증의 활성 크론병 및 궤양성 대장염에 대한 2상 연구를 진행 중이며, 전신성 홍반 루푸스에 대한 연구도 계획하고 있어 다른 면역 매개 질환에서도 자소시티닙의 잠재력을 모색하고 있다.2025-12-30 06:00:56손형민 기자
'빔젤릭스' 염증질환 적응증 확대…생물의약품 경쟁 본격화[데일리팜=손형민 기자] '휴미라(아달리무맙)', '코센틱스(세쿠키누맙)' 등 주요 생물학적제제가 주도해 온 염증질환 치료 시장에 변화의 조짐이 나타나고 있다. 생물학적제제는 물론 야누스 키나제(JAK) 억제제, 차세대 표적 치료제들이 잇달아 적응증 확대에 나서면서 경쟁 구도가 한층 심화되고 있다.유씨비제약 '빔젤릭스'30일 관련 업계에 따르면 식품의약품안전처는 지난 24일 '빔젤릭스(비메키주맙)'를 ▲건선성 관절염 ▲축성 척추관절염 ▲화농성 한선염 등 3개 적응증으로 추가 허가했다. 빔젤릭스는 인터루킨-17A와 17F를 동시에 억제하는 최초이자 유일한 이중 억제제로, 지난해 8월 판상 건선 치료제로 국내 허가를 받은 바 있다.이번 건선성 관절염 적응증 승인은 두 건의 3상 임상 결과를 근거로 이뤄졌다. 생물학적제제 치료 경험이 없는 환자를 대상으로 한 BE OPTIMAL 연구와, TNF-α 억제제 치료에 실패하거나 내약성이 부족했던 환자를 대상으로 한 BE COMPLETE 연구다.BE OPTIMAL 연구에서 빔젤릭스 투여군의 44%가 16주차에 1차 평가변수인 ACR50에 도달해 위약군(10%) 대비 유의한 개선을 보였다. BE COMPLETE 연구에서도 빔젤릭스군의 43%가 ACR50, 27%가 ACR70에 도달했다. 두 연구 모두에서 새로운 안전성 신호는 관찰되지 않았다.축성 척추관절염 적응증은 비방사선학적 환자를 대상으로 한 BE MOBILE 1, 방사선학적 환자를 대상으로 한 BE MOBILE 2 두 건의 병렬 3상 임상 결과를 근거로 허가됐다.두 연구에서 빔젤릭스군의 16주차 ASAS40 도달률은 각각 48%, 45%로, 위약군(21%, 23%) 대비 유의미하게 높았다. 특히 첫 투여 후 1~2주 이내부터 반응이 나타났으며, 24주차까지 반응률이 지속적으로 증가했다. 위약에서 빔젤릭스로 전환한 환자군에서도 24주차에 유사한 반응률을 보였다. 안전성 측면에서도 새로운 이상반응은 확인되지 않았다.화농성 한선염 적응증은 중등도~중증 환자를 대상으로 한 BE HEARD 1·2 두 건의 3상 임상을 근거로 승인됐다. 16주차에 HiSCR50을 달성한 비율은 빔젤릭스군에서 각각 48%, 52%로, 위약군(29%, 32%) 대비 유의하게 높았다.보다 엄격한 기준인 HiSCR75 역시 빔젤릭스군에서 33%, 36%로 위약 대비 우월했다. 이러한 반응은 48주까지 유지되거나 추가 개선되는 경향을 보였으며, DLQI 등 삶의 질 지표에서도 임상적으로 의미 있는 개선이 확인됐다. 장기 연장 연구 통합 분석에서도 2년간 유효성과 안전성이 유지된 것으로 나타났다.후발주자도 가세…TYK2 표적 신약 가능성 주목빔젤릭스의 적응증 확대로 생물학적제제, 야누스 키나제 억제제(JAK) 등과의 경쟁이 불가피해졌다. 현재 빔젤릭스와 유사한 적응증을 갖고 있는 건 노바티스의 ‘코센틱스’, 애브비의 ‘휴미라’, ‘린버크(유파다시티닙)’, 존슨앤드존슨의 ‘스텔라라(우스테키누맙)’ 등 주요 생물학적제제, JAK 억제제가 시장을 선점하고 있다. BMS '소틱투'여기에 TYK2 계열 신약들의 약진도 눈여겨볼만 하다. 현재 BMS의 '소틱투(듀크라바시티닙)'는 국내에서 판상 건선 적응증만 확보한 상황이다. BMS는 건선성 관절염 임상을 마치고 미국에서 허가 심사를 기다리고 있다. TYK2 억제제는 JAK 억제제와 달리 TYK2 단백질을 선택적으로 억제해 IL-12, IL-23, Type I 인터페론 경로의 신호전달만 차단하고, 면역 반응 조절과 함께 보다 안전한 치료가 가능하다는 점에서 주목받고 있다.기존 생물학적제제 중 IL-17 억제제의 경우 궤양성대장염이나 크론병과 같은 염증성장질환 악화와 경구 칸디다증에 대한 우려가 제기되기도 했다. IL-23 억제제는 두드러지는 이상반응은 없었지만 주사 부위에 통증이나 불편감과 상기도 감염에 대한 우려가 있다. 새로운 치료 옵션이 부각되는 이유 중 하나다.후발주자와의 추가적인 경쟁도 불가피한 상황이다. 다케다의 자소시티닙은 소틱투에 이어 가장 상용화에 가깝다고 평가받는다. 지난해 의학전문지 ‘JAMA’에 게재된 임상2b상에서 자소시티닙의 상용화 가능성이 확인됐다.이 연구는 259명의 참가자를 무작위로 배정하여 12주 동안 자소시티닙의 네 가지 일일 경구 용량(2mg, 5mg, 15mg 또는 30mg) 중 하나 또는 위약을 투여했다.임상 결과 자소시티닙은 용량 의존적 반응을 보였으며, 각 용량군에서 건선 중증도 지수(PASI) 75(피부 개선율 75% 이상)에 도달한 환자의 비율은 18%, 44%, 68%, 67%로 위약군 6%에 비해 높았다. 또 이 연구에서는 중대한 안전성 문제는 보고되지 않아 자소시티닙은 양호한 안전성 프로파일을 보였다.다케다는 건선 외 다른 적응증으로도 자소시티닙을 적극적으로 개발하고 있으며, 건선성 관절염 적응증 확보도 모색하고 있다. 또 다케다는 중등증에서 중증의 활성 크론병 및 궤양성 대장염에 대한 2상 연구를 진행 중이며, 전신성 홍반 루푸스에 대한 연구도 계획하고 있어 다른 면역 매개 질환에서도 자소시티닙의 잠재력을 모색하고 있다.2025-12-30 06:00:56손형민 기자 -
 병원약사회, 올해 추계학술대회 우수 연제 25편 선정[데일리팜=김지은 기자] 한국병원약사회(회장 정경주)는 오늘(29일) 지난 11월 열린 ‘2025년도 병원약사대회 및 추계학술대회’에서 발표된 회원 약사 연제 총 143편 중 우수 연제 25편을 선정, 발표했다.올해 병원약사대회·추계학술대회에서는 병원약사가 현장에서 수행하는 업무 현황을 비롯해 병원약사 역할 확대와 약제업무 개선에 기여할 수 있는 다양한 연구 성과가 공유됐다.병원약사회는 이날 발표된 구연 연제 29편과 포스터 연제 114편은 사전 초록 심사와 현장 심사를 거쳐 구연 5편, 포스터 20편 등 총 25편이 우수 연제로 선정됐다고 밝혔다. 구연 발표 부문 최우수 연제는 서울대학교병원 이현정 약사의 ‘지속적 신대체요법 적용 환자에서 정맥혈전색전증 예방을 위한 Enoxaparin 사용 실태 및 안전성 분석’이 선정됐다. 포스터 발표 부문 최우수 연제는 총 3편으로 ▲삼성서울병원 염제민 약사 ‘내과계 중환자실에서의 ASP 활동 현황 보고’ ▲연세대학교 세브란스병원 김다은 약사 ‘중환자에서 열량 대비 단백질 비율에 기반한 정맥영양 지원의 예후 및 효과 평가’ ▲가톨릭대학교 은평성모병원 이지윤 약사 ‘비중증 감염 환자에서 Vancomycin AUC24/MIC 기준의 적정성 평가(Evaluation of Vancomycin AUC24/MIC Targets in Non-severe Infections)’가 각각 수상했다.박애령 학술이사는 심사평을 통해 “포스터 발표 최우수작 중 ‘중환자에서 열량 대비 단백질 비율에 기반한 정맥영양 지원의 예후 및 효과 평가’는 중환자 대상 정맥 영양 지원의 예후와 효과를 분석한 연구”라며 “중환자실 입실 초기 경장 영양이 어려운 환자에 열량 대비 고단백 조성의 정맥 영양을 조기에 공급할 경우 사망률 개선과 체중 감소에 따른 영양 결핍 예방에 기여할 수 있다는 가능성을 제시한 의미 있는 연구”라고 평가했다. 박 이사는 또 다른 수상작인 ‘비중증 감염 환자에서 Vancomycin AUC24/MIC 기준의 적정성 평가’에 대해서는 “중증 감염 환자에 비해 근거가 부족했던 비중증 감염 환자를 대상으로 vancomycin의 최적 AUC를 탐색한 연구”라며 “새로운 적정 AUC 구간(350~600 mg·h/L)을 제시함으로써 비중증 감염 환자의 치료 모니터링 목표를 재평가할 수 있는 근거를 마련했다는 점에서 의의가 있다”고 말했다.홍소연 학술부위원장은 “구연 발표 최우수작은 국내에서 관련 근거가 부족했던 환자군의 처방 실태를 체계적으로 분석했다”면서 “약사 주도로 임상 현장의 의문을 해소하고 환자 안전을 위한 실질적인 근거를 마련했다는 점에서 큰 의미가 있다”라고 평가했다. 홍 부위원장은 포스터 발표 최우수작인 ‘내과계 중환자실에서의 ASP 활동 현황 보고’와 관련 “임상 현장에서 약사와 다학제 팀의 역할을 구체적인 수치로 제시한 연구로, 자문 수용률 97.6%라는 결과를 통해 ASP 개입의 실효성과 의료진과의 높은 협력 수준을 명확히 보여줬다”며 “임상적 타당성과 자료의 충실성, 현장 적용 가능성을 고루 갖춘 연구”라고 했다.정경주 회장은 “추계학술대회 회원 연제 발표는 병원약사가 한 해 동안 축적한 학술적 역량과 연구 성과를 공유하는 의미 있는 자리”라며 “매년 발표 편수가 꾸준히 증가하고 있고, 올해는 150편에 가까운 연제 가운데 완성도 높은 발표가 많아 심사가 특히 까다로웠다”고 말했다. 정 회장은 “이번 발표를 토대로 내용을 더 보완해 병원약사회지 등 등재학술지에 논문으로 투고하는 계기가 되길 바란다”고 덧붙였다.2025-12-29 16:56:34김지은 기자
병원약사회, 올해 추계학술대회 우수 연제 25편 선정[데일리팜=김지은 기자] 한국병원약사회(회장 정경주)는 오늘(29일) 지난 11월 열린 ‘2025년도 병원약사대회 및 추계학술대회’에서 발표된 회원 약사 연제 총 143편 중 우수 연제 25편을 선정, 발표했다.올해 병원약사대회·추계학술대회에서는 병원약사가 현장에서 수행하는 업무 현황을 비롯해 병원약사 역할 확대와 약제업무 개선에 기여할 수 있는 다양한 연구 성과가 공유됐다.병원약사회는 이날 발표된 구연 연제 29편과 포스터 연제 114편은 사전 초록 심사와 현장 심사를 거쳐 구연 5편, 포스터 20편 등 총 25편이 우수 연제로 선정됐다고 밝혔다. 구연 발표 부문 최우수 연제는 서울대학교병원 이현정 약사의 ‘지속적 신대체요법 적용 환자에서 정맥혈전색전증 예방을 위한 Enoxaparin 사용 실태 및 안전성 분석’이 선정됐다. 포스터 발표 부문 최우수 연제는 총 3편으로 ▲삼성서울병원 염제민 약사 ‘내과계 중환자실에서의 ASP 활동 현황 보고’ ▲연세대학교 세브란스병원 김다은 약사 ‘중환자에서 열량 대비 단백질 비율에 기반한 정맥영양 지원의 예후 및 효과 평가’ ▲가톨릭대학교 은평성모병원 이지윤 약사 ‘비중증 감염 환자에서 Vancomycin AUC24/MIC 기준의 적정성 평가(Evaluation of Vancomycin AUC24/MIC Targets in Non-severe Infections)’가 각각 수상했다.박애령 학술이사는 심사평을 통해 “포스터 발표 최우수작 중 ‘중환자에서 열량 대비 단백질 비율에 기반한 정맥영양 지원의 예후 및 효과 평가’는 중환자 대상 정맥 영양 지원의 예후와 효과를 분석한 연구”라며 “중환자실 입실 초기 경장 영양이 어려운 환자에 열량 대비 고단백 조성의 정맥 영양을 조기에 공급할 경우 사망률 개선과 체중 감소에 따른 영양 결핍 예방에 기여할 수 있다는 가능성을 제시한 의미 있는 연구”라고 평가했다. 박 이사는 또 다른 수상작인 ‘비중증 감염 환자에서 Vancomycin AUC24/MIC 기준의 적정성 평가’에 대해서는 “중증 감염 환자에 비해 근거가 부족했던 비중증 감염 환자를 대상으로 vancomycin의 최적 AUC를 탐색한 연구”라며 “새로운 적정 AUC 구간(350~600 mg·h/L)을 제시함으로써 비중증 감염 환자의 치료 모니터링 목표를 재평가할 수 있는 근거를 마련했다는 점에서 의의가 있다”고 말했다.홍소연 학술부위원장은 “구연 발표 최우수작은 국내에서 관련 근거가 부족했던 환자군의 처방 실태를 체계적으로 분석했다”면서 “약사 주도로 임상 현장의 의문을 해소하고 환자 안전을 위한 실질적인 근거를 마련했다는 점에서 큰 의미가 있다”라고 평가했다. 홍 부위원장은 포스터 발표 최우수작인 ‘내과계 중환자실에서의 ASP 활동 현황 보고’와 관련 “임상 현장에서 약사와 다학제 팀의 역할을 구체적인 수치로 제시한 연구로, 자문 수용률 97.6%라는 결과를 통해 ASP 개입의 실효성과 의료진과의 높은 협력 수준을 명확히 보여줬다”며 “임상적 타당성과 자료의 충실성, 현장 적용 가능성을 고루 갖춘 연구”라고 했다.정경주 회장은 “추계학술대회 회원 연제 발표는 병원약사가 한 해 동안 축적한 학술적 역량과 연구 성과를 공유하는 의미 있는 자리”라며 “매년 발표 편수가 꾸준히 증가하고 있고, 올해는 150편에 가까운 연제 가운데 완성도 높은 발표가 많아 심사가 특히 까다로웠다”고 말했다. 정 회장은 “이번 발표를 토대로 내용을 더 보완해 병원약사회지 등 등재학술지에 논문으로 투고하는 계기가 되길 바란다”고 덧붙였다.2025-12-29 16:56:34김지은 기자 -
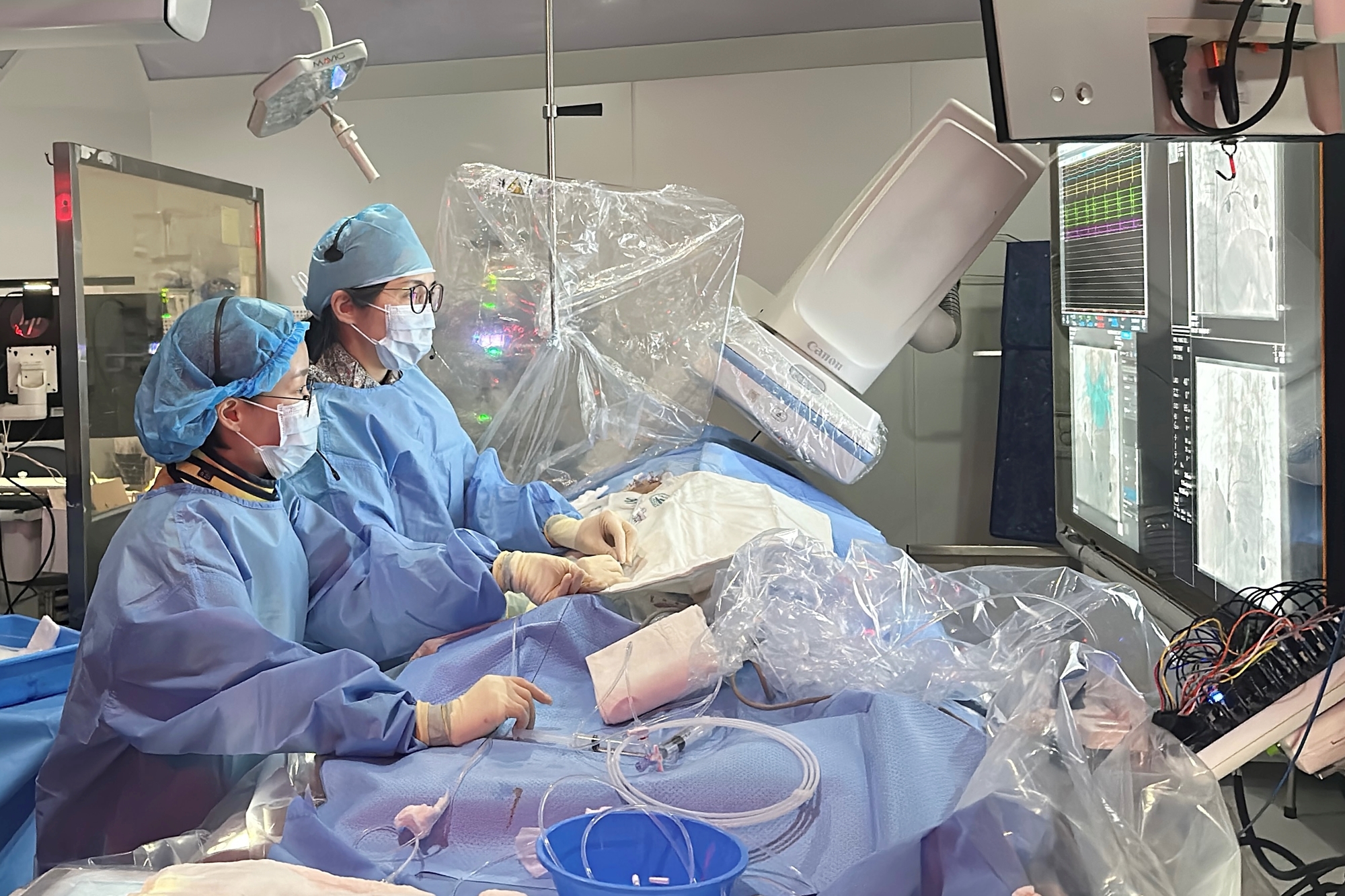 펄스장절제술 국내 도입 가속…글로벌 기업 각축 본격화서울아산병원 PFA 시행 모습[데일리팜=황병우 기자]심방세동(AF) 치료의 패러다임이 기존 '열(Thermal)' 기반에서 비열성 방식인 '펄스장 절제술(PFA, Pulsed Field Ablation)'로 빠르게 재편되고 있다.글로벌 의료기기 기업들이 국내 시장에 차례로 깃발을 꽂으며 점유율 확보를 위한 경쟁에 돌입한 모양새다.29일 한국보건산업진흥원(KHIDI) 보고서에 따르면, 글로벌 PFA 시장 규모는 2024년 약 15억달러(2조1514억원)에서 2029년 약 92억달러(13조1955억원)로 확대될 것으로 전망된다. 연평균 성장률(CAGR)은 약 41.1%가 될 것으로 추정된다.'게임 체인저' 된 PFA... 안전성·시술 효율 강점PFA는 고전압 전기장을 이용해 세포막에 미세한 구멍을 뚫는 '비가역적 전기천공(IRE)' 원리를 이용한다.기존 고주파 절제술(RFA)이나 냉각풍선 절제술(CBA)이 열을 이용해 식도 손상이나 신경 마비 등 합병증 위험이 있었던 것과 달리, 식도 손상, 횡격막 신경 손상, 폐정맥 협착 등 기존 절제술의 주요 합병증을 낮출 수 있다는 평가를 받는다.임상적 데이터도 이를 뒷받침한다. 607명을 대상으로 한 ADVENT 임상시험 결과, PFA의 12개월 치료 성공률은 73.3%로 기존 열 기반 절제술(71.3%) 대비 비열등성을 입증했다.특히 폐정맥 협착 발생률은 PFA군이 0.9%로 기존 방식(12%)보다 현저히 낮았으며, 식도 손상은 단 한 건도 보고되지 않았다.이런 강점을 바탕으로 국내 시장의 침투 속도가 커질 것으로 전망된다. 국내 PFA 시장은 2024년 약 3100만 달러(한화 약 420억 원) 규모에서 연평균 11.1% 성장해 2029년에는 5300만 달러(약 720억 원)에 달할 것으로 예측된다.글로벌 '빅3' 국내 허가 완료... 세브란스 등 상급종합병원 도입 가속현재 국내 PFA 시장은 보스톤사이언티픽, 메드트로닉, 존슨앤드존슨(J&J) 등 글로벌 기업의 3파전 양상이다.가장 먼저 앞서나간 곳은 보스톤사이언티픽이다. '파라펄스(FARAPULSE)' 플랫폼은 지난 2024년 4월 카테터 인증과 9월 제너레이터 허가를 획득하며 국내에 안착했다.지난해 12월 세브란스병원에서 국내 최초 시술을 성공적으로 마친 이후 도입 병원을 빠르게 늘리고 있다.존슨앤드존슨의 '바리펄스(VARIPULSE)'의 경우 2024년 8월 카테터 인증을 받았으며, 자체 3D 매핑 시스템인 '카토3(CARTO 3)'와 완전 통합된 워크플로우를 강점으로 내세우고 있다.뒤이어 메드트로닉의 '펄스셀렉트(PulseSelect)'가 2025년 1월 카테터와 제너레이터 통합 시스템으로 3등급 의료기기 허가를 받으며 참전했다.메드트로닉은 고밀도 매핑과 RF·PF 이중 절제가 가능한 '스피어-9(Sphere-9)' 카테터까지 라인업을 보강하며 공세에 나선 상태다.주요 글로벌 의료기기 기업 PFA 허가 승인 현황"임상 효용성 뚜렷"... 보험 급여 등재가 시장 확산 관건PFA의 도입과 관련해 임상 현장에서는 긍정적인 평가를 내리고 있다.정보영 세브란스병원 심장내과 교수는 "PFA는 기존 방식 대비 시술 시간이 절반 수준으로 단축되고 합병증 위험은 낮아 시술자와 환자 모두의 만족도가 높다"며 "현재 세브란스 심방세동 절제술의 35%가 PFA로 수행되고 있으며, 지속적으로 전환될 것"이라고 내다봤다.벨기에, 독일, 네덜란드에서 수집된 병원 관점의 실제데이터기반(RWD) 비용결과 분석에 따르면 환자 1인당 초기 시술시 직접비용(인력, 시간, 마취, 검사, 입원 등)이 CBS보다 22%, RFA보다 35% 낮은 것으로 나타났다.환자 관점에서도 환자 1인당 비용절감 효과는 크지 않았지만 시간이 경과함에 따라 재시술 감소와 합병증 관리 비용 절감 효과가 누적되는 것으로 분석됐다.다만, 제도적 허들은 남아있다. PFA는 지난해 12월 신의료기술평가를 통과했으나, 아직 건강보험 급여 등재 전 단계로 비급여 항목에 해당한다. 현재는 실손보험 가입 여부가 환자의 선택에 큰 영향을 미치고 있는 상황이다.업계 관계자는 "미국 등 해외에서는 이미 PFA가 전체 절제술의 70% 이상을 차지할 만큼 표준 치료로 자리 잡았다"며 "국내에서도 시술 효율성과 안전성이 입증된 만큼, 급여화 등 제도적 뒷받침이 이뤄진다면 시장 전환 속도는 더욱 빨라질 것"이라고 전망했다.2025-12-29 12:03:35황병우 기자
펄스장절제술 국내 도입 가속…글로벌 기업 각축 본격화서울아산병원 PFA 시행 모습[데일리팜=황병우 기자]심방세동(AF) 치료의 패러다임이 기존 '열(Thermal)' 기반에서 비열성 방식인 '펄스장 절제술(PFA, Pulsed Field Ablation)'로 빠르게 재편되고 있다.글로벌 의료기기 기업들이 국내 시장에 차례로 깃발을 꽂으며 점유율 확보를 위한 경쟁에 돌입한 모양새다.29일 한국보건산업진흥원(KHIDI) 보고서에 따르면, 글로벌 PFA 시장 규모는 2024년 약 15억달러(2조1514억원)에서 2029년 약 92억달러(13조1955억원)로 확대될 것으로 전망된다. 연평균 성장률(CAGR)은 약 41.1%가 될 것으로 추정된다.'게임 체인저' 된 PFA... 안전성·시술 효율 강점PFA는 고전압 전기장을 이용해 세포막에 미세한 구멍을 뚫는 '비가역적 전기천공(IRE)' 원리를 이용한다.기존 고주파 절제술(RFA)이나 냉각풍선 절제술(CBA)이 열을 이용해 식도 손상이나 신경 마비 등 합병증 위험이 있었던 것과 달리, 식도 손상, 횡격막 신경 손상, 폐정맥 협착 등 기존 절제술의 주요 합병증을 낮출 수 있다는 평가를 받는다.임상적 데이터도 이를 뒷받침한다. 607명을 대상으로 한 ADVENT 임상시험 결과, PFA의 12개월 치료 성공률은 73.3%로 기존 열 기반 절제술(71.3%) 대비 비열등성을 입증했다.특히 폐정맥 협착 발생률은 PFA군이 0.9%로 기존 방식(12%)보다 현저히 낮았으며, 식도 손상은 단 한 건도 보고되지 않았다.이런 강점을 바탕으로 국내 시장의 침투 속도가 커질 것으로 전망된다. 국내 PFA 시장은 2024년 약 3100만 달러(한화 약 420억 원) 규모에서 연평균 11.1% 성장해 2029년에는 5300만 달러(약 720억 원)에 달할 것으로 예측된다.글로벌 '빅3' 국내 허가 완료... 세브란스 등 상급종합병원 도입 가속현재 국내 PFA 시장은 보스톤사이언티픽, 메드트로닉, 존슨앤드존슨(J&J) 등 글로벌 기업의 3파전 양상이다.가장 먼저 앞서나간 곳은 보스톤사이언티픽이다. '파라펄스(FARAPULSE)' 플랫폼은 지난 2024년 4월 카테터 인증과 9월 제너레이터 허가를 획득하며 국내에 안착했다.지난해 12월 세브란스병원에서 국내 최초 시술을 성공적으로 마친 이후 도입 병원을 빠르게 늘리고 있다.존슨앤드존슨의 '바리펄스(VARIPULSE)'의 경우 2024년 8월 카테터 인증을 받았으며, 자체 3D 매핑 시스템인 '카토3(CARTO 3)'와 완전 통합된 워크플로우를 강점으로 내세우고 있다.뒤이어 메드트로닉의 '펄스셀렉트(PulseSelect)'가 2025년 1월 카테터와 제너레이터 통합 시스템으로 3등급 의료기기 허가를 받으며 참전했다.메드트로닉은 고밀도 매핑과 RF·PF 이중 절제가 가능한 '스피어-9(Sphere-9)' 카테터까지 라인업을 보강하며 공세에 나선 상태다.주요 글로벌 의료기기 기업 PFA 허가 승인 현황"임상 효용성 뚜렷"... 보험 급여 등재가 시장 확산 관건PFA의 도입과 관련해 임상 현장에서는 긍정적인 평가를 내리고 있다.정보영 세브란스병원 심장내과 교수는 "PFA는 기존 방식 대비 시술 시간이 절반 수준으로 단축되고 합병증 위험은 낮아 시술자와 환자 모두의 만족도가 높다"며 "현재 세브란스 심방세동 절제술의 35%가 PFA로 수행되고 있으며, 지속적으로 전환될 것"이라고 내다봤다.벨기에, 독일, 네덜란드에서 수집된 병원 관점의 실제데이터기반(RWD) 비용결과 분석에 따르면 환자 1인당 초기 시술시 직접비용(인력, 시간, 마취, 검사, 입원 등)이 CBS보다 22%, RFA보다 35% 낮은 것으로 나타났다.환자 관점에서도 환자 1인당 비용절감 효과는 크지 않았지만 시간이 경과함에 따라 재시술 감소와 합병증 관리 비용 절감 효과가 누적되는 것으로 분석됐다.다만, 제도적 허들은 남아있다. PFA는 지난해 12월 신의료기술평가를 통과했으나, 아직 건강보험 급여 등재 전 단계로 비급여 항목에 해당한다. 현재는 실손보험 가입 여부가 환자의 선택에 큰 영향을 미치고 있는 상황이다.업계 관계자는 "미국 등 해외에서는 이미 PFA가 전체 절제술의 70% 이상을 차지할 만큼 표준 치료로 자리 잡았다"며 "국내에서도 시술 효율성과 안전성이 입증된 만큼, 급여화 등 제도적 뒷받침이 이뤄진다면 시장 전환 속도는 더욱 빨라질 것"이라고 전망했다.2025-12-29 12:03:35황병우 기자 -
 PNH 신약 속속 추가…기전·투여 편의성 경쟁구도 확대[데일리팜=손형민 기자] 국내 발작성 야간혈색소뇨증(PNH) 치료 시장에 새로운 C5 보체 억제제가 추가되며 경쟁 구도가 한층 심화됐다. 기존 아스트라제네카의 '솔리리스(에쿨리주맙)·울토미리스(라불리주맙)' 등 C5 보체 억제제 중심에서 C3·B인자·D인자 등 새로운 기전의 치료제들과의 경쟁도 본격화될 전망이다. 업계에서는 향후 PNH 치료제 선택의 핵심 기준이 기전뿐 아니라 투여 간격과 제형 등 투여 편의성으로 이동할 가능성에 주목하고 있다.로슈 PNH 치료제 '피아스카이'27일 관련 업계에 따르면 식품의약품안전처는 지난 24일 로슈의 PNH 치료제 '피아스카이(크로발리맙)'를 허가 승인했다. 피아스카이는 로슈가 개발한 C5 보체 억제제로, 소용량을 4주 간격으로 피하주사(SC)하면 약물이 혈중에서 재순환하며 지속적으로 보체 활성을 억제하는 기전을 갖고 있다.피아스카이는 지난해 6월 미국 식품의약국(FDA) 허가를 획득했으며, 같은 해 8월 유럽에서 상용화됐다. 국내에서는 지난해 2월 희귀의약품으로 지정된 바 있다. 허가 기반은 임상 3상 COMMODORE 2 연구 결과다. COMMODORE 2는 체중 40kg 이상, 13세 이상 PNH 환자를 대상으로 피아스카이와 기존 표준치료제인 아스트라제네카의 솔리리스를 직접 비교한 무작위·개방형·활성 대조 비열등성 임상이다.임상의 1차 평가변수는 수혈 회피율과 용혈 조절 비율이었으며, 2차 평가변수에는 돌파성 용혈, 헤모글로빈 안정성, 피로도 변화, 안전성이 포함됐다.연구에서 5주부터 25주까지의 용혈 조절 달성률은 피아스카이 투여군 79.3%, 솔리리스 투여군 79.0%로 나타나 비열등성을 충족했다. 기저 시점부터 25주까지 적혈구 수혈을 회피한 환자 비율도 각각 65.7%, 68.1%로 유사한 수준을 보였다. 돌파성 용혈 발생률은 피아스카이군 10.4%, 대조군 14.5%로 피아스카이에서 낮은 경향을 보였으며, 안정적인 헤모글로빈 수치를 유지한 환자 비율 역시 양 군 간 큰 차이를 보이지 않았다.안전성 측면에서 피아스카이 투여군의 중대한 이상반응 발생률은 6% 수준으로, 주로 비출혈, 폐렴, 주입 관련 반응 등이 보고됐다. 전반적인 이상반응 양상 역시 기존 C5 억제제와 유사한 수준으로 평가됐다.C3·B인자까지…PNH 시장, '기전+투여 편의성' 경쟁 본격화피아스카이의 국내 허가로 PNH 치료 시장은 기존 C5 억제제 중심 구도를 넘어 기전 다변화 경쟁 국면으로 접어들 전망이다. PNH는 후천적인 유전자 돌연변이에 의해 발생하는 희귀질환이다. 조혈모세포에 다수의 돌연변이가 생길 경우 혈액암으로 발전할 수 있지만, X염색체 유전자인 PIGA 유전자 하나에만 돌연변이가 발생할 경우 PNH가 발생한다.PNH는 현재까지 근본적인 치료법이 없는 질환으로 알려져 있다. 하지만 과학의 발전에 따라 보체 시스템의 활성을 억제하는 방식의 치료제가 개발되면서 치료 접근 방식이 바뀌고 있다. 보체 시스템은 선천 면역(innate immunity)의 핵심 요소로, 병원체를 직접 공격하고 파괴하는 강력한 방어 체계다. 이 시스템은 C3, C5 등 여러 경로로 구성돼 있으며, 최종적으로는 막공격복합체(MAC)를 형성해 적혈구를 파괴하는 역할을 한다.그동안은 보체 시스템의 말단 경로에 위치한 C5를 억제하는 치료제가 주로 사용돼 왔다. 대표적으로 2주 간격으로 투여하는 주사제 솔리리스 이후 8주 간격으로 투여가능한 주사제 울토미리스가 도입되면서 치료 환경이 개선됐다. 현재까지도 많은 환자들이 이 치료제를 기반으로 질환을 관리하고 있다.최근에는 한독의 C3 억제제 '엠파벨리(페그세타코플란)', 노바티스의 B인자 억제제 '파발타(입타코판)', 아스트라제네카의 D인자 억제제 '보이데야(다니코판)' 등이 가세하며 경쟁 축이 넓어지고 있다. 각 약물은 보체 시스템 내 서로 다른 지점을 차단해 C5 억제 이후에도 남아 있던 혈관외 용혈(EVH) 등 미충족 수요를 보완하는 전략을 취하고 있다.왼쪽부터 PNH 치료제 '엠파벨리', '파발타', '보이데야'특히 향후 시장 판도는 약효 차이보다는 투여 편의성이 중요한 변수로 작용할 가능성이 크다는 분석이 나온다. 보이데야는 C5 억제제와 병용 투여가 필요해 복약 구조는 복잡하지만, 오히려 순응도 관리는 더 용이할 수 있다는 장점도 있다파발타의 경우 경구 제형이라는 점에서 주사제 대비 복약 편의성이 강점으로 꼽한다. 특히 이 치료제는 빈혈과 EVH 등에 효과를 보일 수 있다는 강점이 있다.엠파벨리는 주 2회 피하주사라는 부담이 있지만 C3 단계에서의 직접 억제를 통해 임상적 효과를 기대할 수 있는 옵션이다. 주사제에 대한 거부감이 적은 환자에게는 충분히 효과적인 옵션이 될 수 있다는 게 전문가들의 평가다. 이 치료제는 미국 기업 아펠리스가 개발한 PNH 치료제로 스웨덴 소비(Swedish Orphan Biovitrum, Sobi)가 미국 외 판권을 보유하고 있다. 한독은 지난 2023년 엠파벨리의 국내 도입을 위해 소비와 전략적 파트너십 계약을 체결한 바 있다.2025-12-27 06:00:50손형민 기자
PNH 신약 속속 추가…기전·투여 편의성 경쟁구도 확대[데일리팜=손형민 기자] 국내 발작성 야간혈색소뇨증(PNH) 치료 시장에 새로운 C5 보체 억제제가 추가되며 경쟁 구도가 한층 심화됐다. 기존 아스트라제네카의 '솔리리스(에쿨리주맙)·울토미리스(라불리주맙)' 등 C5 보체 억제제 중심에서 C3·B인자·D인자 등 새로운 기전의 치료제들과의 경쟁도 본격화될 전망이다. 업계에서는 향후 PNH 치료제 선택의 핵심 기준이 기전뿐 아니라 투여 간격과 제형 등 투여 편의성으로 이동할 가능성에 주목하고 있다.로슈 PNH 치료제 '피아스카이'27일 관련 업계에 따르면 식품의약품안전처는 지난 24일 로슈의 PNH 치료제 '피아스카이(크로발리맙)'를 허가 승인했다. 피아스카이는 로슈가 개발한 C5 보체 억제제로, 소용량을 4주 간격으로 피하주사(SC)하면 약물이 혈중에서 재순환하며 지속적으로 보체 활성을 억제하는 기전을 갖고 있다.피아스카이는 지난해 6월 미국 식품의약국(FDA) 허가를 획득했으며, 같은 해 8월 유럽에서 상용화됐다. 국내에서는 지난해 2월 희귀의약품으로 지정된 바 있다. 허가 기반은 임상 3상 COMMODORE 2 연구 결과다. COMMODORE 2는 체중 40kg 이상, 13세 이상 PNH 환자를 대상으로 피아스카이와 기존 표준치료제인 아스트라제네카의 솔리리스를 직접 비교한 무작위·개방형·활성 대조 비열등성 임상이다.임상의 1차 평가변수는 수혈 회피율과 용혈 조절 비율이었으며, 2차 평가변수에는 돌파성 용혈, 헤모글로빈 안정성, 피로도 변화, 안전성이 포함됐다.연구에서 5주부터 25주까지의 용혈 조절 달성률은 피아스카이 투여군 79.3%, 솔리리스 투여군 79.0%로 나타나 비열등성을 충족했다. 기저 시점부터 25주까지 적혈구 수혈을 회피한 환자 비율도 각각 65.7%, 68.1%로 유사한 수준을 보였다. 돌파성 용혈 발생률은 피아스카이군 10.4%, 대조군 14.5%로 피아스카이에서 낮은 경향을 보였으며, 안정적인 헤모글로빈 수치를 유지한 환자 비율 역시 양 군 간 큰 차이를 보이지 않았다.안전성 측면에서 피아스카이 투여군의 중대한 이상반응 발생률은 6% 수준으로, 주로 비출혈, 폐렴, 주입 관련 반응 등이 보고됐다. 전반적인 이상반응 양상 역시 기존 C5 억제제와 유사한 수준으로 평가됐다.C3·B인자까지…PNH 시장, '기전+투여 편의성' 경쟁 본격화피아스카이의 국내 허가로 PNH 치료 시장은 기존 C5 억제제 중심 구도를 넘어 기전 다변화 경쟁 국면으로 접어들 전망이다. PNH는 후천적인 유전자 돌연변이에 의해 발생하는 희귀질환이다. 조혈모세포에 다수의 돌연변이가 생길 경우 혈액암으로 발전할 수 있지만, X염색체 유전자인 PIGA 유전자 하나에만 돌연변이가 발생할 경우 PNH가 발생한다.PNH는 현재까지 근본적인 치료법이 없는 질환으로 알려져 있다. 하지만 과학의 발전에 따라 보체 시스템의 활성을 억제하는 방식의 치료제가 개발되면서 치료 접근 방식이 바뀌고 있다. 보체 시스템은 선천 면역(innate immunity)의 핵심 요소로, 병원체를 직접 공격하고 파괴하는 강력한 방어 체계다. 이 시스템은 C3, C5 등 여러 경로로 구성돼 있으며, 최종적으로는 막공격복합체(MAC)를 형성해 적혈구를 파괴하는 역할을 한다.그동안은 보체 시스템의 말단 경로에 위치한 C5를 억제하는 치료제가 주로 사용돼 왔다. 대표적으로 2주 간격으로 투여하는 주사제 솔리리스 이후 8주 간격으로 투여가능한 주사제 울토미리스가 도입되면서 치료 환경이 개선됐다. 현재까지도 많은 환자들이 이 치료제를 기반으로 질환을 관리하고 있다.최근에는 한독의 C3 억제제 '엠파벨리(페그세타코플란)', 노바티스의 B인자 억제제 '파발타(입타코판)', 아스트라제네카의 D인자 억제제 '보이데야(다니코판)' 등이 가세하며 경쟁 축이 넓어지고 있다. 각 약물은 보체 시스템 내 서로 다른 지점을 차단해 C5 억제 이후에도 남아 있던 혈관외 용혈(EVH) 등 미충족 수요를 보완하는 전략을 취하고 있다.왼쪽부터 PNH 치료제 '엠파벨리', '파발타', '보이데야'특히 향후 시장 판도는 약효 차이보다는 투여 편의성이 중요한 변수로 작용할 가능성이 크다는 분석이 나온다. 보이데야는 C5 억제제와 병용 투여가 필요해 복약 구조는 복잡하지만, 오히려 순응도 관리는 더 용이할 수 있다는 장점도 있다파발타의 경우 경구 제형이라는 점에서 주사제 대비 복약 편의성이 강점으로 꼽한다. 특히 이 치료제는 빈혈과 EVH 등에 효과를 보일 수 있다는 강점이 있다.엠파벨리는 주 2회 피하주사라는 부담이 있지만 C3 단계에서의 직접 억제를 통해 임상적 효과를 기대할 수 있는 옵션이다. 주사제에 대한 거부감이 적은 환자에게는 충분히 효과적인 옵션이 될 수 있다는 게 전문가들의 평가다. 이 치료제는 미국 기업 아펠리스가 개발한 PNH 치료제로 스웨덴 소비(Swedish Orphan Biovitrum, Sobi)가 미국 외 판권을 보유하고 있다. 한독은 지난 2023년 엠파벨리의 국내 도입을 위해 소비와 전략적 파트너십 계약을 체결한 바 있다.2025-12-27 06:00:50손형민 기자 -
 새로운 심근병증 치료제 가세…캄지오스와 경쟁 본격화[데일리팜=손형민 기자] 미국에서 폐쇄성 비대성 심근병증(oHCM) 치료제 시장에 새로운 선택지가 추가됐다. 브리스톨마이어스스퀴브(BMS)의 '캄지오스(마바캄텐)'가 사실상 독점해 온 심장 마이오신 억제제 영역에 경쟁 약물이 등장하면서 치료 패러다임과 시장 구도 변화 가능성에 관심이 쏠린다.22일 미국 바이오기업 싸이토키네틱스는 성인 증상성 폐색성 비대성 심근병증(obstructive hypertrophic cardiomyopathy, oHCM) 환자의 운동 능력과 증상 개선을 위한 치료제로 '마이쿼조(MYQORZO, 아피캄텐)'가 미국 식품의약국(FDA)의 허가를 획득했다고 밝혔다. 이 회사가 설립 이후 처음으로 받아든 FDA 승인이다.마이쿼조는 심장 마이오신의 운동 활성을 가역적으로 억제하는 알로스테릭(allosteric) 기전의 약물이다. 과도한 심근 수축과 좌심실 유출로(LVOT) 폐색을 완화하는 방식으로, 이미 시장에 진입한 캄지오스와 동일한 계열에 속한다.아이러니하게도 이 경쟁 구도에는 과거 인연이 있다. 사이토키네틱스는 2012년 마이오카디아(MyoKardia)와의 협력을 통해 캄지오스 개발에 관여했고, 이후 마이오카디아는 BMS에 131억 달러에 인수됐다. 그 결과 캄지오스는 2022년 FDA 승인을 받아 oHCM 치료의 첫 마이오신 억제제로 자리 잡았다.이번 허가는 3상 임상시험 SEQUOIA-HCM 결과를 근거로 이뤄졌다. 24주 치료 후 마이조 투여군은 최대 산소섭취량(pVO₂)이 기저치 대비 1.8 mL/kg/min 증가해 위약군 0.0 mL/kg/min 대비 유의한 개선을 보였다. 연령, 성별, 베타차단제 병용 여부 등 주요 하위군 전반에서 일관된 효과가 확인됐다.안전성 측면에서는 치료 중 중증 심부전 악화나 저좌심실박출률(LVEF)로 인한 치료 중단 사례가 보고되지 않았다. 다만 심근 수축을 억제하는 기전 특성상 심부전 위험에 대한 경고는 유지됐다.마이쿼조는 캄지오스와 마찬가지로 심부전 위험에 대한 박스 경고(Boxed Warning)를 포함하고 있으며, REMS(위험평가·완화전략) 프로그램을 통해서만 처방이 가능하다. 치료 전과 치료 중 심초음파를 통해 LVEF를 모니터링해야 한다는 점도 동일하다."독점 깨질까"…표적치료 시장서 경쟁 본격화BMS '캄지오스'현재 oHCM 치료제 표적치료제 시장은 캄지오스가 사실상 독점하고 있다. 캄지오스는 2022년 FDA 승인을 받은 세계 최초의 심장 미오신 억제제로, 약물 치료가 제한적이었던 oHCM 치료 패러다임을 바꾼 약물로 평가된다. 그동안 HCM 치료에서 선택할 수 있는 약물 옵션은 베타차단제, 칼슘채널차단제 등 만성질환 치료제가 전부였다. 해당 약물로 HCM의 증상을 간접적으로 관리할 수 있었으나 증상이 개선되지 않으면 수술 외 치료옵션이 전무했다. 캄지오스의 등장으로 HCM 표적치료의 길이 새롭게 열렸다. 상업적 성과도 뚜렷하다. BMS에 따르면 캄지오스는 2024년 연 매출 6억 달러를 돌파했으며, 올해도 성장세를 이어가고 있다. 현재까지 oHCM 적응증에서 허가받은 유일한 미오신 억제제라는 점이 시장 독점의 배경이다.그럼에도 불구하고 시장에서는 두 약물 간 미묘한 차별성에 주목하고 있다. 마이쿼조는 ▲단순하고 유연한 용량 조절 ▲약물 간 상호작용 모니터링 불필요 ▲예측 가능한 약동학적 특성을 강점으로 내세운다. 일부 투자 분석가들은 이를 근거로 초기 치료 환자에서 더 사용하기 쉬운 약물이라는 평가를 내놓고 있다.시장에서는 마이쿼조가 캄지오스의 독점 구도를 단기간에 흔들기는 쉽지 않지만, 신규 진단·초기 치료 환자군을 중심으로 점진적인 경쟁이 시작될 것으로 보고 있다. 특히 장기 복용이 필요한 만성 질환 특성상, 투여 편의성과 모니터링 부담은 실제 처방 선택에 중요한 변수로 작용할 수 있다.마이쿼조는 2026년 1월 미국 시장에 출시될 예정이다. 가격은 아직 공개되지 않았으나 연간 약가가 약 10만 달러 수준인 캄지오스와의 가격 전략도 향후 시장 침투 속도를 좌우할 핵심 요소로 꼽힌다.oHCM 치료제 시장이 캄지오스 단일 체제에서 마이오신 억제제 간 경쟁 구도로 전환될 수 있을지, 마이쿼조의 실제 임상 현장 안착 여부가 주목된다.2025-12-24 06:00:47손형민 기자
새로운 심근병증 치료제 가세…캄지오스와 경쟁 본격화[데일리팜=손형민 기자] 미국에서 폐쇄성 비대성 심근병증(oHCM) 치료제 시장에 새로운 선택지가 추가됐다. 브리스톨마이어스스퀴브(BMS)의 '캄지오스(마바캄텐)'가 사실상 독점해 온 심장 마이오신 억제제 영역에 경쟁 약물이 등장하면서 치료 패러다임과 시장 구도 변화 가능성에 관심이 쏠린다.22일 미국 바이오기업 싸이토키네틱스는 성인 증상성 폐색성 비대성 심근병증(obstructive hypertrophic cardiomyopathy, oHCM) 환자의 운동 능력과 증상 개선을 위한 치료제로 '마이쿼조(MYQORZO, 아피캄텐)'가 미국 식품의약국(FDA)의 허가를 획득했다고 밝혔다. 이 회사가 설립 이후 처음으로 받아든 FDA 승인이다.마이쿼조는 심장 마이오신의 운동 활성을 가역적으로 억제하는 알로스테릭(allosteric) 기전의 약물이다. 과도한 심근 수축과 좌심실 유출로(LVOT) 폐색을 완화하는 방식으로, 이미 시장에 진입한 캄지오스와 동일한 계열에 속한다.아이러니하게도 이 경쟁 구도에는 과거 인연이 있다. 사이토키네틱스는 2012년 마이오카디아(MyoKardia)와의 협력을 통해 캄지오스 개발에 관여했고, 이후 마이오카디아는 BMS에 131억 달러에 인수됐다. 그 결과 캄지오스는 2022년 FDA 승인을 받아 oHCM 치료의 첫 마이오신 억제제로 자리 잡았다.이번 허가는 3상 임상시험 SEQUOIA-HCM 결과를 근거로 이뤄졌다. 24주 치료 후 마이조 투여군은 최대 산소섭취량(pVO₂)이 기저치 대비 1.8 mL/kg/min 증가해 위약군 0.0 mL/kg/min 대비 유의한 개선을 보였다. 연령, 성별, 베타차단제 병용 여부 등 주요 하위군 전반에서 일관된 효과가 확인됐다.안전성 측면에서는 치료 중 중증 심부전 악화나 저좌심실박출률(LVEF)로 인한 치료 중단 사례가 보고되지 않았다. 다만 심근 수축을 억제하는 기전 특성상 심부전 위험에 대한 경고는 유지됐다.마이쿼조는 캄지오스와 마찬가지로 심부전 위험에 대한 박스 경고(Boxed Warning)를 포함하고 있으며, REMS(위험평가·완화전략) 프로그램을 통해서만 처방이 가능하다. 치료 전과 치료 중 심초음파를 통해 LVEF를 모니터링해야 한다는 점도 동일하다."독점 깨질까"…표적치료 시장서 경쟁 본격화BMS '캄지오스'현재 oHCM 치료제 표적치료제 시장은 캄지오스가 사실상 독점하고 있다. 캄지오스는 2022년 FDA 승인을 받은 세계 최초의 심장 미오신 억제제로, 약물 치료가 제한적이었던 oHCM 치료 패러다임을 바꾼 약물로 평가된다. 그동안 HCM 치료에서 선택할 수 있는 약물 옵션은 베타차단제, 칼슘채널차단제 등 만성질환 치료제가 전부였다. 해당 약물로 HCM의 증상을 간접적으로 관리할 수 있었으나 증상이 개선되지 않으면 수술 외 치료옵션이 전무했다. 캄지오스의 등장으로 HCM 표적치료의 길이 새롭게 열렸다. 상업적 성과도 뚜렷하다. BMS에 따르면 캄지오스는 2024년 연 매출 6억 달러를 돌파했으며, 올해도 성장세를 이어가고 있다. 현재까지 oHCM 적응증에서 허가받은 유일한 미오신 억제제라는 점이 시장 독점의 배경이다.그럼에도 불구하고 시장에서는 두 약물 간 미묘한 차별성에 주목하고 있다. 마이쿼조는 ▲단순하고 유연한 용량 조절 ▲약물 간 상호작용 모니터링 불필요 ▲예측 가능한 약동학적 특성을 강점으로 내세운다. 일부 투자 분석가들은 이를 근거로 초기 치료 환자에서 더 사용하기 쉬운 약물이라는 평가를 내놓고 있다.시장에서는 마이쿼조가 캄지오스의 독점 구도를 단기간에 흔들기는 쉽지 않지만, 신규 진단·초기 치료 환자군을 중심으로 점진적인 경쟁이 시작될 것으로 보고 있다. 특히 장기 복용이 필요한 만성 질환 특성상, 투여 편의성과 모니터링 부담은 실제 처방 선택에 중요한 변수로 작용할 수 있다.마이쿼조는 2026년 1월 미국 시장에 출시될 예정이다. 가격은 아직 공개되지 않았으나 연간 약가가 약 10만 달러 수준인 캄지오스와의 가격 전략도 향후 시장 침투 속도를 좌우할 핵심 요소로 꼽힌다.oHCM 치료제 시장이 캄지오스 단일 체제에서 마이오신 억제제 간 경쟁 구도로 전환될 수 있을지, 마이쿼조의 실제 임상 현장 안착 여부가 주목된다.2025-12-24 06:00:47손형민 기자 -
 위고비 경구제 FDA 허가…GLP-1 투약방식 전환 신호탄[데일리팜=손형민 기자] 노보노디스크의 비만 치료제 위고비가 알약 제형으로 규제당국의 허가를 받으며, 경구용 글루카곤 유사 펩타이드(GLP-1) 계열 비만 치료 시대가 열렸다. 주사제 중심이던 치료 옵션에 경구제가 추가되면서 환자 접근성과 시장 경쟁 구도가 동시에 변할 것으로 전망된다.23일 관련 업계에 따르면 미국 식품의약국(FDA)은 22일 노보노디스크의 비만 치료제 '위고비(세마글루타이드)' 경구제를 승인했다. 규제당국이 GLP-1 계열 비만 경구제를 승인한 건 이번이 처음이다. 이번 승인으로 GLP-1 계열 비만 치료제는 투여 방식 선택지가 넓어졌다. 현재 위고비와 '삭센다(리라글루타이드)', 일라이 릴리의 '젭바운드·마운자로(터제파타이드)'등 주요 약물은 모두 주사제다.노보노디스크에 따르면 위고비 경구제는 임상시험에서 기존 주사제와 유사한 체중 감량 효과와 안전성 프로파일을 보였다. 허가 기반은 임상3상 OASIS 4 연구 결과다. 당뇨병이 없는 비만 환자 307명을 대상으로 위고비 경구제를 64주간 투여한 결과, 평균 체중 감소율은 16.6%에 달했다. 피험자의 34%는 20% 이상 감량에 성공했으며, 혈압·지질 등 심혈관 위험인자 개선 효과도 확인됐다.안전성 프로파일은 위고비 주사제와 유사했으며, 위장관 부작용은 대체로 경·중등도 수준이었다. 다만 복용 방식은 다소 제한적이다. 위고비 경구제는 공복에 소량의 물과 함께 복용해야 하며, 복용 후 30분간 음식·음료·다른 약물 섭취를 피해야 한다. 이는 동일 성분의 당뇨병 경구제 '리벨서스'가 주사제만큼 확산되지 못한 이유로도 지적돼 왔다.가격은 접근성 확대의 핵심 변수다. 위고비 경구제의 시작 용량은 자가 부담 기준 월 149달러(약 22만원)로 책정됐다. 다만 용량이 단계적으로 증량되는 구조상, 유지 용량(최대 25mg)에서는 비용이 더 높아질 가능성이 크다. 보험 적용 여부에 따라 환자 본인부담금은 달라질 전망이다. 노보노디스크는 내년 초 위고비 경구제를 출시하겠다는 계획이다. 경쟁 구도도 빠르게 형성되고 있다. 일라이 릴리는 경구용 GLP-1 후보물질 '오포글리프론'의 FDA 승인을 내년 초로 예상하고 있다. 오포글리프론은 음식·물 섭취 제한 없이 하루 한 번 복용이 가능해 편의성 측면에서 차별화를 내세운다. 임상시험에서는 72주 최고 용량에서 평균 11% 체중 감소율을 보였다. 또 오포글리프론은 위고비 경구제와의 직접 비교 임상 ACHIEVE-3 연구에서도 당화혈색소와 체중 감량 모두에서 더 높은 효과를 보인 바 있다. 전문가들은 향후 경구제가 체중 감량 유지 요법에서 활용될 가능성에도 주목하고 있다. 주사제로 체중을 감량한 뒤, 알약으로 유지 치료를 이어가는 전략이다. 릴리는 최근 임상에서 주사제 이후 오포글리프론으로 전환한 환자군이 위약 대비 체중 재증가가 적었다는 결과를 제시했다.업계에서는 경구제 등장으로 비만 치료가 주사 부담이라는 심리적 장벽을 일부 낮출 수는 있지만 최종 승부처는 여전히 효과 대비 비용, 장기 복용 편의성, 보험 적용 범위가 될 것으로 보고 있다.2025-12-23 12:00:13손형민 기자
위고비 경구제 FDA 허가…GLP-1 투약방식 전환 신호탄[데일리팜=손형민 기자] 노보노디스크의 비만 치료제 위고비가 알약 제형으로 규제당국의 허가를 받으며, 경구용 글루카곤 유사 펩타이드(GLP-1) 계열 비만 치료 시대가 열렸다. 주사제 중심이던 치료 옵션에 경구제가 추가되면서 환자 접근성과 시장 경쟁 구도가 동시에 변할 것으로 전망된다.23일 관련 업계에 따르면 미국 식품의약국(FDA)은 22일 노보노디스크의 비만 치료제 '위고비(세마글루타이드)' 경구제를 승인했다. 규제당국이 GLP-1 계열 비만 경구제를 승인한 건 이번이 처음이다. 이번 승인으로 GLP-1 계열 비만 치료제는 투여 방식 선택지가 넓어졌다. 현재 위고비와 '삭센다(리라글루타이드)', 일라이 릴리의 '젭바운드·마운자로(터제파타이드)'등 주요 약물은 모두 주사제다.노보노디스크에 따르면 위고비 경구제는 임상시험에서 기존 주사제와 유사한 체중 감량 효과와 안전성 프로파일을 보였다. 허가 기반은 임상3상 OASIS 4 연구 결과다. 당뇨병이 없는 비만 환자 307명을 대상으로 위고비 경구제를 64주간 투여한 결과, 평균 체중 감소율은 16.6%에 달했다. 피험자의 34%는 20% 이상 감량에 성공했으며, 혈압·지질 등 심혈관 위험인자 개선 효과도 확인됐다.안전성 프로파일은 위고비 주사제와 유사했으며, 위장관 부작용은 대체로 경·중등도 수준이었다. 다만 복용 방식은 다소 제한적이다. 위고비 경구제는 공복에 소량의 물과 함께 복용해야 하며, 복용 후 30분간 음식·음료·다른 약물 섭취를 피해야 한다. 이는 동일 성분의 당뇨병 경구제 '리벨서스'가 주사제만큼 확산되지 못한 이유로도 지적돼 왔다.가격은 접근성 확대의 핵심 변수다. 위고비 경구제의 시작 용량은 자가 부담 기준 월 149달러(약 22만원)로 책정됐다. 다만 용량이 단계적으로 증량되는 구조상, 유지 용량(최대 25mg)에서는 비용이 더 높아질 가능성이 크다. 보험 적용 여부에 따라 환자 본인부담금은 달라질 전망이다. 노보노디스크는 내년 초 위고비 경구제를 출시하겠다는 계획이다. 경쟁 구도도 빠르게 형성되고 있다. 일라이 릴리는 경구용 GLP-1 후보물질 '오포글리프론'의 FDA 승인을 내년 초로 예상하고 있다. 오포글리프론은 음식·물 섭취 제한 없이 하루 한 번 복용이 가능해 편의성 측면에서 차별화를 내세운다. 임상시험에서는 72주 최고 용량에서 평균 11% 체중 감소율을 보였다. 또 오포글리프론은 위고비 경구제와의 직접 비교 임상 ACHIEVE-3 연구에서도 당화혈색소와 체중 감량 모두에서 더 높은 효과를 보인 바 있다. 전문가들은 향후 경구제가 체중 감량 유지 요법에서 활용될 가능성에도 주목하고 있다. 주사제로 체중을 감량한 뒤, 알약으로 유지 치료를 이어가는 전략이다. 릴리는 최근 임상에서 주사제 이후 오포글리프론으로 전환한 환자군이 위약 대비 체중 재증가가 적었다는 결과를 제시했다.업계에서는 경구제 등장으로 비만 치료가 주사 부담이라는 심리적 장벽을 일부 낮출 수는 있지만 최종 승부처는 여전히 효과 대비 비용, 장기 복용 편의성, 보험 적용 범위가 될 것으로 보고 있다.2025-12-23 12:00:13손형민 기자 -
 종근당, 200억 '듀비에 시리즈' 강화...브랜드 확장 가속[데일리팜=천승현 기자] 종근당이 자체 개발 신약 ‘듀비에’를 활용한 브랜드 확장 전략에 적극적으로 가동하고 있다. TZD 계열 당뇨약 듀비에에 SGL-2 계열을 결합한 새로운 조합을 허가받았다. 듀비에 허가 이후 듀비메트, 듀비메트에스, 듀비에에스 등에 이어 듀비에 시리즈 5번째 라인업이 출격한다. 서로 다른 조합의 당뇨 복합제를 속속 내놓으면서 의료진과 환자들의 수요를 충족시키고 시장 영향력을 확장하겠다는 전략이다. 듀비에 시리즈는 성장세가 주춤하지만 연간 200억원 이상의 안정적인 매출을 발생하고 있다.23일 금융감독원에 따르면 종근당은 지난 19일 식품의약품안전처로부터 ‘듀피엠파정’의 품목허가를 승인받았다. 듀피엠파는 로베글리타존과 엠파글리플로진을 결합한 복합신약이다. 로베글리타존과 엠파글리플로진의 병용투여가 적합한 성인 제2형 당뇨병 환자를 대상으로 사용할 수 있다.종근당은 “엠파글리플로진과 메트포르민의 병용요법으로 혈당이 적절하게 조절되지 않은 제2형 당뇨병 환자에게 로베글리타존·엠파글리플로진 고정용량 복합제로 새로운 치료요법을 제공하며 복약 편의성을 증대할 것으로 기대한다”라고 설명했다.듀피엠파는 종근당이 자체개발한 당뇨신약 듀비에를 기반으로 개발한 5번째 라인업이다. 지난 2013년 국산신약 20호로 허가 받은 듀비에는 치아졸리딘디온(TZD) 계열의 당뇨치료제다. 엠파글리플로진은 엠파글리플로진은 SGLT-2 억제 계열 당뇨치료제로 베링거인겔하임의 자디앙이 오리지널 의약품이다. SGLT-2 억제제는 신장에서 포도당과 나트륨의 재흡수를 억제해 소변으로 배출시키는 기전으로 작용한다.종근당은 듀비에를 시작으로 듀비메트서방정, 듀비메트에스, 듀비에에스 등 총 4개의 듀비에 시리즈 라인업을 가동 중이다. 지난 2016년 허가받은 듀비메트서방정은 듀비에와 메트포르민을 결합한 복합제다. 2023년 5월 허가받은 듀비메트에스는 듀비메트에 DPP-4 억제제 시타글립틴을 결합한 복합제다. 시타글립틴의 오리지널 의약품은 자누비아다. 종근당은 2023년 6월 로베글리타존과 시타글립틴을 결합한 2제 복합제 듀에에스를 추가로 허가받았다.TZD 계열 단일제를 시작으로 TZD+비구아나이드, TZD+DPP-4+비구아나이드, TZD+DPP-4, TZD+SGLT-2 등 서로 다른 조합의 복합제를 선보이며 처방 시장에서 선택의 폭을 넓혔다. 종근당은 듀비엠파에 메트포르민을 추가한 3제 복합제 ‘듀피엠폴’의 허가도 신청한 바 있다. 듀피엠폴이 허가받으면 총 6종의 듀비에 시리즈를 가동하는 셈이다.듀비에를 중심으로 다양한 복합제를 선보여 의료진과 환자들에게 새로운 치료 대안을 제시하면서 처방 시장에서 시너지를 극대화하겠다는 전략이다.듀비에 시리즈는 최근 성장세가 주춤하지만 처방 시장에서 꾸준한 영향력을 나타내고 있다.의약품 조사기관 유비스트에 따르면 지난해 듀비에 시리즈는 총 210억원의 처방실적을 기록했다. 듀비에와 듀비메트가 각각 192억원과 18억원을 기록했다. 듀비메트에스와 듀비에에스는 지난해부터 처방이 발생하고 있지만 아직 존재감을 나타내지 못하는 모습이다.듀비에 시리즈의 최근 성장세는 주춤한 상태다. 듀비에 시리즈는 지난 2022년 254억원의 처방액을 합작했지만 2023년 228억원으로 10.3% 줄었고 지난해에도 하락세가 이어졌다. 작년 처방액은 2년 전보다 16.9% 감소했다. 올해 3분기 듀비에 시리즈는 총 152억원으로 전년동기보다 2.7% 줄었다. 듀비에 단일제가 200억원에 육박하는 매출로 홀로 선전하고 있다. 지난해 듀비에의 처방액은 192억원으로 듀비에 시리즈의 91.2%를 차지했다. 듀비에는 올해 3분기 누적 처방액 138억원으로 듀비에 시리즈의 90.3%를 점유했다. 종근당 입장에서는 새로운 조합의 복합제를 속속 내놓으면서 처방 시장에서 듀비에의 영향력 확대를 기대할 수 있다. 종근당은 지난 2023년 자누비아의 권리를 사들이며 DPP-4 억제제 시장에서도 탄탄한 라인업을 구축했다. 종근당은 지난 2023년 스위스 MSD 본사와 당뇨치료제 자누비아, 자누메트, 자누메트XR 등 3개 제품의 국내 모든 권리를 도입하는 라이선스 계약을 체결했다. 종근당이 자누비아시리즈 3종의 국내 판매와 유통권리 뿐만 아니라 허가, 상표, 제조 등 모든 권리를 인수하는 내용이다. 계약 기간은 2038년 8월 31일까지다.계약 금액은 총 455억원이다. 종근당은 MSD 본사에 계약금 230억원을 지급하고 매출에 따른 마일스톤 규모는 1700만달러(약 225억원) 규모다. 자누비아는 시타글립틴 성분의 DPP-4 억제계열 당뇨치료제다. 자누메트는 자누비아와 메트포민을 결합한 복합제다. 자누메트 XR은 자누메트의 서방형 제품이다. 자누비아, 자누메트, 자누메트엑스알은 지난해 998억원의 처방액을 합작했다.종근당의 듀비에는 당뇨에 이어 새로운 영역에도 도전한다.종근당의 글로벌 라이선스 파트너사인 아클립스 테라퓨틱스는 지난달 미국 메이요 클리닉과 위마비증 치료 후보물질 ‘M107(로베글리타존)’의 임상 2상을 위한 협약을 체결했다. 듀비에의 주 성분 로베글리타존을 활용해 위마비 치료 가능성을 타진한다.메이요 클리닉은 아클립스의 연구 지원금을 받아 M107의 연구자 주도 임상시험을 진행한다. ‘LOGAST(Lobeglitazone for the treatment of idiopathic gastroparesis)’라는 명칭의 임상 2상은 2026년 1분기에 피험자 모집을 시작하고, 미네소타 로체스터, 애리조나 피닉스, 플로리다 잭슨빌 등 메이요 클리닉의 세 개의 캠퍼스에서 수행될 예정이다.종근당은 2023년 로베글리타존의 신규 적응증 개발을 위해 아클립스와 글로벌 라이선스 협약을 맺었다. 아클립스는 로베글리타존이 경구 투여가 가능한 소분자 약물로, 항염증 효과와 임상적으로 우수한 안전성 프로파일을 보유하고 있음을 확인했다. 염증을 억제하는 M2 대식세포의 발현을 증가시키고 염증을 유발하는 M1 대식세포를 감소시키는 기전을 통해 대식 세포의 불균형을 조절해 위마비증 치료제 개발 가능성을 기대하고 있다.2025-12-23 11:59:58천승현 기자
종근당, 200억 '듀비에 시리즈' 강화...브랜드 확장 가속[데일리팜=천승현 기자] 종근당이 자체 개발 신약 ‘듀비에’를 활용한 브랜드 확장 전략에 적극적으로 가동하고 있다. TZD 계열 당뇨약 듀비에에 SGL-2 계열을 결합한 새로운 조합을 허가받았다. 듀비에 허가 이후 듀비메트, 듀비메트에스, 듀비에에스 등에 이어 듀비에 시리즈 5번째 라인업이 출격한다. 서로 다른 조합의 당뇨 복합제를 속속 내놓으면서 의료진과 환자들의 수요를 충족시키고 시장 영향력을 확장하겠다는 전략이다. 듀비에 시리즈는 성장세가 주춤하지만 연간 200억원 이상의 안정적인 매출을 발생하고 있다.23일 금융감독원에 따르면 종근당은 지난 19일 식품의약품안전처로부터 ‘듀피엠파정’의 품목허가를 승인받았다. 듀피엠파는 로베글리타존과 엠파글리플로진을 결합한 복합신약이다. 로베글리타존과 엠파글리플로진의 병용투여가 적합한 성인 제2형 당뇨병 환자를 대상으로 사용할 수 있다.종근당은 “엠파글리플로진과 메트포르민의 병용요법으로 혈당이 적절하게 조절되지 않은 제2형 당뇨병 환자에게 로베글리타존·엠파글리플로진 고정용량 복합제로 새로운 치료요법을 제공하며 복약 편의성을 증대할 것으로 기대한다”라고 설명했다.듀피엠파는 종근당이 자체개발한 당뇨신약 듀비에를 기반으로 개발한 5번째 라인업이다. 지난 2013년 국산신약 20호로 허가 받은 듀비에는 치아졸리딘디온(TZD) 계열의 당뇨치료제다. 엠파글리플로진은 엠파글리플로진은 SGLT-2 억제 계열 당뇨치료제로 베링거인겔하임의 자디앙이 오리지널 의약품이다. SGLT-2 억제제는 신장에서 포도당과 나트륨의 재흡수를 억제해 소변으로 배출시키는 기전으로 작용한다.종근당은 듀비에를 시작으로 듀비메트서방정, 듀비메트에스, 듀비에에스 등 총 4개의 듀비에 시리즈 라인업을 가동 중이다. 지난 2016년 허가받은 듀비메트서방정은 듀비에와 메트포르민을 결합한 복합제다. 2023년 5월 허가받은 듀비메트에스는 듀비메트에 DPP-4 억제제 시타글립틴을 결합한 복합제다. 시타글립틴의 오리지널 의약품은 자누비아다. 종근당은 2023년 6월 로베글리타존과 시타글립틴을 결합한 2제 복합제 듀에에스를 추가로 허가받았다.TZD 계열 단일제를 시작으로 TZD+비구아나이드, TZD+DPP-4+비구아나이드, TZD+DPP-4, TZD+SGLT-2 등 서로 다른 조합의 복합제를 선보이며 처방 시장에서 선택의 폭을 넓혔다. 종근당은 듀비엠파에 메트포르민을 추가한 3제 복합제 ‘듀피엠폴’의 허가도 신청한 바 있다. 듀피엠폴이 허가받으면 총 6종의 듀비에 시리즈를 가동하는 셈이다.듀비에를 중심으로 다양한 복합제를 선보여 의료진과 환자들에게 새로운 치료 대안을 제시하면서 처방 시장에서 시너지를 극대화하겠다는 전략이다.듀비에 시리즈는 최근 성장세가 주춤하지만 처방 시장에서 꾸준한 영향력을 나타내고 있다.의약품 조사기관 유비스트에 따르면 지난해 듀비에 시리즈는 총 210억원의 처방실적을 기록했다. 듀비에와 듀비메트가 각각 192억원과 18억원을 기록했다. 듀비메트에스와 듀비에에스는 지난해부터 처방이 발생하고 있지만 아직 존재감을 나타내지 못하는 모습이다.듀비에 시리즈의 최근 성장세는 주춤한 상태다. 듀비에 시리즈는 지난 2022년 254억원의 처방액을 합작했지만 2023년 228억원으로 10.3% 줄었고 지난해에도 하락세가 이어졌다. 작년 처방액은 2년 전보다 16.9% 감소했다. 올해 3분기 듀비에 시리즈는 총 152억원으로 전년동기보다 2.7% 줄었다. 듀비에 단일제가 200억원에 육박하는 매출로 홀로 선전하고 있다. 지난해 듀비에의 처방액은 192억원으로 듀비에 시리즈의 91.2%를 차지했다. 듀비에는 올해 3분기 누적 처방액 138억원으로 듀비에 시리즈의 90.3%를 점유했다. 종근당 입장에서는 새로운 조합의 복합제를 속속 내놓으면서 처방 시장에서 듀비에의 영향력 확대를 기대할 수 있다. 종근당은 지난 2023년 자누비아의 권리를 사들이며 DPP-4 억제제 시장에서도 탄탄한 라인업을 구축했다. 종근당은 지난 2023년 스위스 MSD 본사와 당뇨치료제 자누비아, 자누메트, 자누메트XR 등 3개 제품의 국내 모든 권리를 도입하는 라이선스 계약을 체결했다. 종근당이 자누비아시리즈 3종의 국내 판매와 유통권리 뿐만 아니라 허가, 상표, 제조 등 모든 권리를 인수하는 내용이다. 계약 기간은 2038년 8월 31일까지다.계약 금액은 총 455억원이다. 종근당은 MSD 본사에 계약금 230억원을 지급하고 매출에 따른 마일스톤 규모는 1700만달러(약 225억원) 규모다. 자누비아는 시타글립틴 성분의 DPP-4 억제계열 당뇨치료제다. 자누메트는 자누비아와 메트포민을 결합한 복합제다. 자누메트 XR은 자누메트의 서방형 제품이다. 자누비아, 자누메트, 자누메트엑스알은 지난해 998억원의 처방액을 합작했다.종근당의 듀비에는 당뇨에 이어 새로운 영역에도 도전한다.종근당의 글로벌 라이선스 파트너사인 아클립스 테라퓨틱스는 지난달 미국 메이요 클리닉과 위마비증 치료 후보물질 ‘M107(로베글리타존)’의 임상 2상을 위한 협약을 체결했다. 듀비에의 주 성분 로베글리타존을 활용해 위마비 치료 가능성을 타진한다.메이요 클리닉은 아클립스의 연구 지원금을 받아 M107의 연구자 주도 임상시험을 진행한다. ‘LOGAST(Lobeglitazone for the treatment of idiopathic gastroparesis)’라는 명칭의 임상 2상은 2026년 1분기에 피험자 모집을 시작하고, 미네소타 로체스터, 애리조나 피닉스, 플로리다 잭슨빌 등 메이요 클리닉의 세 개의 캠퍼스에서 수행될 예정이다.종근당은 2023년 로베글리타존의 신규 적응증 개발을 위해 아클립스와 글로벌 라이선스 협약을 맺었다. 아클립스는 로베글리타존이 경구 투여가 가능한 소분자 약물로, 항염증 효과와 임상적으로 우수한 안전성 프로파일을 보유하고 있음을 확인했다. 염증을 억제하는 M2 대식세포의 발현을 증가시키고 염증을 유발하는 M1 대식세포를 감소시키는 기전을 통해 대식 세포의 불균형을 조절해 위마비증 치료제 개발 가능성을 기대하고 있다.2025-12-23 11:59:58천승현 기자 -
 삼성바이오에피스, 자가면역질환 치료제 일본 품목허가 승인[데일리팜=최다은 기자] 삼성바이오에피스가 일본 후생노동성으로부터 자가면역질환 치료제 스텔라라(Stelara) 바이오시밀러의 품목허가를 받았다. 이번에 승인된 제품은 프로젝트명 SB17(성분명 우스테키누맙)으로, 일본 내 허가 제품명은 ‘ウステキヌマブBS皮下注45mgシリンジ「ニプロ」’다.스텔라라는 인터루킨(IL)-12와 IL-23의 활성을 억제하는 기전의 자가면역질환 치료제로, 판상 건선과 건선성 관절염, 궤양성 대장염 등 다양한 적응증을 보유하고 있다. 글로벌 시장에서 연간 약 15조원(103억6100만달러) 규모의 매출을 기록하고 있는 대표적인 블록버스터 바이오의약품이다.삼성바이오에피스 사옥 전력./ 사진=삼성바이오에피스삼성바이오에피스는 일본 현지 커머셜 파트너사인 니프로 코퍼레이션(NIPRO Corporation)을 통해 내년 5월 일본 시장에 해당 제품을 출시할 계획이다. 양사는 앞서 지난 6월 일본 내 제품 상업화를 위한 파트너십 계약을 체결했다. 이는 삼성바이오에피스가 일본 시장 진출을 위해 현지 기업과 협업한 첫 사례다.정병인 삼성바이오에피스 RA(Regulatory Affairs)팀장(상무)은 “이번 품목허가 승인을 통해 일본 자가면역질환 환자들의 치료 접근성을 높이는 한편, 바이오시밀러 업계 선도 기업으로서 글로벌 시장 확대의 중요한 발판을 마련했다”고 말했다.한편 삼성바이오에피스는 2021년 7월부터 2022년 11월까지 총 8개국에서 판상 건선 환자 503명을 대상으로 SB17의 글로벌 임상 3상을 진행했다. 이를 통해 오리지널 의약품과의 유효성 및 안전성 등 임상의학적 동등성을 확인했다.이후 삼성바이오에피스는 유럽과 미국에서 마케팅 파트너사 산도스를 통해 **‘피즈치바(Pyzchiva®)’**라는 제품명으로 해당 바이오시밀러를 출시했으며, 국내에서는 **‘에피즈텍(Epyztek®)’**이라는 제품명으로 직접 판매하고 있다.2025-12-23 09:14:06최다은 기자
삼성바이오에피스, 자가면역질환 치료제 일본 품목허가 승인[데일리팜=최다은 기자] 삼성바이오에피스가 일본 후생노동성으로부터 자가면역질환 치료제 스텔라라(Stelara) 바이오시밀러의 품목허가를 받았다. 이번에 승인된 제품은 프로젝트명 SB17(성분명 우스테키누맙)으로, 일본 내 허가 제품명은 ‘ウステキヌマブBS皮下注45mgシリンジ「ニプロ」’다.스텔라라는 인터루킨(IL)-12와 IL-23의 활성을 억제하는 기전의 자가면역질환 치료제로, 판상 건선과 건선성 관절염, 궤양성 대장염 등 다양한 적응증을 보유하고 있다. 글로벌 시장에서 연간 약 15조원(103억6100만달러) 규모의 매출을 기록하고 있는 대표적인 블록버스터 바이오의약품이다.삼성바이오에피스 사옥 전력./ 사진=삼성바이오에피스삼성바이오에피스는 일본 현지 커머셜 파트너사인 니프로 코퍼레이션(NIPRO Corporation)을 통해 내년 5월 일본 시장에 해당 제품을 출시할 계획이다. 양사는 앞서 지난 6월 일본 내 제품 상업화를 위한 파트너십 계약을 체결했다. 이는 삼성바이오에피스가 일본 시장 진출을 위해 현지 기업과 협업한 첫 사례다.정병인 삼성바이오에피스 RA(Regulatory Affairs)팀장(상무)은 “이번 품목허가 승인을 통해 일본 자가면역질환 환자들의 치료 접근성을 높이는 한편, 바이오시밀러 업계 선도 기업으로서 글로벌 시장 확대의 중요한 발판을 마련했다”고 말했다.한편 삼성바이오에피스는 2021년 7월부터 2022년 11월까지 총 8개국에서 판상 건선 환자 503명을 대상으로 SB17의 글로벌 임상 3상을 진행했다. 이를 통해 오리지널 의약품과의 유효성 및 안전성 등 임상의학적 동등성을 확인했다.이후 삼성바이오에피스는 유럽과 미국에서 마케팅 파트너사 산도스를 통해 **‘피즈치바(Pyzchiva®)’**라는 제품명으로 해당 바이오시밀러를 출시했으며, 국내에서는 **‘에피즈텍(Epyztek®)’**이라는 제품명으로 직접 판매하고 있다.2025-12-23 09:14:06최다은 기자 -
 톡신은 왜 아직도 '국가핵심기술'인가…해제 요구 확산[데일리팜=이석준 기자] 보툴리눔 톡신이 국가핵심기술로 처음 지정된 것은 2010년이다. 이후 2016년에는 관리 범위가 '균주'까지 확대됐다. 산업통상자원부는 당시 지정 배경으로 독성이 강한 물질이라는 점과 해외 유출 시 국가 안보에 미칠 수 있는 위험성을 들었다. 제도 도입 자체만 놓고 보면, 당시 기술 환경과 정책 기조를 감안한 판단으로 해석할 여지는 있었다.그러나 이후 10년 동안 톡신 산업을 둘러싼 환경은 근본적으로 바뀌었다. 보툴리눔 톡신은 더 이상 일부 국가나 기업만 보유한 희소 기술이 아니다. 글로벌 시장에서는 이미 다수 기업이 상업화에 성공했고, 국내만 해도 허가 품목만 30개 이상으로 파악된다. 경쟁의 초점 역시 균주 자체에서 제조 공정의 안정성, 품질 관리 체계, 임상 데이터의 신뢰성, 글로벌 공급망 운영 능력으로 이동했다. 즉, ‘무엇을 갖고 있느냐’보다 ‘어떻게 운용하느냐’가 경쟁력을 가르는 산업으로 성격이 바뀌었다.특히 톡신은 미용을 넘어 치료 영역으로 빠르게 확장되고 있다. 근긴장이상, 사시, 편두통, 뇌성마비, 경직 치료 등으로 적응증이 넓어지면서 임상 데이터 축적과 장기 안전성 관리가 핵심 경쟁 요소로 부상했다. 기술을 ‘가지고 있느냐’보다 ‘어떻게 관리하고 재현하느냐’가 산업 경쟁력을 좌우하는 구조로 전환된 셈이다.그럼에도 국내 제도는 과거의 판단 위에 머물러 있다. 균주와 제조기술을 포괄하는 국가핵심기술 지정은 그대로 유지되고 있고, 수출이나 해외 임상, 기술 협력 단계마다 산업통상자원부 장관 승인이라는 별도 절차가 요구된다. 업계에 따르면 승인에는 평균 수개월이 소요되며, 경우에 따라 1년 가까이 지연되는 사례도 적지 않다. 이 과정에서 기업의 전략과 일정은 제도 변수에 의해 반복적으로 흔들린다.이로 인한 부담은 단순한 행정 불편을 넘어선다. 해외 임상 일정이 늦어지고 글로벌 파트너와의 협상 과정에서는 규제 리스크가 상수로 작용한다. 동일한 시장에서 경쟁하는 해외 기업들이 비교적 자유롭게 생산 거점을 다변화하는 동안, 국내 기업은 규제 불확실성을 안고 출발선에 서게 된다.10년 멈춘 기준, 바뀐 산업이같은 간극은 단순한 인식 차원을 넘어 정책 효과의 문제로 이어진다. 국가핵심기술 지정은 기술 보호를 목적으로 하지만, 톡신 산업에서는 오히려 기술 활용과 확장을 제약하는 요인으로 작동하고 있다는 지적이 나온다. 글로벌 시장에서 경쟁의 기준이 이미 ‘기술 보유’에서 ‘운영·관리 역량’으로 이동한 상황에서, 제도는 여전히 과거의 잣대에 머물러 있다는 것이다. 보호 논리가 산업 경쟁력과 어긋나기 시작했다는 문제의식이다.자연계에 존재하는 미생물 균주를 ‘국가핵심기술’로 규정하는 것이 산업기술보호법의 취지에 부합하느냐는 근본적 질문도 제기된다. 국가핵심기술은 해외 유출 시 국가 경제와 안보에 중대한 피해를 주는 독창적 기술을 전제로 한다. 이미 특허가 만료되고 해외에서 상용화된 기술까지 동일한 틀로 관리하는 것이 합리적인지에 대한 문제 제기가 반복되는 이유다.현장에서는 제도 유지의 명분과 산업 현실 사이의 간극을 체감하고 있다. 보호를 위해 도입된 규제가 결과적으로는 산업의 속도를 늦추고 있다는 인식이다. 글로벌 경쟁이 가속화되는 상황에서 과거 기준을 그대로 적용하는 것이 산업 발전을 저해하고 있다는 우려도 커지고 있다.업계 관계자는 “국가핵심기술 지정이 도입 당시에는 의미가 있었을지 몰라도 지금은 산업 환경이 완전히 달라졌다. 제도가 여전히 목적에 맞게 작동하는지 객관적인 재검토가 필요하다”고 말했다.2025-12-22 12:00:56이석준 기자
톡신은 왜 아직도 '국가핵심기술'인가…해제 요구 확산[데일리팜=이석준 기자] 보툴리눔 톡신이 국가핵심기술로 처음 지정된 것은 2010년이다. 이후 2016년에는 관리 범위가 '균주'까지 확대됐다. 산업통상자원부는 당시 지정 배경으로 독성이 강한 물질이라는 점과 해외 유출 시 국가 안보에 미칠 수 있는 위험성을 들었다. 제도 도입 자체만 놓고 보면, 당시 기술 환경과 정책 기조를 감안한 판단으로 해석할 여지는 있었다.그러나 이후 10년 동안 톡신 산업을 둘러싼 환경은 근본적으로 바뀌었다. 보툴리눔 톡신은 더 이상 일부 국가나 기업만 보유한 희소 기술이 아니다. 글로벌 시장에서는 이미 다수 기업이 상업화에 성공했고, 국내만 해도 허가 품목만 30개 이상으로 파악된다. 경쟁의 초점 역시 균주 자체에서 제조 공정의 안정성, 품질 관리 체계, 임상 데이터의 신뢰성, 글로벌 공급망 운영 능력으로 이동했다. 즉, ‘무엇을 갖고 있느냐’보다 ‘어떻게 운용하느냐’가 경쟁력을 가르는 산업으로 성격이 바뀌었다.특히 톡신은 미용을 넘어 치료 영역으로 빠르게 확장되고 있다. 근긴장이상, 사시, 편두통, 뇌성마비, 경직 치료 등으로 적응증이 넓어지면서 임상 데이터 축적과 장기 안전성 관리가 핵심 경쟁 요소로 부상했다. 기술을 ‘가지고 있느냐’보다 ‘어떻게 관리하고 재현하느냐’가 산업 경쟁력을 좌우하는 구조로 전환된 셈이다.그럼에도 국내 제도는 과거의 판단 위에 머물러 있다. 균주와 제조기술을 포괄하는 국가핵심기술 지정은 그대로 유지되고 있고, 수출이나 해외 임상, 기술 협력 단계마다 산업통상자원부 장관 승인이라는 별도 절차가 요구된다. 업계에 따르면 승인에는 평균 수개월이 소요되며, 경우에 따라 1년 가까이 지연되는 사례도 적지 않다. 이 과정에서 기업의 전략과 일정은 제도 변수에 의해 반복적으로 흔들린다.이로 인한 부담은 단순한 행정 불편을 넘어선다. 해외 임상 일정이 늦어지고 글로벌 파트너와의 협상 과정에서는 규제 리스크가 상수로 작용한다. 동일한 시장에서 경쟁하는 해외 기업들이 비교적 자유롭게 생산 거점을 다변화하는 동안, 국내 기업은 규제 불확실성을 안고 출발선에 서게 된다.10년 멈춘 기준, 바뀐 산업이같은 간극은 단순한 인식 차원을 넘어 정책 효과의 문제로 이어진다. 국가핵심기술 지정은 기술 보호를 목적으로 하지만, 톡신 산업에서는 오히려 기술 활용과 확장을 제약하는 요인으로 작동하고 있다는 지적이 나온다. 글로벌 시장에서 경쟁의 기준이 이미 ‘기술 보유’에서 ‘운영·관리 역량’으로 이동한 상황에서, 제도는 여전히 과거의 잣대에 머물러 있다는 것이다. 보호 논리가 산업 경쟁력과 어긋나기 시작했다는 문제의식이다.자연계에 존재하는 미생물 균주를 ‘국가핵심기술’로 규정하는 것이 산업기술보호법의 취지에 부합하느냐는 근본적 질문도 제기된다. 국가핵심기술은 해외 유출 시 국가 경제와 안보에 중대한 피해를 주는 독창적 기술을 전제로 한다. 이미 특허가 만료되고 해외에서 상용화된 기술까지 동일한 틀로 관리하는 것이 합리적인지에 대한 문제 제기가 반복되는 이유다.현장에서는 제도 유지의 명분과 산업 현실 사이의 간극을 체감하고 있다. 보호를 위해 도입된 규제가 결과적으로는 산업의 속도를 늦추고 있다는 인식이다. 글로벌 경쟁이 가속화되는 상황에서 과거 기준을 그대로 적용하는 것이 산업 발전을 저해하고 있다는 우려도 커지고 있다.업계 관계자는 “국가핵심기술 지정이 도입 당시에는 의미가 있었을지 몰라도 지금은 산업 환경이 완전히 달라졌다. 제도가 여전히 목적에 맞게 작동하는지 객관적인 재검토가 필요하다”고 말했다.2025-12-22 12:00:56이석준 기자 -
 샤페론–국전약품, 먹는 알츠하이머 치료제 1상 투약 완료[데일리팜=이석준 기자] 샤페론은 국전약품과 공동 연구·개발 중인 경구용 알츠하이머 치료제 ‘누세린(NuCerin)’의 국내 임상 1상 시험 투약을 완료했다고 22일 밝혔다. 현재 임상시험 대행 기관(CRO)을 통해 확보된 데이터를 기반으로 상세 분석이 진행 중이며, 내년 1분기 내 임상시험결과보고서(CSR)를 확보할 계획이다. 양사는 이를 토대로 글로벌 상업화 및 기술이전 논의를 본격화할 방침이다. 임상 1상은 건강한 성인을 대상으로 단회투여(SAD) 및 반복투여(MAD) 시험으로 나뉘 진행됐다. SAD 시험을 통해 적정 용량과 투여 방식을 확인한 뒤, MAD 시험에서는 용량을 단계적으로 높이며 경구 제형의 반복 투여 가능성을 평가했다. 총 52명이 참여했으며, 6개 용량군에서 투약이 이뤄졌다. 현재는 모든 투약과 추적 관찰이 종료됨에 따라 안전성, 내약성, 약동학(PK) 특성에 대한 분석이 진행 중이다. 누세린은 아밀로이드 베타 축적에 의해 활성화되는 염증복합체(inflammasome) 경로를 조절해 뇌 염증을 완화하는 기전의 경구용 치료제 후보물질이다. 주사제 형태의 항체 치료제가 아밀로이드 베타 자체를 제거하는 데 초점을 맞췄다면, 누세린은 신경 염증을 억제해 신경세포 사멸을 줄이고 인지·기억 기능 저하를 완화하는 접근법을 취한다. 회사 측에 따르면 치매 유발 동물 모델에서 인지·기억 능력 보존 효과가 확인됐으며, 관련 결과는 다수의 논문과 학회를 통해 발표됐다. 누세린의 작용 표적인 GPCR19는 염증성 질환과 대사 질환 등 다양한 치료 영역에서 연구돼 온 수용체로, 2000년대 초부터 글로벌 제약사들이 신약 개발을 시도해 왔다. 다만 약물 결합 방식과 작용 조절의 어려움으로 인해 염증성 질환을 적응증으로 한 상업적 성공 사례는 제한적이었다는 평가가 많다. 샤페론은 인공지능(AI) 기반 구조 분석을 통해 GPCR19 수용체의 결합 부위를 정밀 분석하는 과정에서, 누세린이 기존 후보물질들과는 다른 결합 특성을 갖고 있다는 점에 주목했다. 기존 접근법이 수용체의 작용 부위에 강하게 작용하면서 부작용을 유발했던 반면, 누세린은 수용체의 정상 생리 신호를 유지한 채 활성도를 미세하게 조절하는 방식으로 설계됐다는 설명이다. 실제로 경쟁 후보물질들의 선행 임상에서는 담낭 비대나 심혈관계 부작용 등이 보고되며 개발이 중단된 사례가 있었다. 샤페론은 이번 경구제 임상 1상 결과를 바탕으로 알츠하이머 외에도 전신 염증 반응이 관여하는 다른 질환으로 적응증 확대 가능성을 검토하고 있다. 이를 통해 염증복합체 억제 플랫폼을 다양한 염증성 질환으로 확장하는 전략을 추진 중이다. 국전약품은 샤페론으로부터 누세린에 대한 국내 개발 및 사업화 독점 권한을 확보했으며, 양사는 임상 1상 결과를 토대로 임상 개발 확대와 함께 국내외 제약사들과의 기술이전 협의를 진행할 계획이다. 원천기술을 보유한 샤페론은 미국, 유럽, 일본 등 주요 해외 시장에 대한 권리를 보유하고 있다.2025-12-22 10:23:29이석준 기자
샤페론–국전약품, 먹는 알츠하이머 치료제 1상 투약 완료[데일리팜=이석준 기자] 샤페론은 국전약품과 공동 연구·개발 중인 경구용 알츠하이머 치료제 ‘누세린(NuCerin)’의 국내 임상 1상 시험 투약을 완료했다고 22일 밝혔다. 현재 임상시험 대행 기관(CRO)을 통해 확보된 데이터를 기반으로 상세 분석이 진행 중이며, 내년 1분기 내 임상시험결과보고서(CSR)를 확보할 계획이다. 양사는 이를 토대로 글로벌 상업화 및 기술이전 논의를 본격화할 방침이다. 임상 1상은 건강한 성인을 대상으로 단회투여(SAD) 및 반복투여(MAD) 시험으로 나뉘 진행됐다. SAD 시험을 통해 적정 용량과 투여 방식을 확인한 뒤, MAD 시험에서는 용량을 단계적으로 높이며 경구 제형의 반복 투여 가능성을 평가했다. 총 52명이 참여했으며, 6개 용량군에서 투약이 이뤄졌다. 현재는 모든 투약과 추적 관찰이 종료됨에 따라 안전성, 내약성, 약동학(PK) 특성에 대한 분석이 진행 중이다. 누세린은 아밀로이드 베타 축적에 의해 활성화되는 염증복합체(inflammasome) 경로를 조절해 뇌 염증을 완화하는 기전의 경구용 치료제 후보물질이다. 주사제 형태의 항체 치료제가 아밀로이드 베타 자체를 제거하는 데 초점을 맞췄다면, 누세린은 신경 염증을 억제해 신경세포 사멸을 줄이고 인지·기억 기능 저하를 완화하는 접근법을 취한다. 회사 측에 따르면 치매 유발 동물 모델에서 인지·기억 능력 보존 효과가 확인됐으며, 관련 결과는 다수의 논문과 학회를 통해 발표됐다. 누세린의 작용 표적인 GPCR19는 염증성 질환과 대사 질환 등 다양한 치료 영역에서 연구돼 온 수용체로, 2000년대 초부터 글로벌 제약사들이 신약 개발을 시도해 왔다. 다만 약물 결합 방식과 작용 조절의 어려움으로 인해 염증성 질환을 적응증으로 한 상업적 성공 사례는 제한적이었다는 평가가 많다. 샤페론은 인공지능(AI) 기반 구조 분석을 통해 GPCR19 수용체의 결합 부위를 정밀 분석하는 과정에서, 누세린이 기존 후보물질들과는 다른 결합 특성을 갖고 있다는 점에 주목했다. 기존 접근법이 수용체의 작용 부위에 강하게 작용하면서 부작용을 유발했던 반면, 누세린은 수용체의 정상 생리 신호를 유지한 채 활성도를 미세하게 조절하는 방식으로 설계됐다는 설명이다. 실제로 경쟁 후보물질들의 선행 임상에서는 담낭 비대나 심혈관계 부작용 등이 보고되며 개발이 중단된 사례가 있었다. 샤페론은 이번 경구제 임상 1상 결과를 바탕으로 알츠하이머 외에도 전신 염증 반응이 관여하는 다른 질환으로 적응증 확대 가능성을 검토하고 있다. 이를 통해 염증복합체 억제 플랫폼을 다양한 염증성 질환으로 확장하는 전략을 추진 중이다. 국전약품은 샤페론으로부터 누세린에 대한 국내 개발 및 사업화 독점 권한을 확보했으며, 양사는 임상 1상 결과를 토대로 임상 개발 확대와 함께 국내외 제약사들과의 기술이전 협의를 진행할 계획이다. 원천기술을 보유한 샤페론은 미국, 유럽, 일본 등 주요 해외 시장에 대한 권리를 보유하고 있다.2025-12-22 10:23:29이석준 기자 -
 '엘라히어' 국내 등장…애브비, ADC 개발 잇단 성과ADC 신약 '엘라히어'[데일리팜=손형민 기자] 애브비가 항체약물접합체(ADC) 신약 상용화에 연이어 성공하며 항암 포트폴리오를 빠르게 확장하고 있다.이 회사는 난소암에서는 첫 ADC 치료제 허가를 확보했고 비소세포폐암(NSCLC)에서는 c-Met 타깃 ADC를 허가받으며 미충족 수요 공략에 나섰다.20일 관련 업계에 따르면 애브비는 19일 백금저항성 난소암 ADC 신약 '엘라히어(미르베툭시맙 소라브탄신)'의 국내 허가를 획득했다. 구체적인 적응증은 이전에 한 가지에서 세 가지의 전신 요법을 받은 적이 있고, 엽산 수용체 알파(FRα) 양성이면서 백금기반 화학요법에 저항성이 있는 고등급 장액성 상피성 난소암, 난관암 또는 원발성 복막암 성인 환자 치료다. 엘라히어는 FRα를 발현하는 난소암을 겨냥한 ADC로, 강력한 세포독성 약물 DM4를 암세포 내로 전달해 종양을 사멸시키는 기전이다. 특히 백금계 항암제에 내성을 보이는 난소암 환자군에서 새로운 옵션으로 주목받고 있다. 이 치료제는 백금저항성난소암 치료에 약 10년만에 등장한 새로운 기전의 신약으로 올해 1월 국내에서 희귀의약품에 지정되기도 했다.엘라히어는 엽산 수용체 알파 결합 항체, 가용성 링크, 그리고 표적 암세포를 죽이도록 설계된 강력한 미세소관 억제제인 메이탄시노이드 계열의 DM4를 포함하는 최초로 개발된 ADC다.난소암의 90%를 차지하는 상피성 난소암에서는 파클리탁셀 등 탁산 계열 약물과 카보플라틴, 시스플라틴 등 백금계열 항암제가 주로 사용된다. 다만 백금계 약물에 저항성이 있는 재발성 난소암의 경우 기존의 표준요법인 항암화학요법에 대한 반응률이 전반적으로 낮게 나타나 생존율 개선에 많은 제한이 있었다. 엘라히어는 백금 저항성 난소암 환자들을 대상으로 진행한 임상3상 MIRASOL 연구를 통해 새로운 대안이 될 수 있음을 증명했다.MIRASOL 연구에서 엘라히어는 기존 비백금 항암화학요법 대비 질병 진행 또는 사망 위험을 35% 감소시켰다.무진행생존기간(PFS) 중앙값은 5.62개월로 대조군 3.98개월 대비 개선됐고, 객관적반응률(ORR)은 최대 42.3%로 표준치료요법군 15.9%보다 유의하게 높았다.전체생존기간(OS) 역시 16.85개월로, 대조군 13.34개월 대비 사망 위험을 32% 낮췄다.안전성 측면에서는 안구 관련 이상반응, 피로, 복통 등이 보고됐으나 전반적으로 관리 가능한 수준으로 평가됐다.이 같은 임상 성과를 바탕으로 엘라히어는 지난해 3월 미국, 같은 해 11월 유럽에서 허가를 받았다.미국 NCCN 가이드라인은 FRα 양성 백금저항성 난소암 환자 치료에서 엘라히어를 선호요법(preferred regimen)이자 카테고리 1로 권고하고 있으며, 대한부인종양학회 역시 최고 근거 수준(Level I), 권고 등급 A로 엘라히어 사용을 권고하고 있다비소세포폐암서도 c-Met 타깃 ‘엠렐리스’ 상용화ADC 신약 '엠렐리스'애브비는 난소암에 이어 비소세포폐암에서도 ADC 상용화에 성공했다.지난 5월 미국 식품의약국(FDA)은 c-Met 타깃 ADC '엠렐리스(텔리소투주맙 베도틴)'를 이전 치료를 받은 국소 진행성 또는 전이성 비편평 비소세포폐암 성인 환자 중 c-Met 단백 과발현 환자를 대상으로 가속 승인했다.c-Met은 상피간엽이행(Met) 유전자에 의해 발현된 단백질이다. c-Met은 세포에 신호를 전달하는 단백질 중 하나로 대표적인 암 유발 유전자로 꼽히며 비소세포폐암뿐만 아니라 대장암, 위암, 간암 등 각종 고형암 발생과 연관이 있다. 비소세포폐암 환자 중 6%에서 c-Met 변이가 나타나는 것으로 알려져 있다.현재 c-Met 변이를 타깃하는 ADC 중 상용화 된 제품은 애브비의 엠렐리스가 유일하다. 엠렐리스는 주요 평가지표인 ORR과 반응지속기간(DOR) 개선을 근거로 이뤄졌으며, 확증 임상에서 임상적 유용성이 확인될 경우 정식 승인으로 전환될 예정이다. 임상2상 LUMINOSITY 연구에서 c-Met 과발현 환자 84명을 대상으로 한 분석 결과, 엠렐리스 투여군의 ORR은 35%, DOR 중앙값은 7.2개월로 나타났다.주요 이상반응은 말초신경병증, 피로, 식욕 감소, 말초부종 등이었으며, 3~4등급 이상반응으로는 림프구 감소, 간효소 상승, 전해질 이상 등이 보고됐다.엠렐리스는 2021년 해당 임상 데이터를 근거로 FDA로부터 혁신치료제(Breakthrough Therapy Designation)로도 지정된 바 있다.현재 엠렐리스는 3상 확증 임상 TeliMET NSCLC-01 연구에서 단독요법으로 추가 평가가 진행 중이다.2025-12-20 06:00:54손형민 기자
'엘라히어' 국내 등장…애브비, ADC 개발 잇단 성과ADC 신약 '엘라히어'[데일리팜=손형민 기자] 애브비가 항체약물접합체(ADC) 신약 상용화에 연이어 성공하며 항암 포트폴리오를 빠르게 확장하고 있다.이 회사는 난소암에서는 첫 ADC 치료제 허가를 확보했고 비소세포폐암(NSCLC)에서는 c-Met 타깃 ADC를 허가받으며 미충족 수요 공략에 나섰다.20일 관련 업계에 따르면 애브비는 19일 백금저항성 난소암 ADC 신약 '엘라히어(미르베툭시맙 소라브탄신)'의 국내 허가를 획득했다. 구체적인 적응증은 이전에 한 가지에서 세 가지의 전신 요법을 받은 적이 있고, 엽산 수용체 알파(FRα) 양성이면서 백금기반 화학요법에 저항성이 있는 고등급 장액성 상피성 난소암, 난관암 또는 원발성 복막암 성인 환자 치료다. 엘라히어는 FRα를 발현하는 난소암을 겨냥한 ADC로, 강력한 세포독성 약물 DM4를 암세포 내로 전달해 종양을 사멸시키는 기전이다. 특히 백금계 항암제에 내성을 보이는 난소암 환자군에서 새로운 옵션으로 주목받고 있다. 이 치료제는 백금저항성난소암 치료에 약 10년만에 등장한 새로운 기전의 신약으로 올해 1월 국내에서 희귀의약품에 지정되기도 했다.엘라히어는 엽산 수용체 알파 결합 항체, 가용성 링크, 그리고 표적 암세포를 죽이도록 설계된 강력한 미세소관 억제제인 메이탄시노이드 계열의 DM4를 포함하는 최초로 개발된 ADC다.난소암의 90%를 차지하는 상피성 난소암에서는 파클리탁셀 등 탁산 계열 약물과 카보플라틴, 시스플라틴 등 백금계열 항암제가 주로 사용된다. 다만 백금계 약물에 저항성이 있는 재발성 난소암의 경우 기존의 표준요법인 항암화학요법에 대한 반응률이 전반적으로 낮게 나타나 생존율 개선에 많은 제한이 있었다. 엘라히어는 백금 저항성 난소암 환자들을 대상으로 진행한 임상3상 MIRASOL 연구를 통해 새로운 대안이 될 수 있음을 증명했다.MIRASOL 연구에서 엘라히어는 기존 비백금 항암화학요법 대비 질병 진행 또는 사망 위험을 35% 감소시켰다.무진행생존기간(PFS) 중앙값은 5.62개월로 대조군 3.98개월 대비 개선됐고, 객관적반응률(ORR)은 최대 42.3%로 표준치료요법군 15.9%보다 유의하게 높았다.전체생존기간(OS) 역시 16.85개월로, 대조군 13.34개월 대비 사망 위험을 32% 낮췄다.안전성 측면에서는 안구 관련 이상반응, 피로, 복통 등이 보고됐으나 전반적으로 관리 가능한 수준으로 평가됐다.이 같은 임상 성과를 바탕으로 엘라히어는 지난해 3월 미국, 같은 해 11월 유럽에서 허가를 받았다.미국 NCCN 가이드라인은 FRα 양성 백금저항성 난소암 환자 치료에서 엘라히어를 선호요법(preferred regimen)이자 카테고리 1로 권고하고 있으며, 대한부인종양학회 역시 최고 근거 수준(Level I), 권고 등급 A로 엘라히어 사용을 권고하고 있다비소세포폐암서도 c-Met 타깃 ‘엠렐리스’ 상용화ADC 신약 '엠렐리스'애브비는 난소암에 이어 비소세포폐암에서도 ADC 상용화에 성공했다.지난 5월 미국 식품의약국(FDA)은 c-Met 타깃 ADC '엠렐리스(텔리소투주맙 베도틴)'를 이전 치료를 받은 국소 진행성 또는 전이성 비편평 비소세포폐암 성인 환자 중 c-Met 단백 과발현 환자를 대상으로 가속 승인했다.c-Met은 상피간엽이행(Met) 유전자에 의해 발현된 단백질이다. c-Met은 세포에 신호를 전달하는 단백질 중 하나로 대표적인 암 유발 유전자로 꼽히며 비소세포폐암뿐만 아니라 대장암, 위암, 간암 등 각종 고형암 발생과 연관이 있다. 비소세포폐암 환자 중 6%에서 c-Met 변이가 나타나는 것으로 알려져 있다.현재 c-Met 변이를 타깃하는 ADC 중 상용화 된 제품은 애브비의 엠렐리스가 유일하다. 엠렐리스는 주요 평가지표인 ORR과 반응지속기간(DOR) 개선을 근거로 이뤄졌으며, 확증 임상에서 임상적 유용성이 확인될 경우 정식 승인으로 전환될 예정이다. 임상2상 LUMINOSITY 연구에서 c-Met 과발현 환자 84명을 대상으로 한 분석 결과, 엠렐리스 투여군의 ORR은 35%, DOR 중앙값은 7.2개월로 나타났다.주요 이상반응은 말초신경병증, 피로, 식욕 감소, 말초부종 등이었으며, 3~4등급 이상반응으로는 림프구 감소, 간효소 상승, 전해질 이상 등이 보고됐다.엠렐리스는 2021년 해당 임상 데이터를 근거로 FDA로부터 혁신치료제(Breakthrough Therapy Designation)로도 지정된 바 있다.현재 엠렐리스는 3상 확증 임상 TeliMET NSCLC-01 연구에서 단독요법으로 추가 평가가 진행 중이다.2025-12-20 06:00:54손형민 기자 -
 모더나, RSV mRNA 백신 '엠레스비아' 국내 허가 획득RSV mRNA 백신 '엠레스비아'[데일리팜=손형민 기자] 모더나코리아는 최근 호흡기세포융합바이러스(RSV) mRNA 백신 '엠레스비아프리필드시린지'가 식품의약품안전처로부터 허가를 받았다고 19일 밝혔다. 이번 허가는 RSV 예방을 위한 mRNA 플랫폼 백신으로는 국내 최초다.엠레스비아프리필드시린지는 60세 이상 성인과 18세 이상 60세 미만의 RSV 고위험군 성인에서 RSV로 인한 하기도 질환(LRTD) 예방을 목적으로 허가됐다. RSV는 감기와 유사한 증상부터 폐렴 등 중증 하기도 감염으로 진행될 수 있는 바이러스로, 특히 고령자와 기저질환을 가진 성인에서 질병 부담이 큰 것으로 알려져 있다.모더나코리아 김상표 대표는 "RSV는 고령층과 기저질환을 가진 성인에게 입원과 중증 합병증으로 이어질 수 있는 주요 호흡기 질환"이라며 "엠레스비아프리필드시린지는 한국에서 허가된 모더나의 두 번째 제품으로, 코로나19에 이어 RSV 예방까지 모더나의 mRNA 기술로 공중보건에 기여할 수 있게 되어 매우 뜻깊게 생각한다"고 말했다. 이어 "모더나코리아는RSV를 포함한 다양한 호흡기 감염병 예방을 위해 앞으로도 보건당국과 긴밀히 협력해 나가겠다"고 덧붙였다. 엠레스비아프리필드시린지의 허가는 한국을 포함한 22개국에서 60세 이상 성인 약 3만7천 명을 대상으로 진행된 무작위 배정, 위약 대조, 관찰자 눈가림(observer-blind), 사례 기반(case-driven) 3상 임상시험 'ConquerRSV'의 긍정적인 결과를 근거로 이뤄졌다. 해당 3상 임상시험에서 중대한 안전성 우려는 확인되지 않았다.모더나는 이번 국내 허가를 통해 RSV 예방 영역에서 mRNA 기술의 확장 가능성을 제시하고, 고위험군 성인을 포함한 더 넓은 연령층의 RSV 예방에 기여할 수 있을 것으로 기대하고 있다.2025-12-19 10:47:20손형민 기자
모더나, RSV mRNA 백신 '엠레스비아' 국내 허가 획득RSV mRNA 백신 '엠레스비아'[데일리팜=손형민 기자] 모더나코리아는 최근 호흡기세포융합바이러스(RSV) mRNA 백신 '엠레스비아프리필드시린지'가 식품의약품안전처로부터 허가를 받았다고 19일 밝혔다. 이번 허가는 RSV 예방을 위한 mRNA 플랫폼 백신으로는 국내 최초다.엠레스비아프리필드시린지는 60세 이상 성인과 18세 이상 60세 미만의 RSV 고위험군 성인에서 RSV로 인한 하기도 질환(LRTD) 예방을 목적으로 허가됐다. RSV는 감기와 유사한 증상부터 폐렴 등 중증 하기도 감염으로 진행될 수 있는 바이러스로, 특히 고령자와 기저질환을 가진 성인에서 질병 부담이 큰 것으로 알려져 있다.모더나코리아 김상표 대표는 "RSV는 고령층과 기저질환을 가진 성인에게 입원과 중증 합병증으로 이어질 수 있는 주요 호흡기 질환"이라며 "엠레스비아프리필드시린지는 한국에서 허가된 모더나의 두 번째 제품으로, 코로나19에 이어 RSV 예방까지 모더나의 mRNA 기술로 공중보건에 기여할 수 있게 되어 매우 뜻깊게 생각한다"고 말했다. 이어 "모더나코리아는RSV를 포함한 다양한 호흡기 감염병 예방을 위해 앞으로도 보건당국과 긴밀히 협력해 나가겠다"고 덧붙였다. 엠레스비아프리필드시린지의 허가는 한국을 포함한 22개국에서 60세 이상 성인 약 3만7천 명을 대상으로 진행된 무작위 배정, 위약 대조, 관찰자 눈가림(observer-blind), 사례 기반(case-driven) 3상 임상시험 'ConquerRSV'의 긍정적인 결과를 근거로 이뤄졌다. 해당 3상 임상시험에서 중대한 안전성 우려는 확인되지 않았다.모더나는 이번 국내 허가를 통해 RSV 예방 영역에서 mRNA 기술의 확장 가능성을 제시하고, 고위험군 성인을 포함한 더 넓은 연령층의 RSV 예방에 기여할 수 있을 것으로 기대하고 있다.2025-12-19 10:47:20손형민 기자 -
 식약처, 항체·약물 복합체 등 참조물질 32종 무상 분양[데일리팜=이탁순 기자] 식품의약품안전처(처장 오유경) 소속 식품의약품안전평가원(원장 강석연)은 바이오의약품 연구·개발에 활용할 수 있도록 항체·약물 복합체, 인유두종바이러스 항원 등 참조물질 32종을 새로 개발해 무상으로 추가 분양한다고 19일 밝혔다. 항체·약물 복합제는 항체와 세포독성 약물이 결합 된 복합체로 항체가 암세포를 정밀 표적화하고 세포독성 약물로 암세포만 사멸시켜 정상세포에 미치는 부작용을 최소화한 새로운 개념의 치료제다. 인유두종바이러스 항원은 인유두종바이러스 감염 진단과 예방접종 후 면역원성 평가 등에 사용된다.'참조물질'은 바이오의약품의 품질, 안전성, 효능을 시험할 때 사용하는 기준물질로, 이를 활용하면 의약품 개발의 시간과 비용을 줄일 수 있다. 식약처는 그간 혈청·항원·항체 등 57종의 참조물질을 분양하고 있다.참조물질 목록과 분양신청서는 식품의약품안전평가원 누리집에서 확인할 수 있으며, 바이오의약품 개발·연구 업체는 담당부서(바이오의약품연구과)에 전자우편이나 전화로 신청하면 의약품 개발 등 사용 목적에 따라 무상으로 공급받을 수 있다.식약처는 신규 개발된 참조물질 분양을 통해 바이오의약품 연구·개발이 차질 없이 수행되는데 도움될 것으로 기대하며, 앞으로도 바이오의약품 참조물질을 지속적으로 개발하여 제공할 예정이라고 밝혔다.2025-12-19 09:58:48이탁순 기자
식약처, 항체·약물 복합체 등 참조물질 32종 무상 분양[데일리팜=이탁순 기자] 식품의약품안전처(처장 오유경) 소속 식품의약품안전평가원(원장 강석연)은 바이오의약품 연구·개발에 활용할 수 있도록 항체·약물 복합체, 인유두종바이러스 항원 등 참조물질 32종을 새로 개발해 무상으로 추가 분양한다고 19일 밝혔다. 항체·약물 복합제는 항체와 세포독성 약물이 결합 된 복합체로 항체가 암세포를 정밀 표적화하고 세포독성 약물로 암세포만 사멸시켜 정상세포에 미치는 부작용을 최소화한 새로운 개념의 치료제다. 인유두종바이러스 항원은 인유두종바이러스 감염 진단과 예방접종 후 면역원성 평가 등에 사용된다.'참조물질'은 바이오의약품의 품질, 안전성, 효능을 시험할 때 사용하는 기준물질로, 이를 활용하면 의약품 개발의 시간과 비용을 줄일 수 있다. 식약처는 그간 혈청·항원·항체 등 57종의 참조물질을 분양하고 있다.참조물질 목록과 분양신청서는 식품의약품안전평가원 누리집에서 확인할 수 있으며, 바이오의약품 개발·연구 업체는 담당부서(바이오의약품연구과)에 전자우편이나 전화로 신청하면 의약품 개발 등 사용 목적에 따라 무상으로 공급받을 수 있다.식약처는 신규 개발된 참조물질 분양을 통해 바이오의약품 연구·개발이 차질 없이 수행되는데 도움될 것으로 기대하며, 앞으로도 바이오의약품 참조물질을 지속적으로 개발하여 제공할 예정이라고 밝혔다.2025-12-19 09:58:48이탁순 기자 -
 GC녹십자 코로나19 mRNA 백신, 임상1상 승인[데일리팜=이탁순 기자] GC녹십자의 코로나19 mRNA 백신 후보 물질이 국내 임상 1상 시험시험계획서를 승인받았다. 국산 mRNA 백신이 상업화에 성공해 우리나라도 펜데믹 대응 역량을 갖추게 될 지 주목된다.식약처는 18일 녹십자 'GC4006A'의 임상1상을 승인했다. 이번 임상은 19~64세의 건강한 성인을 대상으로 코로나19 예방 백신 'GC4006A'의 안전성 및 면역원성을 평가하기 위한 제1상 시험이다.시험은 고대안산병원, 강남성심병원, 고대구로병원에서 진행될 예정이다.GC4006A는 GC녹십자가 2019년부터 시작한 mRNA-LNP 연구를 통해 mRNA 의약품 개발 전 공정을 자체적으로 수행할 수 있는 플랫폼을 확보하면서 상업화 개발이 진행되고 있다.회사는 자체 플랫폼이 이번 임상을 통해 검증되면, 새로운 팬데믹 발생시 100일 이내 대응이 가능할 것으로 전망하고 있다.GC40006A는 지난 4월 질병관리청이 주관하는 '펜데믹 대비 mRNA 백신 개발 지원 사업'에도 선정된 바 있다. 질병청은 2028년까지 mRNA 백신 국산화를 목표로 해당 후보물질을 지원할 방침이다.GC녹십자는 내년 초 첫 투약을 개시할 계획이다. 비임상시험에서 GC4006A는 기존 상용 백신과 유사한 수준의 항체를 생성하는 체액성 면역 반응뿐 아니라, 바이러스 감염 세포를 공격하는 세포성 면역 반응도 효과적으로 유도한 것으로 확인됐다.녹십자는 mRNA-LNP 플랫폼을 희귀 유전 질환, 만성 염증 질환, 항암 면역 치료제, 백신 등 다양한 파이프라인으로 확대할 예정이다.2025-12-19 09:52:59이탁순 기자
GC녹십자 코로나19 mRNA 백신, 임상1상 승인[데일리팜=이탁순 기자] GC녹십자의 코로나19 mRNA 백신 후보 물질이 국내 임상 1상 시험시험계획서를 승인받았다. 국산 mRNA 백신이 상업화에 성공해 우리나라도 펜데믹 대응 역량을 갖추게 될 지 주목된다.식약처는 18일 녹십자 'GC4006A'의 임상1상을 승인했다. 이번 임상은 19~64세의 건강한 성인을 대상으로 코로나19 예방 백신 'GC4006A'의 안전성 및 면역원성을 평가하기 위한 제1상 시험이다.시험은 고대안산병원, 강남성심병원, 고대구로병원에서 진행될 예정이다.GC4006A는 GC녹십자가 2019년부터 시작한 mRNA-LNP 연구를 통해 mRNA 의약품 개발 전 공정을 자체적으로 수행할 수 있는 플랫폼을 확보하면서 상업화 개발이 진행되고 있다.회사는 자체 플랫폼이 이번 임상을 통해 검증되면, 새로운 팬데믹 발생시 100일 이내 대응이 가능할 것으로 전망하고 있다.GC40006A는 지난 4월 질병관리청이 주관하는 '펜데믹 대비 mRNA 백신 개발 지원 사업'에도 선정된 바 있다. 질병청은 2028년까지 mRNA 백신 국산화를 목표로 해당 후보물질을 지원할 방침이다.GC녹십자는 내년 초 첫 투약을 개시할 계획이다. 비임상시험에서 GC4006A는 기존 상용 백신과 유사한 수준의 항체를 생성하는 체액성 면역 반응뿐 아니라, 바이러스 감염 세포를 공격하는 세포성 면역 반응도 효과적으로 유도한 것으로 확인됐다.녹십자는 mRNA-LNP 플랫폼을 희귀 유전 질환, 만성 염증 질환, 항암 면역 치료제, 백신 등 다양한 파이프라인으로 확대할 예정이다.2025-12-19 09:52:59이탁순 기자
오늘의 TOP 10
- 1HLB그룹, 김태한 전 삼성바이오로직스 대표이사 영입
- 2개미들, 바이오 4.7조 순매수…삼성에피스·알테오젠 집중
- 3제약 CEO 45% "사업 전망 부정적"...약가개편 걸림돌
- 4씨투스 후발주자에 경쟁 과열...한국프라임, 급여 진입
- 5닥터나우 도매금지법, 국회 처리 진퇴양난…원안 유지될까
- 6셀트리온, 4조 매출 안착…합병 후 수익성 정상화
- 7[기자의 눈] 예측불허 약국 환경, 미래 먹거리 필요하다
- 8약국 혈액순환제 선택기준, 답은 '고객의 말'에 있다
- 9바이오시밀러 심사 속도…식약처, 허가 전담부서 신설
- 10GIFT 지정된 PBC 새로운 치료제 '셀라델파'
-
상품명최고최저평균
-
케토톱플라스타(34매)13,00013,00013,000
-
게보린(10정)4,0003,0003,620
-
노스카나겔(20g)22,00018,00020,703
-
베나치오에프액(75ml)1,0008001,000
-
비코그린에스(20정)5,0004,0004,417












![[리쥬올]레티노 멜라세럼 저자극 레티놀](https://cdn.platpharm.co.kr/2025/09/2509260219360000145.webp)
![[위고비] 직거래 최저가](https://cdn.platpharm.co.kr/2025/12/2512020211090000013.webp)
![[리쥬올]리쥬올 PDRN 약국 1위 PDRN](https://cdn.platpharm.co.kr/2025/09/2509260220180000170.webp)
![[SK케미칼] 트라스트패취 피록시캄 성분](https://cdn.platpharm.co.kr/2025/10/2510020656150002375.webp)
![[SK케미칼] 속편한정 복합소화제](https://cdn.platpharm.co.kr/2025/12/2512040916400005920.webp)
![[종근당] 벤포벨에스 어른들의 피로회복제](https://cdn.platpharm.co.kr/2025/07/2507290841210004645.webp)
![[신신] 새사래 상처연고 습윤밴드](https://cdn.platpharm.co.kr/2025/10/2510210339570001784.webp)
![[유한양행] 미녹펜겔 탈모스팟 집중케어](https://cdn.platpharm.co.kr/2025/09/2509220824180004563.webp)
![[유한양행] 콘택콜드 걸렸구나 생각되면](https://cdn.platpharm.co.kr/2025/10/2510282252420008436.webp)
![[신신] 아렉스 두번효과로 강력한](https://cdn.platpharm.co.kr/2025/10/2510230254510000664.webp)
![[더본메디칼] ATC인쇄리본 특가](https://cdn.platpharm.co.kr/2025/04/2504100527360001454.jpg)
![[셀로맥스] 베베락스 온가족 안심 관장약](https://cdn.platpharm.co.kr/2025/09/2509171131320018843.webp)
![[아워팜] 에너지 바로 충전, 바로콤](https://i.baropharm.com/products/202512/1764922282624.png)
![[휴온스 ] 비듬을 한번에, 니조랄 2%액](https://i.baropharm.com/products/478a284d-4361-4b4a-8a00-8bab80f34319.png?label=PLAN_01)
![[레킷코리아] 목 아플 때, 스트렙실 허니&레몬 트로키 12정](https://i.baropharm.com/products/202502/1739520767049.png?label=PLAN_01)
![[한독] 붙이는 통증 전문가, 케토톱 액티브 플라스타(쿨) 40매](https://i.baropharm.com/products/202503/1741829602305.png)
![[아워팜] CJ웰케어, 바이오코어 1000억 유산균](https://i.baropharm.com/products/202512/1765955416559.png)
![[아워팜] 혈행건강 히어로, 혈행건강 초임계 rTG 오메가3 프리미엄](https://i.baropharm.com/products/f724f191-7052-4ad5-bc92-cda889cf13a6.png)
![[아워팜] 건강한 힘, 바로바이오틱스 kids 비피더스 50억](https://i.baropharm.com/products/202511/1763106585375.png)
![[켄뷰] 오리지널 폼타입, 로게인5%폼에어로졸60g](https://i.baropharm.com/products/dc84d96e-d0b4-46bc-bcc8-d62016406fe4.png)
![[아워팜] 아이들이 먼저찾는, 바로타민 kids 미네랄](https://i.baropharm.com/products/202512/1766121243228.png)
![[아워팜] 우리아이 맞춤설계, 바로타민 kids 엘더베리맛](https://i.baropharm.com/products/8eae7689-61be-4b71-9608-05364b05ea12.png)
![[오펠라] 부드럽고 편안한, 둘코락스에스장용정 20정](https://i.baropharm.com/products/202511/1762260404625.png)
![[켄뷰] 다양한 통증에, 타이레놀정 500mg 10정](https://i.baropharm.com/products/6c6ea4f4-7ab2-44f2-a165-f062d80f525b.png)
