총 32건
-
 생존의 문제 '탈모'...급여 시급한 중증 원형탈모치료제[데일리팜=어윤호 기자] 정부가 탈모에 대한 보장상 확대 의지를 보이면서 관련 조치에 관심이 쏠리고 있다.최근 이재명 대통령은 보건복지부 업무 보고에서 탈모가 단순한 미용 문제가 아니라 개인의 삶과 존엄, 나아가 생명과도 연결될 수 있는 질환일 수 있다는 취지의 발언을 했다. 외모와 미용의 이슈로 치부돼 온 탈모 질환을 공중보건의 관점에서 다시 바라봐야 한다는 문제의식이 제기된 것이다.특히 호르몬성이나 노화에 따른 탈모와 달리, 실제 사회적인 생명에 위협을 받고 있는 중증 원형탈모 환자들이 실제로 체감하는 현실은 여전히 냉담하다.중증 원형탈모는 머리카락뿐 아니라 눈썹, 속눈썹, 체모 전반이 소실되는 자가면역 질환으로, 환자들은 외모 변화로 인한 극심한 사회적 낙인과 심리적 어려움을 경험한다. 취업 과정에서의 불이익, 대인관계 단절, 우울·불안 등 정신건강 문제는 흔히 동반된다.국내 허가된 중증 원형탈모치료제로는 '올루미언트(바리시티닙)'가 있다. 하지만 이 약의 보험급여 확대 절차는 장기간 지연되고 있다.올루미언트는 이미 아토피 피부염과 류마티스 관절염 적응증으로 건강보험 급여가 적용 중인 경구용, 가역적, 선택적 JAK억제제이다. 개발사인 릴리는 2024년 9월, 동일한 제품에 대해 소아 아토피피부염, 중증 원형탈모, 소아 특발성 관절염 등 3개 적응증을 동시에 급여 확대 신청했다.문제는 이들 적응증에 대한 급여 검토가 불균형하게 진행됐다는 점이다. 소아 아토피피부염의 경우 급여기준소위원회 논의를 거쳐 복지부 보고 이후 불과 두 달 만에 급여가 확정됐다.반면 중증 원형탈모는 급여기준소위 논의와 복지부 보고까지 마쳤음에도 불구하고, 이후 약 5개월간 아무런 논의나 절차적 진척 없이 계류되고 있는 것으로 보인다. 통상 약제기준부에서 복지부 보고가 이뤄지면 1개월 내 재정영향 검토 명령이 내려오는 것이 일반적인 흐름이라는 점을 감안하면, 이는 매우 이례적이다.특히 중증 원형탈모 적응증은 세 개의 동시 신청 적응증 가운데 가장 긴 지연을 겪었다. 소아 특발성 관절염은 급여 기준 설정 단계에서 비급여 결론이 도출된 반면, 중증 원형탈모는 '검토중' 상태가 장기화되는 모양새다. 동일 제품, 동일 시점 신청이라는 조건에도 불구하고 적응증에 따라 급여 접근성에 극명한 격차가 발생한 셈이다.현 제도에서는 적응증별로 담당자가 분리 배정돼 검토가 이뤄진다. 이로 인해 담당자의 업무량, 검토 순서, 정책적 우선순위 등에 따라 실제 처리 속도가 크게 달라질 수밖에 없다. 같은 치료제라도 '어떤 적응증 담당자에게 배정됐는지'에 따라 환자의 급여 접근 시점이 달라지는 구조다.같은 기전, 같은 성분의 치료제임에도 적응증에 따라 치료 접근성이 사실상 정부 부처의 검토 순서에 따라 달라진다면 환자들의 입장에서는 이해하기 어렵다. 특히 중증 원형탈모처럼 질환 특성상 사회적 고립과 정신적 부담이 큰 경우, 급여 지연은 단순한 행정 문제가 아니라 환자의 삶 전반에 영향을 미치는 문제다.장용현 경북대학교병원 피부과 교수(대한피부과학회 보험이사)는 "원형탈모증은 미용의 문제가 아닌 면역 이상으로 발생하는 자가면역질환으로, 특히 중증 단계에서는 치료 시기를 놓치면 회복이 어려워진다. 임상적으로 효과가 입증된 치료제가 있음에도 비용 부담으로 치료를 시작하지 못하거나, 호전을 보다가도 경제적 이유로 치료를 중단하는 환자들이 적잖다"고 말했다.이어 "중증 원형탈모증 치료는 외모 개선이 아닌 환자의 일상과 정신건강을 지키기 위한 필수 의료로 봐야 한다. 임상적 근거가 충분한 치료제에 대해서는 치료 접근성을 높이기 위한 제도적 논의가 필요하다"고 강조했다.2025-12-18 14:12:41어윤호 기자
생존의 문제 '탈모'...급여 시급한 중증 원형탈모치료제[데일리팜=어윤호 기자] 정부가 탈모에 대한 보장상 확대 의지를 보이면서 관련 조치에 관심이 쏠리고 있다.최근 이재명 대통령은 보건복지부 업무 보고에서 탈모가 단순한 미용 문제가 아니라 개인의 삶과 존엄, 나아가 생명과도 연결될 수 있는 질환일 수 있다는 취지의 발언을 했다. 외모와 미용의 이슈로 치부돼 온 탈모 질환을 공중보건의 관점에서 다시 바라봐야 한다는 문제의식이 제기된 것이다.특히 호르몬성이나 노화에 따른 탈모와 달리, 실제 사회적인 생명에 위협을 받고 있는 중증 원형탈모 환자들이 실제로 체감하는 현실은 여전히 냉담하다.중증 원형탈모는 머리카락뿐 아니라 눈썹, 속눈썹, 체모 전반이 소실되는 자가면역 질환으로, 환자들은 외모 변화로 인한 극심한 사회적 낙인과 심리적 어려움을 경험한다. 취업 과정에서의 불이익, 대인관계 단절, 우울·불안 등 정신건강 문제는 흔히 동반된다.국내 허가된 중증 원형탈모치료제로는 '올루미언트(바리시티닙)'가 있다. 하지만 이 약의 보험급여 확대 절차는 장기간 지연되고 있다.올루미언트는 이미 아토피 피부염과 류마티스 관절염 적응증으로 건강보험 급여가 적용 중인 경구용, 가역적, 선택적 JAK억제제이다. 개발사인 릴리는 2024년 9월, 동일한 제품에 대해 소아 아토피피부염, 중증 원형탈모, 소아 특발성 관절염 등 3개 적응증을 동시에 급여 확대 신청했다.문제는 이들 적응증에 대한 급여 검토가 불균형하게 진행됐다는 점이다. 소아 아토피피부염의 경우 급여기준소위원회 논의를 거쳐 복지부 보고 이후 불과 두 달 만에 급여가 확정됐다.반면 중증 원형탈모는 급여기준소위 논의와 복지부 보고까지 마쳤음에도 불구하고, 이후 약 5개월간 아무런 논의나 절차적 진척 없이 계류되고 있는 것으로 보인다. 통상 약제기준부에서 복지부 보고가 이뤄지면 1개월 내 재정영향 검토 명령이 내려오는 것이 일반적인 흐름이라는 점을 감안하면, 이는 매우 이례적이다.특히 중증 원형탈모 적응증은 세 개의 동시 신청 적응증 가운데 가장 긴 지연을 겪었다. 소아 특발성 관절염은 급여 기준 설정 단계에서 비급여 결론이 도출된 반면, 중증 원형탈모는 '검토중' 상태가 장기화되는 모양새다. 동일 제품, 동일 시점 신청이라는 조건에도 불구하고 적응증에 따라 급여 접근성에 극명한 격차가 발생한 셈이다.현 제도에서는 적응증별로 담당자가 분리 배정돼 검토가 이뤄진다. 이로 인해 담당자의 업무량, 검토 순서, 정책적 우선순위 등에 따라 실제 처리 속도가 크게 달라질 수밖에 없다. 같은 치료제라도 '어떤 적응증 담당자에게 배정됐는지'에 따라 환자의 급여 접근 시점이 달라지는 구조다.같은 기전, 같은 성분의 치료제임에도 적응증에 따라 치료 접근성이 사실상 정부 부처의 검토 순서에 따라 달라진다면 환자들의 입장에서는 이해하기 어렵다. 특히 중증 원형탈모처럼 질환 특성상 사회적 고립과 정신적 부담이 큰 경우, 급여 지연은 단순한 행정 문제가 아니라 환자의 삶 전반에 영향을 미치는 문제다.장용현 경북대학교병원 피부과 교수(대한피부과학회 보험이사)는 "원형탈모증은 미용의 문제가 아닌 면역 이상으로 발생하는 자가면역질환으로, 특히 중증 단계에서는 치료 시기를 놓치면 회복이 어려워진다. 임상적으로 효과가 입증된 치료제가 있음에도 비용 부담으로 치료를 시작하지 못하거나, 호전을 보다가도 경제적 이유로 치료를 중단하는 환자들이 적잖다"고 말했다.이어 "중증 원형탈모증 치료는 외모 개선이 아닌 환자의 일상과 정신건강을 지키기 위한 필수 의료로 봐야 한다. 임상적 근거가 충분한 치료제에 대해서는 치료 접근성을 높이기 위한 제도적 논의가 필요하다"고 강조했다.2025-12-18 14:12:41어윤호 기자 -
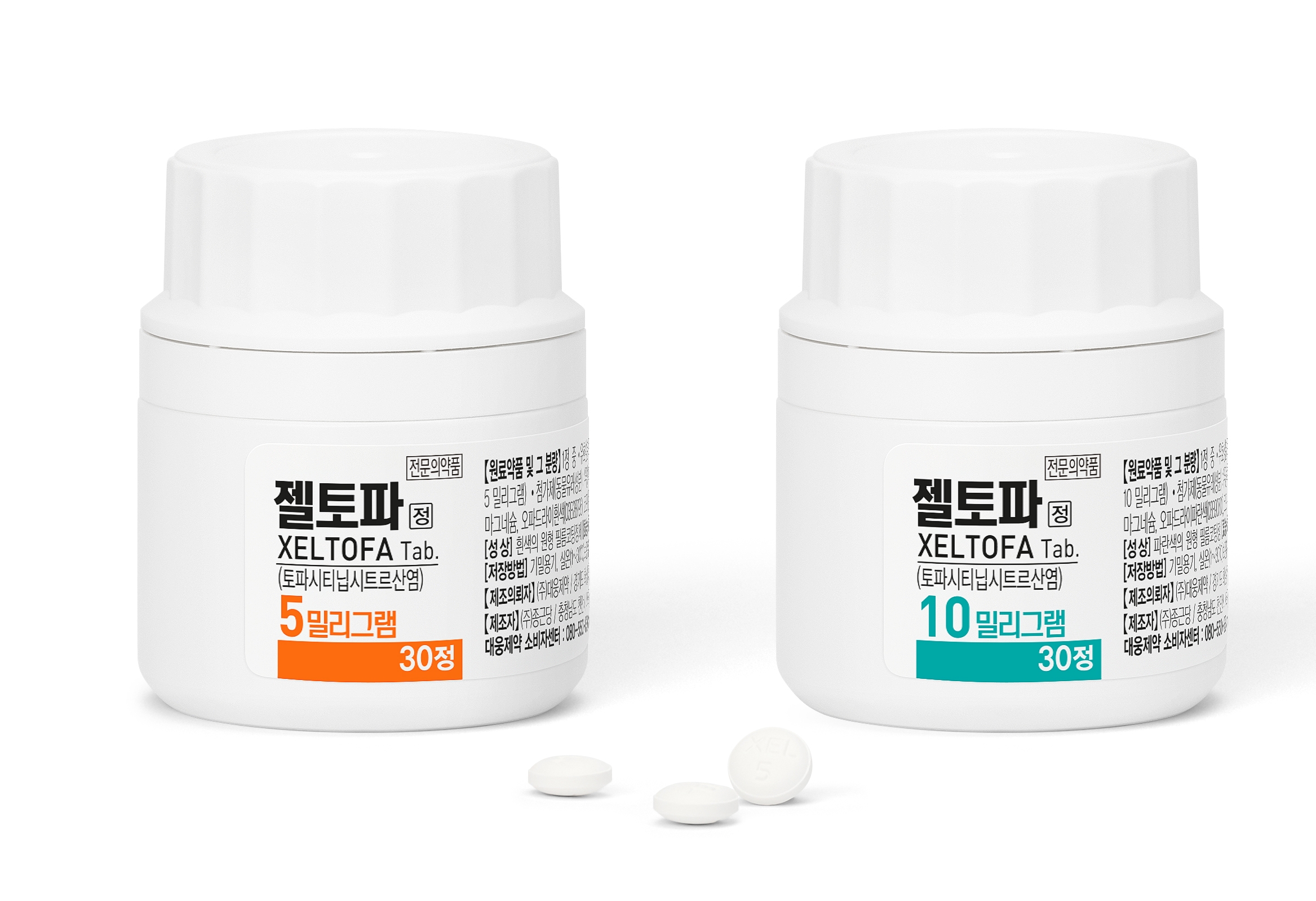 젤잔즈 첫 제네릭 '젤토파' 등장…시장 판도 흔들까대웅제약이 JAK 억제제 계열 자가면역질환 치료제 시장에 퍼스트 제네릭 ‘젤토파’를 출시하며 판 흔들기에 나섰다. 화이자 블록버스터 '젤잔즈' 독점 체제가 처음으로 깨진 만큼, 단기 속도는 더디더라도 중장기적으로는 제네릭 전환 흐름이 가능할 것이라는 분석이 나온다. 젤토파 제품사진대웅제약은 지난 27일 JAK 억제제 계열 자가면역질환 치료제 '젤토파정(이하 젤토파)'를 출시했다.젤토파는 화이자 젤잔즈(토파시티닙)의 퍼스트 제네릭으로 오리지널과 생물학적 동등성을 확보해 동등한 치료 효과와 안전성을 보이고 경제성과 복약 편의성 등을 개선한 것이 특징이다.오리지널 의약품과 동일하게 5·10mg가 동시 출시돼 류마티스관절염(RA), 건선성 관절염(PsA), 강직성 척추염(AS), 궤양성 대장염(UC) 등 모든 적응증을 확보한 풀 라인업을 완성했다.이에 대웅제약은 당장 동일 성분 시장에서 젤잔즈 점유율을 정조준한다는 전략이다.대웅제약이 가장 먼저 내세우는 것은 비용이다. 현재 젤토파의 급여가는 1정 기준 10mg이 8307원, 5mg이 5005원이다. 젤잔즈의 각각 9773원(10mg), 5888원(5mg)와 비교하면 가격 경쟁력이 존재한다.복약 편의성도 차별화 포인트로 내세운다. 젤토파는 부형제 최적화를 통해 정제 크기를 오리지널 대비 최대 15% 줄였다. 회사는 이를 통해 고령 환자나 만성복용 환자들의 복용 부담을 일정 부분 낮출 수 있을 것으로 기대하고 있다.초기 처방 전환은 관망세…중장기 신뢰 구축 필요현장 분위기는 관망세다. 가격 부분은 급여가 적용되는 치료제로 산정특례에 따라 환자부담금이 적다는 점을 고려했을 때 유의미한 차이가 발생하기는 어려울 수 있다는 시각도 있다. A 류마티스내과 전문의는 "산정특례 혜택 등 현재 환자의 부담이 크지 않기 때문에 가격 체감 차이는 크지 않을 수 있다"며 "특히 최근에는 환자들이 생물학적제제나 JAK억제제 등 질환과 치료제에 대한 이해도가 높아 경제적인 부분이 상대적으로 큰 장애물은 아닌 상태다"고 설명했다.젤잔즈 제품사진대표적인 질환인 류마티스관절염 등의 질환 특성상 효과의 동등성을 확인했다고 하더라도 조심스런 접근이 이뤄질 것으로 전망도 있다.여기에 현재 JAK 억제제 계열에는 젤잔즈 외에도 올루미언트(바리시티닙), 린버크(우파다시티닙), 지셀레카(필고티닙) 등 경쟁 약물이 이미 다수 포진해 있다.B 상급종합병원 류마티스내과 교수는 "같은 토파시티닙 성분이기 때문에 안전성에는 큰 문제가 없을 것으로 예측하지만 효과는 좀 더 면밀히 살펴볼 것으로 본다"며 "류마티스 치료제들이 적은 용량에서도 환자 반응의 차이가 있어 임상과 별개로 현장에서는 상황을 관망할 것으로 예상한다"고 밝혔다.이어 "앞서 휴미라의 바이오시밀러가 출시 됐을 때와 같은 유사한 흐름을 보일 것으로 예측한다"며 "타 질환 보다는 제네릭으로 전환되는 속도가 더딜 것으로 본다"고 전했다.임상 현장에 따르면 대웅제약은 이미 젤토파를 중심으로 본격적인 영업·마케팅 활동을 시작한 상태다.A 전문의는 “다국적사 대비 영업 활동이 현장 깊숙이 들어오는 느낌은 있다”면서도 “다만 만성 자가면역질환 영역 특성상 영업·마케팅의 영향력이 단기간 성과로 바로 연결되기보다는, 장기적인 신뢰 구축이 더 중요하다”고 말했다.박형철 대웅제약 ETC마케팅본부장은 “젤토파는 고가 치료제 위주의 JAK 억제제 시장에서 환자들의 경제적 부담을 실질적으로 낮출 수 있는 대안”이라며 “장기복용이 불가피한 자가면역질환 환자들이 보다 안정적으로 치료를 이어갈 수 있는 옵션으로 자리잡도록 최선을 다하겠다”고 밝혔다.업계는 젤토파가 당장 JAK 억제제 시장의 판도를 뒤집지는 못하더라도, 젤잔즈 독점 구도를 흔드는 ‘첫 균열’이라는 점에서 상징적 출발점이 될 것으로 보고 있다. 관건은 대웅제약이 이 균열을 실제 처방 전환으로 얼마나 빠르게 연결시키느냐, 그리고 중장기적 마케팅·임상 데이터 축적을 통해 의료진 신뢰를 얼마나 공고히 하느냐가 될 전망이다.2025-11-29 06:34:37황병우 기자
젤잔즈 첫 제네릭 '젤토파' 등장…시장 판도 흔들까대웅제약이 JAK 억제제 계열 자가면역질환 치료제 시장에 퍼스트 제네릭 ‘젤토파’를 출시하며 판 흔들기에 나섰다. 화이자 블록버스터 '젤잔즈' 독점 체제가 처음으로 깨진 만큼, 단기 속도는 더디더라도 중장기적으로는 제네릭 전환 흐름이 가능할 것이라는 분석이 나온다. 젤토파 제품사진대웅제약은 지난 27일 JAK 억제제 계열 자가면역질환 치료제 '젤토파정(이하 젤토파)'를 출시했다.젤토파는 화이자 젤잔즈(토파시티닙)의 퍼스트 제네릭으로 오리지널과 생물학적 동등성을 확보해 동등한 치료 효과와 안전성을 보이고 경제성과 복약 편의성 등을 개선한 것이 특징이다.오리지널 의약품과 동일하게 5·10mg가 동시 출시돼 류마티스관절염(RA), 건선성 관절염(PsA), 강직성 척추염(AS), 궤양성 대장염(UC) 등 모든 적응증을 확보한 풀 라인업을 완성했다.이에 대웅제약은 당장 동일 성분 시장에서 젤잔즈 점유율을 정조준한다는 전략이다.대웅제약이 가장 먼저 내세우는 것은 비용이다. 현재 젤토파의 급여가는 1정 기준 10mg이 8307원, 5mg이 5005원이다. 젤잔즈의 각각 9773원(10mg), 5888원(5mg)와 비교하면 가격 경쟁력이 존재한다.복약 편의성도 차별화 포인트로 내세운다. 젤토파는 부형제 최적화를 통해 정제 크기를 오리지널 대비 최대 15% 줄였다. 회사는 이를 통해 고령 환자나 만성복용 환자들의 복용 부담을 일정 부분 낮출 수 있을 것으로 기대하고 있다.초기 처방 전환은 관망세…중장기 신뢰 구축 필요현장 분위기는 관망세다. 가격 부분은 급여가 적용되는 치료제로 산정특례에 따라 환자부담금이 적다는 점을 고려했을 때 유의미한 차이가 발생하기는 어려울 수 있다는 시각도 있다. A 류마티스내과 전문의는 "산정특례 혜택 등 현재 환자의 부담이 크지 않기 때문에 가격 체감 차이는 크지 않을 수 있다"며 "특히 최근에는 환자들이 생물학적제제나 JAK억제제 등 질환과 치료제에 대한 이해도가 높아 경제적인 부분이 상대적으로 큰 장애물은 아닌 상태다"고 설명했다.젤잔즈 제품사진대표적인 질환인 류마티스관절염 등의 질환 특성상 효과의 동등성을 확인했다고 하더라도 조심스런 접근이 이뤄질 것으로 전망도 있다.여기에 현재 JAK 억제제 계열에는 젤잔즈 외에도 올루미언트(바리시티닙), 린버크(우파다시티닙), 지셀레카(필고티닙) 등 경쟁 약물이 이미 다수 포진해 있다.B 상급종합병원 류마티스내과 교수는 "같은 토파시티닙 성분이기 때문에 안전성에는 큰 문제가 없을 것으로 예측하지만 효과는 좀 더 면밀히 살펴볼 것으로 본다"며 "류마티스 치료제들이 적은 용량에서도 환자 반응의 차이가 있어 임상과 별개로 현장에서는 상황을 관망할 것으로 예상한다"고 밝혔다.이어 "앞서 휴미라의 바이오시밀러가 출시 됐을 때와 같은 유사한 흐름을 보일 것으로 예측한다"며 "타 질환 보다는 제네릭으로 전환되는 속도가 더딜 것으로 본다"고 전했다.임상 현장에 따르면 대웅제약은 이미 젤토파를 중심으로 본격적인 영업·마케팅 활동을 시작한 상태다.A 전문의는 “다국적사 대비 영업 활동이 현장 깊숙이 들어오는 느낌은 있다”면서도 “다만 만성 자가면역질환 영역 특성상 영업·마케팅의 영향력이 단기간 성과로 바로 연결되기보다는, 장기적인 신뢰 구축이 더 중요하다”고 말했다.박형철 대웅제약 ETC마케팅본부장은 “젤토파는 고가 치료제 위주의 JAK 억제제 시장에서 환자들의 경제적 부담을 실질적으로 낮출 수 있는 대안”이라며 “장기복용이 불가피한 자가면역질환 환자들이 보다 안정적으로 치료를 이어갈 수 있는 옵션으로 자리잡도록 최선을 다하겠다”고 밝혔다.업계는 젤토파가 당장 JAK 억제제 시장의 판도를 뒤집지는 못하더라도, 젤잔즈 독점 구도를 흔드는 ‘첫 균열’이라는 점에서 상징적 출발점이 될 것으로 보고 있다. 관건은 대웅제약이 이 균열을 실제 처방 전환으로 얼마나 빠르게 연결시키느냐, 그리고 중장기적 마케팅·임상 데이터 축적을 통해 의료진 신뢰를 얼마나 공고히 하느냐가 될 전망이다.2025-11-29 06:34:37황병우 기자 -
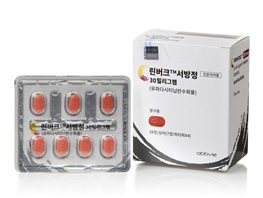 종근당에 대웅도 가세...'린버크' 제네릭 특허전 가열린버크 제품사진 [데일리팜=김진구 기자] 경구용 자가면역질환 치료제 ‘린버크(유파다시티닙)’ 제네릭 조기 발매를 위한 특허분쟁이 확산할 조짐이다. JAK 억제제 시장이 급성장 중인 데다 린버크가 독주 체제를 강화하고 있다는 점에서 여러 업체가 특허 도전에 나설 것이란 전망이 나온다.1일 제약업계에 따르면 대웅제약은 최근 애브비를 상대로 린버크 결정형특허에 소극적 권리범위확인 심판을 청구했다.현재 린버크 관련 특허는 2개가 등재돼 있다. 2032년 5월 만료되는 물질특허와 2036년 10월 만료되는 결정형특허다. 이 가운데 결정형특허를 우선 회피한 뒤, 물질특허 만료 시점에 맞춰 제네릭을 조기에 발매하겠다는 게 대웅제약의 구상이다.대웅제약에 앞서 종근당이 린버크 특허에 도전장을 내며 이번 분쟁의 포문을 열었다. 종근당은 지난달 19일 관련 심판을 청구했다. 제약업계에선 두 회사에 이어 린버크 특허에 도전하는 업체가 더욱 늘어날 것이란 전망이 제기다.우선판매품목허가(우판권)를 받기 위한 요건 중 하나는 ‘최초 심판 청구’다. 단, 처음으로 심판이 청구된 날로부터 영업일 기준 14일 이내에 동일한 심판을 청구할 경우, 해당 업체도 이 요건을 충족한 것으로 간주된다. 린버크 제네릭 우판권을 확보하기 위해 남은 기간 동안 심판 청구가 이어질 것으로 예상되는 배경이다.의약품 시장조사기관 유비스트에 따르면 올해 상반기 JAK 억제제의 원외처방 규모는 386억원이다. 작년 상반기 275억원 대비 1년 새 40% 증가했다.JAK 억제제는 자가면역질환 치료제 시장에서 경구용 제제라는 편의성을 앞세워 급성장 중이다. 2020년 187억원이던 JAK 억제제 시장은 이듬해 255억원으로 36% 늘었다. 이어 2022년 355억원, 2023년 400억원, 2024년 622억원 등으로 매년 큰 폭의 성장을 반복했다. 주요 제품의 급여 확대가 시장 성장을 이끌었다. 작년 10월엔 류마티스관절염에서 JAK억제제 간 교체 투여가 급여로 인정되면서 성장 속도가 더욱 가팔라졌다. 시장이 확대되는 동안 린버크는 독주 체제를 더욱 강화하고 있다. 올해 상반기 린버크의 처방액은 167억원으로, 작년 상반기 112억원 대비 49% 증가했다. 젤잔즈(토파시티닙)·올루미언트(바리시티닙) 등 경쟁 제품 대비 성장세가 가파르다. 2023년 4분기 시장 1위로 올라선 뒤 점유율을 더욱 확대하고 있다. 올해 상반기 린버크의 점유율은 43%에 달한다.린버크는 류마티스 관절염과 아토피 피부염 등 자가면역질환에 쓰이는 JAK 억제제 계열 약물이다. 염증성 사이토카인을 억제해 염증과 통증, 세포 활성화를 차단하는 기전이다.2025-09-01 12:00:16김진구
종근당에 대웅도 가세...'린버크' 제네릭 특허전 가열린버크 제품사진 [데일리팜=김진구 기자] 경구용 자가면역질환 치료제 ‘린버크(유파다시티닙)’ 제네릭 조기 발매를 위한 특허분쟁이 확산할 조짐이다. JAK 억제제 시장이 급성장 중인 데다 린버크가 독주 체제를 강화하고 있다는 점에서 여러 업체가 특허 도전에 나설 것이란 전망이 나온다.1일 제약업계에 따르면 대웅제약은 최근 애브비를 상대로 린버크 결정형특허에 소극적 권리범위확인 심판을 청구했다.현재 린버크 관련 특허는 2개가 등재돼 있다. 2032년 5월 만료되는 물질특허와 2036년 10월 만료되는 결정형특허다. 이 가운데 결정형특허를 우선 회피한 뒤, 물질특허 만료 시점에 맞춰 제네릭을 조기에 발매하겠다는 게 대웅제약의 구상이다.대웅제약에 앞서 종근당이 린버크 특허에 도전장을 내며 이번 분쟁의 포문을 열었다. 종근당은 지난달 19일 관련 심판을 청구했다. 제약업계에선 두 회사에 이어 린버크 특허에 도전하는 업체가 더욱 늘어날 것이란 전망이 제기다.우선판매품목허가(우판권)를 받기 위한 요건 중 하나는 ‘최초 심판 청구’다. 단, 처음으로 심판이 청구된 날로부터 영업일 기준 14일 이내에 동일한 심판을 청구할 경우, 해당 업체도 이 요건을 충족한 것으로 간주된다. 린버크 제네릭 우판권을 확보하기 위해 남은 기간 동안 심판 청구가 이어질 것으로 예상되는 배경이다.의약품 시장조사기관 유비스트에 따르면 올해 상반기 JAK 억제제의 원외처방 규모는 386억원이다. 작년 상반기 275억원 대비 1년 새 40% 증가했다.JAK 억제제는 자가면역질환 치료제 시장에서 경구용 제제라는 편의성을 앞세워 급성장 중이다. 2020년 187억원이던 JAK 억제제 시장은 이듬해 255억원으로 36% 늘었다. 이어 2022년 355억원, 2023년 400억원, 2024년 622억원 등으로 매년 큰 폭의 성장을 반복했다. 주요 제품의 급여 확대가 시장 성장을 이끌었다. 작년 10월엔 류마티스관절염에서 JAK억제제 간 교체 투여가 급여로 인정되면서 성장 속도가 더욱 가팔라졌다. 시장이 확대되는 동안 린버크는 독주 체제를 더욱 강화하고 있다. 올해 상반기 린버크의 처방액은 167억원으로, 작년 상반기 112억원 대비 49% 증가했다. 젤잔즈(토파시티닙)·올루미언트(바리시티닙) 등 경쟁 제품 대비 성장세가 가파르다. 2023년 4분기 시장 1위로 올라선 뒤 점유율을 더욱 확대하고 있다. 올해 상반기 린버크의 점유율은 43%에 달한다.린버크는 류마티스 관절염과 아토피 피부염 등 자가면역질환에 쓰이는 JAK 억제제 계열 약물이다. 염증성 사이토카인을 억제해 염증과 통증, 세포 활성화를 차단하는 기전이다.2025-09-01 12:00:16김진구 -
 린버크, 원형탈모증 경쟁 합류…JAK 억제제 3파전 예고[데일리팜=황병우 기자] 애브비의 JAK 억제제 린버크(유파다시티닙)가 원형탈모증 임상에 성공하면서 본격적인 시장 경쟁 참전이 예상된다.린버크 제품사진애브비는 최근 성인과 청소년 중증 원형탈모 환자를 대상으로 한 린버크의 주요 3상 임상(UP-AA 프로그램) 2번 연구에서 긍정적인 톱라인 결과를 발표했다.이 시험에서 린버크는 24주 차에 두피 모발의 80% 이상 재성장을 달성한 환자 비율(주 평가변수)을 위약 대비 유의하게 높이며 1차 목표를 충족시켰다.이번 결과로 린버크는 원형탈모 치료제 시장에 합류할 강력한 후보로 부상했다. 구체적으로 린버크 15mg 투여군의 44.6%, 30mg 투여군의 54.3%가 24주 시점에 두피의 80% 이상 모발이 재생(SALT 점수 ≤20)된 반면 위약군은 3.4%에 그쳤다.또 눈썹·속눈썹의 발모 개선과 두피 모발 90% 이상 재성장(SALT ≤10), 완전 두피 모발 재성장(SALT=0) 달성률 등의 주요 2차 지표들도 두 용량 린버크 군에서 모두 충족됐다.안전성 프로파일 역시 기존 린버크 적응증에서 관찰된 내용과 대체로 일치했으며, 새로운 위험 신호는 확인되지 않았다.아라쉬 모스타히미 하버드 의과대학 브리검 앤드 위민스 병원의 피부과 교수는 "원형탈모 환자가 겪는 갑작스럽고 종종 예측할 수 없는 탈모는 환자들의 자존감과 정신건강에 심각한 영향을 준다"며 "두피와 두피 이외 부위의 모발 재생을 돕는 더 많은 치료법이 절실히 필요하다. 유파다시티닙이 중요한 새로운 치료 옵션이 될 가능성을 보여주는 이번 결과는 매우 고무적"이라고 평가했다.또 애브비 면역사업부 임상개발 글로벌팀 수장인 코리 월래스 부회장은 "UP-AA는 SALT=0과 같은 높은 목표를 수립하고 달성한 최초의 주요 임상연구로, 이번 연구 결과는 면역 매개 질환 환자들의 삶을 개선하기 위한 잠재력을 지닌 새로운 치료법을 발전시키기 위한 애브비의 노력을 보여준다"고 말했다.애브비는 이번 결과를 바탕으로 글로벌 허가 절차에 착수할 예정이다. 이번에 발표된 임상에는 한국 환자도 포함된 것으로 알려져 향후 신속한 허가 절차가 진행될 것으로 예측된다.3번째 원형탈모 치료제 등장 예고, 경쟁 점화 예상린버크가 시판 허가를 받을 경우, 국내 원형탈모 치료제 시장에는 세 번째 JAK 억제제가 등장하게 된다.현재 국내에는 한국릴리의 올루미언트(바리시티닙)와 한국화이자의 리트풀로(리틀레시티닙)’ 등 2개 경구용 JAK 억제제가 중증 원형탈모증 치료에 사용할 수 있다.올루미언트의 경우 2023년 3월 식품의약품안전처 승인을 받아 국내 첫 성인 중증 원형탈모 치료제로 자리매김했다.이 약은 BRAVE-AA 임상 결과를 기반으로 허가받았으며, 4mg 용량 투여 시 36주 차에 약 38.8%의 환자가 두피 모발 80% 이상 재성장을 이뤄내 위약군(6.2%) 대비 우월한 효과를 입증한 바 있다.또 리트풀로는 12세 이상 청소년까지 투여 적응증을 획득한 최초의 원형탈모 치료제로, 2024년 9월 식약처 승인을 거쳐 올해 3월 국내에 출시됐다.기전 측면에서 올루미언트는 JAK1과 JAK2를 동시에 억제하는 반면, 리트풀로는 JAK3와 TEC 계열 키나아제에 선택적으로 작용하는 약물이다.현재 임상현장은 두 치료제와 관련해 직접 비교가 어려운 만큼 충분한 치료 데이터의 축적이 필요하다는 게 공통적인 견해다.다만 성인의 경우 빠른 모발 재성장을 원하면 올루미언트를, 감염 등 안전성을 더 중시하면 리트풀로를 고려할 수 있다는 의견도 존재한다.특히 올루미언트와 비교해 리트풀로는 국내 출시 후 처방 경험이 쌓이는 단계로, 실제 환자군에서의 유효성·안전성 프로파일을 좀 더 지켜봐야 할 것으로 보인다.(왼쪽부터)리트풀로, 올루미언트 제품사진 이러한 가운데 후발주자 린버크는 강력한 3상 데이터를 앞세워 시장 경쟁에 가세할 전망이다.린버크는 JAK1 선택적 억제제로서 기존 약제들과 표적 범위가 다르고, 앞선 아토피 등 면역질환 적응증에서 입증된 효과와 누적된 안전성 데이터가 있다는 점에서 어필할 것으로 보인다.특히 이번 임상에서 확인된 24주차 환자 절반 안팎의 높은 응답률은 단기간 효능 측면에서 경쟁약 대비 두드러진 강점이 될 것으로 전망된다.또 린버크 글로벌 임상에 청소년 환자가 포함되어 있어, 향후 승인을 받으면 리트풀로와 같이 만 12세 이상으로 적응증을 확보할 가능성이 높다.결국 성인 환자에 국한됐던 올루미언트와의 경쟁에서는 더 넓은 환자군 그리고 리트풀로와의 경쟁에서는 앞서 아토피 등 다양한 적응증에서 쌓아온 경험이 차별화 포인트가 될 수 있다는 의미다.애브비는 이미 피부과 영역에서 아토피 치료제로 린버크를 성공적으로 안착시킨 바 있어, 동일 처방군인 피부과 의료진에게 원형탈모 적응증을 효과적으로 확산시킬 것이라는 관측도 있다.치료 접근성 측면에서는 허가된 치료제가 없었던 원형탈모증 분야에 올루미언트와 리트풀로가 연이어 등장하며 치료 패러다임의 전환점을 마련했고, 여기에 린버크까지 가세하면 치료 옵션 선택의 폭이 한층 넓어질 전망이다.다만 원형탈모증이 현재 건강보험 급여를 받지 못해 비급여 영역으로 남아있는 점은 시장확장의 걸림돌이 될 것으로 보인다.2025-08-02 06:00:08황병우
린버크, 원형탈모증 경쟁 합류…JAK 억제제 3파전 예고[데일리팜=황병우 기자] 애브비의 JAK 억제제 린버크(유파다시티닙)가 원형탈모증 임상에 성공하면서 본격적인 시장 경쟁 참전이 예상된다.린버크 제품사진애브비는 최근 성인과 청소년 중증 원형탈모 환자를 대상으로 한 린버크의 주요 3상 임상(UP-AA 프로그램) 2번 연구에서 긍정적인 톱라인 결과를 발표했다.이 시험에서 린버크는 24주 차에 두피 모발의 80% 이상 재성장을 달성한 환자 비율(주 평가변수)을 위약 대비 유의하게 높이며 1차 목표를 충족시켰다.이번 결과로 린버크는 원형탈모 치료제 시장에 합류할 강력한 후보로 부상했다. 구체적으로 린버크 15mg 투여군의 44.6%, 30mg 투여군의 54.3%가 24주 시점에 두피의 80% 이상 모발이 재생(SALT 점수 ≤20)된 반면 위약군은 3.4%에 그쳤다.또 눈썹·속눈썹의 발모 개선과 두피 모발 90% 이상 재성장(SALT ≤10), 완전 두피 모발 재성장(SALT=0) 달성률 등의 주요 2차 지표들도 두 용량 린버크 군에서 모두 충족됐다.안전성 프로파일 역시 기존 린버크 적응증에서 관찰된 내용과 대체로 일치했으며, 새로운 위험 신호는 확인되지 않았다.아라쉬 모스타히미 하버드 의과대학 브리검 앤드 위민스 병원의 피부과 교수는 "원형탈모 환자가 겪는 갑작스럽고 종종 예측할 수 없는 탈모는 환자들의 자존감과 정신건강에 심각한 영향을 준다"며 "두피와 두피 이외 부위의 모발 재생을 돕는 더 많은 치료법이 절실히 필요하다. 유파다시티닙이 중요한 새로운 치료 옵션이 될 가능성을 보여주는 이번 결과는 매우 고무적"이라고 평가했다.또 애브비 면역사업부 임상개발 글로벌팀 수장인 코리 월래스 부회장은 "UP-AA는 SALT=0과 같은 높은 목표를 수립하고 달성한 최초의 주요 임상연구로, 이번 연구 결과는 면역 매개 질환 환자들의 삶을 개선하기 위한 잠재력을 지닌 새로운 치료법을 발전시키기 위한 애브비의 노력을 보여준다"고 말했다.애브비는 이번 결과를 바탕으로 글로벌 허가 절차에 착수할 예정이다. 이번에 발표된 임상에는 한국 환자도 포함된 것으로 알려져 향후 신속한 허가 절차가 진행될 것으로 예측된다.3번째 원형탈모 치료제 등장 예고, 경쟁 점화 예상린버크가 시판 허가를 받을 경우, 국내 원형탈모 치료제 시장에는 세 번째 JAK 억제제가 등장하게 된다.현재 국내에는 한국릴리의 올루미언트(바리시티닙)와 한국화이자의 리트풀로(리틀레시티닙)’ 등 2개 경구용 JAK 억제제가 중증 원형탈모증 치료에 사용할 수 있다.올루미언트의 경우 2023년 3월 식품의약품안전처 승인을 받아 국내 첫 성인 중증 원형탈모 치료제로 자리매김했다.이 약은 BRAVE-AA 임상 결과를 기반으로 허가받았으며, 4mg 용량 투여 시 36주 차에 약 38.8%의 환자가 두피 모발 80% 이상 재성장을 이뤄내 위약군(6.2%) 대비 우월한 효과를 입증한 바 있다.또 리트풀로는 12세 이상 청소년까지 투여 적응증을 획득한 최초의 원형탈모 치료제로, 2024년 9월 식약처 승인을 거쳐 올해 3월 국내에 출시됐다.기전 측면에서 올루미언트는 JAK1과 JAK2를 동시에 억제하는 반면, 리트풀로는 JAK3와 TEC 계열 키나아제에 선택적으로 작용하는 약물이다.현재 임상현장은 두 치료제와 관련해 직접 비교가 어려운 만큼 충분한 치료 데이터의 축적이 필요하다는 게 공통적인 견해다.다만 성인의 경우 빠른 모발 재성장을 원하면 올루미언트를, 감염 등 안전성을 더 중시하면 리트풀로를 고려할 수 있다는 의견도 존재한다.특히 올루미언트와 비교해 리트풀로는 국내 출시 후 처방 경험이 쌓이는 단계로, 실제 환자군에서의 유효성·안전성 프로파일을 좀 더 지켜봐야 할 것으로 보인다.(왼쪽부터)리트풀로, 올루미언트 제품사진 이러한 가운데 후발주자 린버크는 강력한 3상 데이터를 앞세워 시장 경쟁에 가세할 전망이다.린버크는 JAK1 선택적 억제제로서 기존 약제들과 표적 범위가 다르고, 앞선 아토피 등 면역질환 적응증에서 입증된 효과와 누적된 안전성 데이터가 있다는 점에서 어필할 것으로 보인다.특히 이번 임상에서 확인된 24주차 환자 절반 안팎의 높은 응답률은 단기간 효능 측면에서 경쟁약 대비 두드러진 강점이 될 것으로 전망된다.또 린버크 글로벌 임상에 청소년 환자가 포함되어 있어, 향후 승인을 받으면 리트풀로와 같이 만 12세 이상으로 적응증을 확보할 가능성이 높다.결국 성인 환자에 국한됐던 올루미언트와의 경쟁에서는 더 넓은 환자군 그리고 리트풀로와의 경쟁에서는 앞서 아토피 등 다양한 적응증에서 쌓아온 경험이 차별화 포인트가 될 수 있다는 의미다.애브비는 이미 피부과 영역에서 아토피 치료제로 린버크를 성공적으로 안착시킨 바 있어, 동일 처방군인 피부과 의료진에게 원형탈모 적응증을 효과적으로 확산시킬 것이라는 관측도 있다.치료 접근성 측면에서는 허가된 치료제가 없었던 원형탈모증 분야에 올루미언트와 리트풀로가 연이어 등장하며 치료 패러다임의 전환점을 마련했고, 여기에 린버크까지 가세하면 치료 옵션 선택의 폭이 한층 넓어질 전망이다.다만 원형탈모증이 현재 건강보험 급여를 받지 못해 비급여 영역으로 남아있는 점은 시장확장의 걸림돌이 될 것으로 보인다.2025-08-02 06:00:08황병우 -
 올루미언트, 소아 아토피…자디앙, 신장병 급여 확대릴리 [데일리팜=이탁순 기자] 릴리 올루미언트정이 소아 중증 아토피피부염에도 급여가 적용된다.또한 베링거인겔하임 자디앙정은 만성 신장병에도 급여가 적용돼 사용범위가 확대된다.복지부는 18일 이같은 요양급여의 적용기준 및 방법에 관한 세부사항(약제) 일부 개정고시안을 행정예고했다. 시행일은 8월 1일 부터다.류마티스 관절염과 중증 아토피피부염에 사용되는 바리시티닙 제제는 릴리 올루미언트정이 대표적이다.이번에 바리시티닙 경구제는 교과서, 가이드라인, 임상 연구문헌, 전문가 의견 등을 고려해 소아 중증 아토피 피부염에도 급여기준이 확대된다.정확히 급여가 적용되는 소아 환자는 1년 이상 증상이 지속되는 만 6세부터 만 11세 까지이다.SGLT-2 억제 계열 당뇨병치료제 자디앙정10mg(엠파글리플로진)은 비당뇨성 만성신장병 환자에 급여가 확대된다. 앞서 또다른 SGLT-2 억제제 다파글리플로진은 이번달부터 만성신장병 환자에 급여가 확대된 바 있다.복지부는 자디앙정10mg이 사용량-약가 연동제와 이번 사용범위 확대로 중복 인하가 예정됨에 따라 약가 조정 시기를 8월로 연기한 바 있다.시신경척수염 범주질환 치료제 엔스프링프리필드시린지주(사트랄리주맙, 로슈)의 급여조건도 완화된다.기존에는 '최근 2년 이내 적어도 2번(최근 1년 이내 1번 포함)의 증상 재발이 경우'에서 '최근 1년 이내 적어도 1번의 증상 재발 있는 경우'로 조건을 완화했다.보건당국은 교과서, 가이드라인, 임상논문, 학회 의견, 제외국 평가결과 등을 참조해 투여대상의 재발기준을 완화했다고 밝혔다.루푸스 치료제 벤리스타주(벨리무맙, GSK)는 최대 투약기간이 최대 36개월에서 최대 84개월로 연장됐다. 임상진료지침, 임상연구문헌 등을 참고한 결과다.이와함께 파브리병 치료제 갈라폴드캡슐(미갈라스타트, 한독)은 45kg 이상의 12세 이상 청소년 환자에 급여를 확대하고, 효소 대체요법 선행조건을 삭제했다.2025-07-18 11:53:23이탁순
올루미언트, 소아 아토피…자디앙, 신장병 급여 확대릴리 [데일리팜=이탁순 기자] 릴리 올루미언트정이 소아 중증 아토피피부염에도 급여가 적용된다.또한 베링거인겔하임 자디앙정은 만성 신장병에도 급여가 적용돼 사용범위가 확대된다.복지부는 18일 이같은 요양급여의 적용기준 및 방법에 관한 세부사항(약제) 일부 개정고시안을 행정예고했다. 시행일은 8월 1일 부터다.류마티스 관절염과 중증 아토피피부염에 사용되는 바리시티닙 제제는 릴리 올루미언트정이 대표적이다.이번에 바리시티닙 경구제는 교과서, 가이드라인, 임상 연구문헌, 전문가 의견 등을 고려해 소아 중증 아토피 피부염에도 급여기준이 확대된다.정확히 급여가 적용되는 소아 환자는 1년 이상 증상이 지속되는 만 6세부터 만 11세 까지이다.SGLT-2 억제 계열 당뇨병치료제 자디앙정10mg(엠파글리플로진)은 비당뇨성 만성신장병 환자에 급여가 확대된다. 앞서 또다른 SGLT-2 억제제 다파글리플로진은 이번달부터 만성신장병 환자에 급여가 확대된 바 있다.복지부는 자디앙정10mg이 사용량-약가 연동제와 이번 사용범위 확대로 중복 인하가 예정됨에 따라 약가 조정 시기를 8월로 연기한 바 있다.시신경척수염 범주질환 치료제 엔스프링프리필드시린지주(사트랄리주맙, 로슈)의 급여조건도 완화된다.기존에는 '최근 2년 이내 적어도 2번(최근 1년 이내 1번 포함)의 증상 재발이 경우'에서 '최근 1년 이내 적어도 1번의 증상 재발 있는 경우'로 조건을 완화했다.보건당국은 교과서, 가이드라인, 임상논문, 학회 의견, 제외국 평가결과 등을 참조해 투여대상의 재발기준을 완화했다고 밝혔다.루푸스 치료제 벤리스타주(벨리무맙, GSK)는 최대 투약기간이 최대 36개월에서 최대 84개월로 연장됐다. 임상진료지침, 임상연구문헌 등을 참고한 결과다.이와함께 파브리병 치료제 갈라폴드캡슐(미갈라스타트, 한독)은 45kg 이상의 12세 이상 청소년 환자에 급여를 확대하고, 효소 대체요법 선행조건을 삭제했다.2025-07-18 11:53:23이탁순 -
 1천억 자디앙 제네릭 경쟁 예고…젤잔즈·씨투스도 대기[데일리팜=김진구 기자] 연 1000억원 규모의 당뇨병 치료제 ‘자디앙(엠파글리플로진)’ 물질특허가 오는 10월 만료된다.SGLT-2 억제제 계열 당뇨약 시장에서 제네릭 경쟁이 다시 한 번 치열하게 전개될 전망이다. 관련 제네릭을 허가받은 업체만 50여 곳에 이른다.11월엔 화이자의 경구용 자가면역질환 치료제 '젤잔즈(토파시티닙)'의 물질특허 만료가 이어진다. 야누스키나제(JAK) 억제제 계열 약물로는 첫 제네릭 발매가 예상된다. 연 150억원 규모의 시장에 60여개 제네릭이 출격 대기 중이다.천식·알레르기비염 치료제 '씨투스(프란루카스트)' 제네릭의 우선판매 기간은 10월 만료된다. 앞서 우선판매품목허가를 받지 못한 후발의약품의 시장 진입이 예상된다.10월 ‘자디앙 제네릭’ 대거 출격 예고…변수는 ‘미등재 특허’30일 식품의약품안전처에 따르면 베링거인겔하임 자디앙의 물질특허가 오는 10월 23일 만료된다.제약업계에선 특허 만료 시점에 맞춰 제네릭이 대거 발매될 것이란 전망이 나온다. 제네릭사들은 베링거인겔하임과의 특허 분쟁에서 물질특허를 제외한 나머지 등재 특허를 회피하는 데 성공한 상태다.현재 49개 업체가 333개의 엠파글리플로진 기반 단일제·복합제 품목허가를 받아둔 상태다. 자디앙 제네릭은 48개 제네릭사가 100개 품목을, 자디앙듀오(엠파글리플로진+메트포르민) 제네릭은 36개사가 213개 품목을 각각 허가받았다. 에스글리토(엠파글리플로진+리나글립틴) 제네릭은 5개사 10개 품목이 허가됐다.오리지널엔 없는 성분·조합의 제품도 출격 대기 중이다. 종근당과 대원제약은 엠파글리플로진+시타글립틴 조합의 후발약 4개 품목을, 엠파글리플로진+시타글립틴+메트포르민 조합의 후발약 6개 품목을 각각 허가받았다. 당뇨약 시장에서 치열한 제네릭 경쟁이 재현될 것으로 예상된다. 제네릭들은 연 1000억원 이상으로 성장한 엠파글리플로진 시장 진입을 예고한 상태다.의약품 시장조사기관 유비스트에 따르면 자디앙과 자디앙듀오의 지난해 처방실적은 1082억원이다. 2023년 975억원 대비 11% 증가했다.동일 계열 제품인 '포시가(다파글리플로진)'의 공백이 자디앙의 상승세에 적잖은 영향을 끼친 것으로 분석된다. 아스트라제네카는 2023년 말 포시가의 한국시장 철수를 결정한 바 있다. 단 메트포르민 복합제인 직듀오는 남겼다. 포시가는 작년 중순까지 국내 공급됐다.연 500억원 규모의 포시가 공백의 상당 부분은 대부분 자디앙이 차지했다. 자디앙의 처방실적은 2023년 4분기 150억원에서 작년 4분기 182억원으로 1년 새 22% 증가했다. 올해 1분기엔 190억원으로 더욱 늘었다.여기에 메트포르민 복합제인 자디앙듀오도 꾸준한 상승세다. 올해 1분기엔 전년동기 대비 10% 증가한 108억원의 처방실적을 올렸다. 자디앙과 자디앙듀오가 연 1000억원의 처방실적을 합산한다는 점에서 제네릭의 도전이 거셀 것으로 전망된다. 변수는 '미등재 특허'다. 한국베링거인겔하임은 특허청엔 등록됐지만, 식약처 특허목록집엔 등재되지 않은 자디앙·자디앙듀오·에스글리토 관련 특허 9개 이상을 보유하고 있다. 등재 특허가 아니기 때문에 제품 허가엔 문제가 없지만, 발매의 경우 특허침해 우려가 있다.한국베링거인겔하임은 특허권을 강력하게 행사한다는 방침이다. 이미 지난해 트라젠타(리나글립틴) 물질특허 만료 사례에서 한국베링거인겔하임은 제네릭사들에게 내용증명을 보내는 등 적극적으로 특허침해에 대해 경고한 바 있다.이에 제네릭사들은 자디앙 미등재특허의 회피·무효화에 도전하고 있다. 업계에선 상당수 제네릭사가 물질특허 만료 후 제네릭 발매를 강행할 것이란 전망이 나온다. 이미 트라젠타 물질특허 만료 때도 많은 제네릭사가 특허침해 리스크를 안은 채 제품 발매를 강행한 바 있기 때문이다.11월 22일엔 화이자 젤잔즈의 특허가 만료된다. 경구용 자가면역질환 치료제 가운데 첫 특허 만료로 관심을 모은다. 55개 업체가 63개 제네릭 품목허가를 받은 상태다. 이들은 연 144억원 규모의 젤잔즈 시장에 도전한다.나아가 젤잔즈를 포함한 다른 JAK 억제제 계열 오리지널 약물과의 경쟁도 예상된다. 국내에 JAK 억제제로는 젤잔즈를 비롯해 린버크(유파타시티닙)·올루미언트(바리시티닙)·지셀레카(필고티닙) 등이 발매됐다. 이들의 작년 처방액은 622억원으로, 전년대비 56% 증가했다.연 460억 ‘씨투스’ 우판기간 10월 만료…제네릭 추가 진입 전망오는 10월 1일엔 씨투스 제네릭의 우판기간이 만료된다. 이 시점에 맞춰 우판권을 받지 못한 제네릭의 발매가 가능해진다.앞서 제네릭사들은 삼아제약을 상대로 씨투스 제제특허에 소극적 권리범위확인 심판을 청구한 바 있다. 이어 지난해 10월 특허심판원으로부터 청구 성립 심결을 받았다. 삼아제약의 항소 없이 이 심결은 확정됐다.1심 승리를 근거로 특허도전 업체들은 제네릭을 잇달아 허가받았다. 이 가운데 다산제약 ‘프리투스’와 동국제약 ‘프란피드’, 녹십자 ‘네오프란’. 대웅바이오 ‘씨투원’이 우판권을 받았다. 우판기간은 작년 11월부터 올해 10월까지다.이때 우판권을 받지 못한 제네릭사들은 10월 이후 제품을 발매할 수 있다. 한화제약과 동구바이오제약의 제네릭 후발의약품 발매가 예상된다. 이들은 삼아제약을 상대로 한 특허분쟁에서 승리한 바 있다. 한화제약의 경우 ‘씨투리엔’이란 이름으로 제네릭 품목허가까지 받아둔 상태다.씨투스가 연 460억원 규모의 처방실적을 올리고 있는 데다, 먼저 발매된 씨투스 제네릭들이 천식·알레르기비염 치료제 시장에서 제대로 자리를 잡지 못했다는 점에서 1년여 늦게 출격하는 후발의약품에도 충분히 경쟁력이 있다는 분석이 나온다.올해 1분기 씨투스 제네릭은 6억원의 처방실적을 합작하는 데 그쳤다. 전체 프란루카스트 시장에서의 점유율은 5% 수준이다. 반면 오리지널 씨투스는 올해 1분기 114억원으로 전년동기 대비 소폭 증가했다.대형품목 제네릭 시장 열린다2025-06-30 12:15:21김진구
1천억 자디앙 제네릭 경쟁 예고…젤잔즈·씨투스도 대기[데일리팜=김진구 기자] 연 1000억원 규모의 당뇨병 치료제 ‘자디앙(엠파글리플로진)’ 물질특허가 오는 10월 만료된다.SGLT-2 억제제 계열 당뇨약 시장에서 제네릭 경쟁이 다시 한 번 치열하게 전개될 전망이다. 관련 제네릭을 허가받은 업체만 50여 곳에 이른다.11월엔 화이자의 경구용 자가면역질환 치료제 '젤잔즈(토파시티닙)'의 물질특허 만료가 이어진다. 야누스키나제(JAK) 억제제 계열 약물로는 첫 제네릭 발매가 예상된다. 연 150억원 규모의 시장에 60여개 제네릭이 출격 대기 중이다.천식·알레르기비염 치료제 '씨투스(프란루카스트)' 제네릭의 우선판매 기간은 10월 만료된다. 앞서 우선판매품목허가를 받지 못한 후발의약품의 시장 진입이 예상된다.10월 ‘자디앙 제네릭’ 대거 출격 예고…변수는 ‘미등재 특허’30일 식품의약품안전처에 따르면 베링거인겔하임 자디앙의 물질특허가 오는 10월 23일 만료된다.제약업계에선 특허 만료 시점에 맞춰 제네릭이 대거 발매될 것이란 전망이 나온다. 제네릭사들은 베링거인겔하임과의 특허 분쟁에서 물질특허를 제외한 나머지 등재 특허를 회피하는 데 성공한 상태다.현재 49개 업체가 333개의 엠파글리플로진 기반 단일제·복합제 품목허가를 받아둔 상태다. 자디앙 제네릭은 48개 제네릭사가 100개 품목을, 자디앙듀오(엠파글리플로진+메트포르민) 제네릭은 36개사가 213개 품목을 각각 허가받았다. 에스글리토(엠파글리플로진+리나글립틴) 제네릭은 5개사 10개 품목이 허가됐다.오리지널엔 없는 성분·조합의 제품도 출격 대기 중이다. 종근당과 대원제약은 엠파글리플로진+시타글립틴 조합의 후발약 4개 품목을, 엠파글리플로진+시타글립틴+메트포르민 조합의 후발약 6개 품목을 각각 허가받았다. 당뇨약 시장에서 치열한 제네릭 경쟁이 재현될 것으로 예상된다. 제네릭들은 연 1000억원 이상으로 성장한 엠파글리플로진 시장 진입을 예고한 상태다.의약품 시장조사기관 유비스트에 따르면 자디앙과 자디앙듀오의 지난해 처방실적은 1082억원이다. 2023년 975억원 대비 11% 증가했다.동일 계열 제품인 '포시가(다파글리플로진)'의 공백이 자디앙의 상승세에 적잖은 영향을 끼친 것으로 분석된다. 아스트라제네카는 2023년 말 포시가의 한국시장 철수를 결정한 바 있다. 단 메트포르민 복합제인 직듀오는 남겼다. 포시가는 작년 중순까지 국내 공급됐다.연 500억원 규모의 포시가 공백의 상당 부분은 대부분 자디앙이 차지했다. 자디앙의 처방실적은 2023년 4분기 150억원에서 작년 4분기 182억원으로 1년 새 22% 증가했다. 올해 1분기엔 190억원으로 더욱 늘었다.여기에 메트포르민 복합제인 자디앙듀오도 꾸준한 상승세다. 올해 1분기엔 전년동기 대비 10% 증가한 108억원의 처방실적을 올렸다. 자디앙과 자디앙듀오가 연 1000억원의 처방실적을 합산한다는 점에서 제네릭의 도전이 거셀 것으로 전망된다. 변수는 '미등재 특허'다. 한국베링거인겔하임은 특허청엔 등록됐지만, 식약처 특허목록집엔 등재되지 않은 자디앙·자디앙듀오·에스글리토 관련 특허 9개 이상을 보유하고 있다. 등재 특허가 아니기 때문에 제품 허가엔 문제가 없지만, 발매의 경우 특허침해 우려가 있다.한국베링거인겔하임은 특허권을 강력하게 행사한다는 방침이다. 이미 지난해 트라젠타(리나글립틴) 물질특허 만료 사례에서 한국베링거인겔하임은 제네릭사들에게 내용증명을 보내는 등 적극적으로 특허침해에 대해 경고한 바 있다.이에 제네릭사들은 자디앙 미등재특허의 회피·무효화에 도전하고 있다. 업계에선 상당수 제네릭사가 물질특허 만료 후 제네릭 발매를 강행할 것이란 전망이 나온다. 이미 트라젠타 물질특허 만료 때도 많은 제네릭사가 특허침해 리스크를 안은 채 제품 발매를 강행한 바 있기 때문이다.11월 22일엔 화이자 젤잔즈의 특허가 만료된다. 경구용 자가면역질환 치료제 가운데 첫 특허 만료로 관심을 모은다. 55개 업체가 63개 제네릭 품목허가를 받은 상태다. 이들은 연 144억원 규모의 젤잔즈 시장에 도전한다.나아가 젤잔즈를 포함한 다른 JAK 억제제 계열 오리지널 약물과의 경쟁도 예상된다. 국내에 JAK 억제제로는 젤잔즈를 비롯해 린버크(유파타시티닙)·올루미언트(바리시티닙)·지셀레카(필고티닙) 등이 발매됐다. 이들의 작년 처방액은 622억원으로, 전년대비 56% 증가했다.연 460억 ‘씨투스’ 우판기간 10월 만료…제네릭 추가 진입 전망오는 10월 1일엔 씨투스 제네릭의 우판기간이 만료된다. 이 시점에 맞춰 우판권을 받지 못한 제네릭의 발매가 가능해진다.앞서 제네릭사들은 삼아제약을 상대로 씨투스 제제특허에 소극적 권리범위확인 심판을 청구한 바 있다. 이어 지난해 10월 특허심판원으로부터 청구 성립 심결을 받았다. 삼아제약의 항소 없이 이 심결은 확정됐다.1심 승리를 근거로 특허도전 업체들은 제네릭을 잇달아 허가받았다. 이 가운데 다산제약 ‘프리투스’와 동국제약 ‘프란피드’, 녹십자 ‘네오프란’. 대웅바이오 ‘씨투원’이 우판권을 받았다. 우판기간은 작년 11월부터 올해 10월까지다.이때 우판권을 받지 못한 제네릭사들은 10월 이후 제품을 발매할 수 있다. 한화제약과 동구바이오제약의 제네릭 후발의약품 발매가 예상된다. 이들은 삼아제약을 상대로 한 특허분쟁에서 승리한 바 있다. 한화제약의 경우 ‘씨투리엔’이란 이름으로 제네릭 품목허가까지 받아둔 상태다.씨투스가 연 460억원 규모의 처방실적을 올리고 있는 데다, 먼저 발매된 씨투스 제네릭들이 천식·알레르기비염 치료제 시장에서 제대로 자리를 잡지 못했다는 점에서 1년여 늦게 출격하는 후발의약품에도 충분히 경쟁력이 있다는 분석이 나온다.올해 1분기 씨투스 제네릭은 6억원의 처방실적을 합작하는 데 그쳤다. 전체 프란루카스트 시장에서의 점유율은 5% 수준이다. 반면 오리지널 씨투스는 올해 1분기 114억원으로 전년동기 대비 소폭 증가했다.대형품목 제네릭 시장 열린다2025-06-30 12:15:21김진구 -
 원형탈모 치료제 '렉셀비', 세 번째 경구 JAK 억제제4편: 세 번째 경구 JAK 억제제, 원형탈모증 치료제 렉셀비(Deuruxolitinib)렉셀비(Leqselvi®, lek-sel-vee, 성분명: 듀룩소리티닙, Deuruxolitinib, Sun Pharma)는 미국 FDA로부터 2024년 7월에 성인 중증 원형탈모증(alopecia areata) 치료제로 승인되었다.이 약제는 세 번째 경구용 JAK(Janus kinase) 억제제로, 특히 JAK1과 JAK2를 선택적으로 억제하여 면역 반응을 조절함으로써 탈모를 유발하는 염증 경로를 차단한다. 현재 유럽 EMA에서는 승인되지 않았다.원형탈모증(Alopecia areata, AA)은 비반흔성(non-scarring) 자가면역성 탈모 질환으로, 주로 성장기(anagen phase)의 모낭(hair follicle)이 면역계의 표적이 되어 발생한다. 임상적으로는 국소성 탈모에서 전신 탈모(alopecia universalis)에 이르기까지 다양한 양상을 보인다.여러 연구들은 원형탈모증의 병태생리가 모낭 면역 특권(hair follicle immune privilege)의 붕괴와 밀접하게 연관되어 있음을 밝히며, 최근 이러한 병태생리에 기반한 JAK 억제제들이 개발되면서 치료 패러다임에 중요한 변화가 일어나고 있다.JAK는 원형탈모증의 염증 촉진성 사이토카인(pro-inflammatrory cytokines) 신호전달에서 핵심적인 역할을 하며, 이에 따라 JAK 억제제는 중증 원형탈모증 치료의 유망한 약물 계열로 부상하고 있다. 실제로 미국 FDA는 JAK 억제제인 바리시티닙(Baricitinib)과 리틀레시티닙(Ritlecitinib)을 중증 원형탈모증 치료제로 승인하였고, 국내에도 이미 소개되어 있다.이어 세 번째 경구용 JAK 억제제인 듀룩소리티닙은 JAK1과 JAK2를 선택적으로 억제하고 TYK2도 일부 억제함으로써 염증 반응을 조절하고, 림프구 기능을 부분적으로 유지하는 것이 특징이다. 특히 IFN-γ, IL-2, IL-6, IL-15 등의 광범위한 염증 촉진성 사이토카인에 작용하여, 면역 조절 효과를 극대화한다.듀룩소리티닙의 승인은 두 건의 다국적 3상 임상시험인 THRIVE-AA1 및 THRIVE-AA2를 근거로 이루어졌다. 이들 연구에서는 중증 원형탈모증 환자(두피 탈모 범위 ≥50%) 총 1,220명의 성인 환자를 대상으로 24주간 치료를 시행한 결과, 약 30%의 환자에서 두피 모발의 80% 이상이 회복(SALT 점수 ≤20)되는 유의미한 임상적 개선 효과가 확인되었다.사이토카인(Cytokine)이란 무엇인가?사이토카인은 면역세포를 비롯한 다양한 세포에 의해 생성되며, 주로 폴리펩타이드(polypeptide) 또는 당단백질(glycoprotein)의 형태로 존재하는 세포 간 신호 전달 분자이다.이들은 자가분비(autocrine) 및 측분비(paracrine) 경로를 통해 작용하면서 세포의 증식, 분화, 생존, 그리고 활성화와 같은 핵심 생물학적 과정을 정교하게 조절한다.사이토카인은 특정 세포군에 국한되지 않고, 면역세포뿐만 아니라 상피세포, 섬유아세포, 혈관내피세포 등 다양한 비면역세포에서도 발현될 수 있다. 이는 하나의 사이토카인이 여러 종류의 세포에 작용할 수 있으며, 서로 다른 사이토카인이 동일한 생물학적 효과를 유도하는 경우도 흔하게 관찰된다. 이러한 특성은 세포 간 신호 전달 경로를 복잡하고도 정교하게 구성하게 한다.사이토카인의 작용은 선천 및 후천 면역 반응의 조절뿐 아니라 염증 반응의 유도와 조절, 조직 재생( tissue regeneration), 생체 항상성(homeostasis)의 유지 등 다양한 생리적 과정에서 핵심적인 조절자 역할을 수행한다.사이토카인의 계열로는 인터루킨(interleukins, ILs), 인터페론(interferons, IFNs), 종양괴사인자(tumor necrosis factors, TNFs), 집락자극인자(colony-stimulating factors, CSFs), 케모카인(chemokines), 성장인자(growth factors) 등이 있으며, 이들은 각기 다른 수용체에 결합하여 세포 내 신호전달을 유도하고 세포의 기능적 운명을 결정짓는다.이들 사이토카인은 면역 반응의 시작, 유지, 해소에 관여하는 저분자 단백질로서, 면역세포 간의 신호 전달을 매개하는 주요 인자이다. 이들은 일반적으로 염증 촉진성(pro-inflammatory)과 염증 억제성(anti-inflammatory)으로 분류되며, 세포 내 신호전달, 면역세포의 활성화 상태, 조직 환경 등에 따라 상황 의존적으로 조절된다이러한 두 사이토카인 계열 간의 균형은 병원체 방어와 면역 항상성 유지에 결정적인 역할을 하며, 이 균형이 깨질 경우 자가면역 질환, 만성 염증 또는 면역 억제 상태로 이어질 수 있다.이 중 염증 촉진성 사이토카인은 선천면역 반응 초기 단계에서 빠르게 분비되어 병원체에 대한 방어를 유도하며, 항원제시세포(APC)의 활성화, T 세포 분화, 염증성 케모카인 생성 등을 매개한다. 대표적인 염증성 사이토카인으로는 IFN-γ, IL-1β, IL-6, TNF-α, IL-12, IL-15, IL-17, IL-23 등이 있다.반면, 염증 억제성 사이토카인은 염증 반응을 억제하거나 종결시키는 방향으로 작용하며, 면역 관용 유지 및 조직 복구에 관여한다. 대표적인 억제성 사이토카인으로는 TGF-β, IL-4, IL-10, IL-13, IL-27, IL-35 등이 있다.이와 같이, 두 사이토카인은 상호작용을 통해 면역 반응의 강도와 범위를 조절하며, 이들의 균형은 감염 방어와 자가면역 예방 사이에서 정교하게 조절된다.따라서, 사이토카인(리간드)이 해당 수용체에 결합하면, 수용체에 연계된 JAK가 활성화된다. 활성화된 JAK는 자가 티로신 잔기를 인산화하여 자신의 키나아제 활성을 증가시키며, 이어서 STAT 단백질을 인산화한다. 인산화된 STAT는 이형 혹은 동형 다이머(dimer)를 형성한 후 핵으로 이동하여, 표적 유전자의 전사(transcription)를 촉진한다(Figure 1). 사이토카인 수용체(Cytokine receptors)의 분류와 역할은? 사이토카인 수용체는 사이토카인과의 특이적인 결합을 통해 세포 내 신호 전달을 유도하는 막관통 단백질(transmembrane proteins)이다.사이토카인 수용체는 기능적으로는 결합하는 리간드의 종류에 따라 인터루킨 수용체, 인터페론 수용체, 종양괴사인자(TNF) 수용체, 케모카인 수용체, 조혈자극인자(CSF) 수용체, 성장인자 수용체 등으로 분류되며, 각각 특정한 세포 신호 경로를 통해 고유의 생리학적 효과를 매개한다.또한, 구조적 유사성과 진화적 상동성을 기준으로 분류하면, 크게 제1형 및 제2형 사이토카인 수용체, 케모카인 수용체 계열, TNF 수용체 초계열(superfamily), TGF-β 수용체 계열, 그리고 면역글로불린(Ig) 수용체 초계열로 나뉜다. 각 계열은 공통된 구조적 도메인 및 신호전달 기전을 공유하며, 세포의 운명 결정에 중요한 신호를 전달한다.이 중 제1형 사이토카인 수용체(Type I cytokine receptors)은 다양한 사이토카인에 반응하는 세포막 수용체로, 주로 인터루킨(IL)과 같은 사이토카인을 인식한다. 이 계열에는 IL-2(β-서브유닛), IL-3, IL-4, IL-5, IL-6, IL-7, IL-9, IL-11, IL-12, GM-CSF, G-CSF, 에리스로포이에틴(EPO), LIF, CNTF, TPO(혈소판생성인자), 프로락틴, 성장호르몬 등의 수용체가 있다. 이들 수용체 대부분 JAK-STAT 경로를 통해 세포 내로 신호를 전달한다.또한, 제2형 사이토카인 수용체(Type II cytokine receptors)는 주로 인터페론 계열 및 일부 인터루킨 계열의 사이토카인을 인식하며, 제1형과는 기능적 구조 단위(motif)와 도메인의 구성 및 배열 방식에서 구조적 차이를 보인다. 이 계열에는 IFN-α, IFN-β, IFN-γ, IL-10, IL-22, Tissue factor 등이 있다. 이들 수용체는 리간드 결합 도메인에서 구조적 유사성을 가지며, JAK-STAT 경로를 통해 세포 내로 신호를 전달한다.JAK(Janus kinase)란 무엇인가? JAK는 세포막을 직접 관통하지 않는 비수용체형 티로신 단백질 키나아제((non-receptor tyrosine kinase)로, 사이토카인 수용체의 세포질 도메인에 결합해 세포 외부의 신호를 세포 내부로 전달하는 데 핵심적인 역할을 한다.JAK는 일반적으로 두 개의 기능적 도메인으로 구성되며, 하나는 기질의 인산화를 수행하는 tyrosine kinase 도메인이고, 다른 하나는 촉매 활성을 갖지 않는 pseudokinase 도메인이다. 이러한 이중적인 구조는 로마 신화에서 두 얼굴을 가진 신인 ‘야누스(Janus)’를 연상시키며, Janus kinase라는 명칭의 유래가 되었다.JAK는 단순한 키나아제 활성을 넘어, 수용체 복합체의 안정화, 수용체의 세포 내 이동 및 성숙 조절, 그리고 SOCS(suppressor of cytokine signaling)와 같은 음성 조절인자와의 상호작용을 통해 신호 전달을 정밀하게 조율하는 기능도 수행한다. 이에는 JAK1, JAK2, JAK3 그리고 TYK2로 구분된다.JAK1은 대부분의 조직에서 발현되며, Type I 인터페론 수용체(IFN-α, IFN-β 등), Type II 인터페론 수용체(IFN-γ), IL-6 계열 수용체, 그리고 γc(공통 감마사슬) 수용체와 연계되어 작용한다. 이러한 분자들과의 상호작용을 통해 JAK1은 면역 및 염증 반응의 조절에 중심적인 역할을 한다.JAK2는 다양한 조직에서 광범위하게 발현되며, erythropoietin(EPO), thrombopoietin(TPO), granulocyte colony-stimulating factor(G-CSF) 등 호르몬 유사 사이토카인의 수용체에 특이적으로 작용한다. 이러한 기능을 통해 JAK2는 조혈 및 배아 발생 과정에 필수적인 역할을 한다.JAK3는 주로 골수 및 림프계 조직(T 세포, B 세포, NK 세포 등)에서 특이적으로 발현되며, γc(공통 감마사슬)를 공유하는 IL-2, IL-4, IL-7, IL-9, IL-15, IL-21 수용체에 한정적으로 결합하여 림프구의 발달 및 항상성 유지에 관여한다.TYK2는 Type I 인터페론 수용체를 비롯하여 IL-12 및 IL-23 수용체의 신호 전달에 관여하며, 항바이러스 면역, Th1/Th17 관련 면역 반응, 자가면역 질환의 병태생리 조절에 핵심적인 역할을 한다.STAT(Signal transducer and activator of transcription)는 무엇인가? STAT은 세포 외부의 사이토카인 또는 성장인자 자극을 핵 내 유전자 전사로 연결하는 전사 조절 인자로서, JAK-STAT 경로의 주요 하위 신호 전달자로 기능한다. STAT 단백질은 면역 반응, 염증 조절, 세포 생존 및 분화 등 다양한 생리적 과정에 관여하며, 이들의 활성 이상은 자가면역질환, 염증성 질환, 종양 등의 병태생리와 밀접하게 연관되어 있다.현재까지 밝혀진 STAT은 총 7종(STAT1, STAT2, STAT3, STAT4, STAT5A, STAT5B, STAT6)으로 구성되며, 각 STAT 단백질은 특정 사이토카인 자극에 의해 선택적으로 인산화된 후 이합체(homodimer 또는 heterodimer)를 형성하여 핵으로 이동하고, 표적 유전자의 전사를 조절한다.각 JAK 단백질은 STAT1~4, STAT5A/B, STAT6 등 다양한 STAT 인자들과 선택적으로 결합하며, 이는 특정 리간드-수용체 조합에 따른 하위 신호 전달의 특이성을 매개하는 데 중요한 역할을 한다. 예를 들어, IL-4 수용체는 JAK1과 JAK3의 이종이합체를 형성하여 STAT6를 주로 활성화한다. 이러한 다양성은 사이토카인 신호의 선택성과 세포 특이적 반응을 정밀하게 조절하는 분자적 기반을 제공한다(Figure 2). 이처럼 JAK 계열 단백질은 면역, 염증, 조혈, 항바이러스 반응을 포함한 다양한 생리적·병리적 기능의 중심에서 핵심적 신호전달 플랫폼으로 작용하며, 이를 표적으로 하는 JAK 억제제는 자가면역질환, 염증성 질환, 혈액암 등에서 치료 전략으로 각광받고 있다.JAK-STAT(Janus kinase-Signal transducer and activator of transcription) 경로는 무엇인가?사이토카인과 성장인자는 JAK-STAT 신호 전달 경로를 활성화하는 주요 인자로, 진화적으로 잘 보존되어 있는 신호 체계이다. 이러한 경로는 점균류(slime mold)와 같은 단순한 진핵생물부터 인간에 이르기까지 다양한 생물에서 발견되며, 세포 간 의사소통을 가능하게 하기 위해 진화한 가장 초기의 신호 전달 기전 중 하나이다. 이후 이 경로는 다양한 세포 내 신호전달 기전과 함께 진화하면서, 특정 리간드에 반응하는 정교하고 특이적인 신호 전달 시스템으로 발전하게 되었다.JAK-STAT 경로는 유전자 발현을 정밀하게 조절하여 세포 기능의 다양성과 항상성을 유지하고, 세포 증식, 분화, 이동, 생존, 세포사멸 등 다양한 생물학적 현상을 조절한다. 이 경로는 자극의 종류와 세포 및 조직 환경에 따라 상이한 생리적 반응을 유도하며, 조혈, 면역세포 발달, 줄기세포 항상성, 개체 성장, 유선 발달 등 필수적인 생물학적 과정에서 핵심적인 기능을 담당한다.현재까지 50종 이상의 사이토카인 및 펩타이드 호르몬이 이 경로를 통해 신호를 전달하는 것으로 밝혀져 있으며, 이를 통해 세포 및 조직 수준에서의 반응에 유연성과 정밀성을 부여한다. 이 경로는 인터루킨(IL), 인터페론(IFN), 성장인자, 호르몬 등 다양한 리간드에 의해 활성화된다.JAK-STAT 경로의 활성화는 사이토카인이 세포막 사이토카인 수용체에 결합하면서 시작된다. 사이토카인 결합은 수용체에 결합된 JAK의 자가인산화 및 상호인산화(phosphorylation)를 유도하고, 이에 따라 수용체의 세포질 도메인 내 특정 티로신 잔기가 인산화된다.이 인산화 부위는 Src homology 2(SH2) 도메인을 가진 STAT 단백질의 도킹 부위로 작용하며, STAT은 이곳에 결합한 후 JAK에 의해 인산화되어 활성화된다. 활성화된 STAT은 수용체로부터 분리되어 동종 또는 이종 이합체(dimerization)를 형성한 뒤, 핵으로 이동하여 특정 DNA 서열에 결합함으로써 전사인자로서 유전자 발현을 조절한다(Figure 3). 모낭의 면역 특권(immune privilege, IP)이란 무엇인가? 모낭은 성장기(anagen phase) 동안 자가항원에 대한 면역 반응을 회피하기 위해 면역 특권(IP)이라는 국소적 면역억제 환경을 형성한다. 이는 MHC class I 및 II 분자의 발현 억제, 형질전환 성장인자(transforming growth factor-beta,TGF-β), 알파 멜라닌세포자극호르몬(alpha-melanocyte-stimulating hormone, α-MSH, IL-10 등의 면역조절 인자의 발현, 그리고 NK 및 T 세포 억제 인자의 작용을 통해 이루어진다.이러한 면역 특권은 외부 항원으로부터 모낭 줄기세포 및 멜라닌세포와 같은 면역학적으로 취약한 구조물을 보호하는 역할을 한다. 특히, 모낭 상피 줄기세포는 자가면역성 공격 중에도 보존되므로, 항염증 치료 후에도 모발 재생의 가능성을 보여준다.그러나 원형탈모증에서는 이러한 면역 특권이 국소적으로 붕괴되어 유도되는 자가면역 질환이다. 면역 특권의 손실은 세포독성 T 세포(cytotoxic T cell)의 한 종류인 CD8⁺ NKG2D⁺ T 세포(CD8⁺ Natural Killer Group 2 Member D⁺ T cell)의 모낭 침윤, IFN-γ 및 IL-15와 같은 염증 촉진성 사이토카인(pro-inflammatory cytokine)의 과발현, CXCR3–CXCL9/10 축을 통한 림프구 유입 등이 복합적으로 작용하여 모낭 파괴와 탈모가 유도된다(Figure 4). 요약하면, 원형탈모증에서 사이토카인은 자가면역 반응의 유도, 증폭, 유지에 핵심적인 역할을 하며, 특히 IFN-γ, IL-15, CXCL10 등의 염증 촉진성 사이토카인은 모낭 면역 특권 붕괴 및 세포독성 T 세포의 활성화를 매개한다. 반면, TGF-β 및 IL-10과 같은 염증 억제성 사이토카인의 감소는 이 균형을 더욱 악화시킨다. 이러한 사이토카인 네트워크는 JAK/STAT 신호전달 경로와 밀접히 연관되어 있어, 현재 JAK 억제제를 포함한 다양한 표적 치료제의 개발 근거로 활용되고 있다.현재 원형탈모증 치료제에는 어떤 약제를 사용하는가?원형탈모증은 흉터를 남기지 않는 자가면역성 탈모 질환으로, 모낭 수준에서의 만성 염증을 특징으로 한다. 임상적으로는 국소적이고 경계가 명확한 두피 병변부터 전신 및 두피의 광범위한 탈모에 이르기까지 다양한 양상으로 나타날 수 있다.현재 치료법은 두피 및 체모 침범 정도에 따라 달라지며, 경증의 경우 국소 도포제 및 병변 내 스테로이드 주사(intralesional corticosteroid injection)가 1차 치료로 사용되며, 중등도에서 중증의 경우 전신 면역억제제가 주요 치료법이다. 국소 스테로이드 주사는 두피나 눈썹 부위의 탈모 병변에 직접 주사할 수 있으며, 작은 병변에 가장 효과적인 치료법이다. 또한, 전신 스테로이드제(경구용)는 고용량으로 경구 투여하면 모발 재성장이 유도될 수 있으나, 치료 중단 시 탈모가 재발하는 경우가 많다.외용제로 디트라놀(Dithranol) 크림은 주로 건선(psoriasis) 치료에 사용되는 크림으로, 피부에 자극 반응을 유도함으로써 모발 성장 자극 효과가 보고된 바 있다. 또한 미녹시딜(Minoxidil) 로션은 탈모 부위에 도포하면 일부 환자에서 미세한 모발 성장을 유도할 수 있다.경구용 면역억제제(Sulfasalazine, Methotrexate, Cyclosporine, Azathioprine 등)는 면역 반응을 억제함으로써 기존 치료에 반응하지 않는 중증 원형탈모증 환자에서 제한적으로 사용된다.프로스타글란딘 유사체(Prostaglandin analogs)로 라타노프로스트(Latanoprost), 비마토프로스트(Bimatoprost) 등은 안약 형태 약물이 속눈썹 성장 효과를 보이는 것으로 알려져 있다.JAK 억제제(Baricitinib, Ritlecitinib 등)은 JAK-STAT 신호전달을 차단함으로써 자가면역 반응을 억제하는 작용을 한다.JAK 억제제는 무엇인가? 모낭 상피세포(Follicular epithelial cells)에 MHC class I 분자와 NKG2D 리간드(예: MICA, ULBP 계열)를 비정상적으로 과발현하면, 이는 CD8⁺ NKG2D⁺ T 세포에 의해 인식되어 면역학적 공격의 대상이 된다. 이들 세포는 항원 제시 또는 세포 스트레스 신호에 반응하여 모낭 상피세포와 면역 접합부(immune synapse)를 형성하고, 이를 통해 세포독성 반응을 유도한다.CD8⁺ NKG2D⁺ T 세포는 진피로 침윤하여 모낭 구부(hair follicle bulb) 부위에 분포화되며, IFN-γ를 분비한다. 이는 모낭 상피세포에 발현된 IFN-γ 수용체와 결합하여 JAK1/JAK2 의존적 경로를 활성화시킨다. 이러한 자극은 모낭의 면역 특권을 붕괴시키고, 모발 주기의 퇴행기(catagen phase)로의 전환을 유도한다.동시에, IFN-γ 자극은 모낭 상피세포로 하여금 IL-15를 생성하도록 유도하며, 이 역시 JAK1 및 JAK2 경로를 통해 매개된다. 분비된 IL-15는 CD8⁺ T 세포의 IL-15 수용체에 결합하고, JAK1/JAK3 경로를 통해 추가적으로 IFN-γ 생성을 촉진함으로써, 염증 촉진성 양성 피드백 루프가 증폭된다. 이 루프는 모낭 상피세포의 MHC class I과 NKG2D 리간드(MICA, ULBP-3 등)의 발현을 더욱 촉진하며, 지속적인 자가면역적 공격을 유도하여 원형탈모증의 병태생리에 중심적인 역할을 한다.따라서, IFN-γ는 MHC 분자 및 NKG2D 리간드의 비정상적인 발현을 유도함으로써 면역계에 의한 인식을 촉진하며, IL-15는 자가반응성 기억 T 세포(autoreactive memory T cell)의 생존과 증식을 조절하여 염증 반응을 지속시킨다. 이러한 면역 특권의 병리적 붕괴를 표적으로 하는 치료 전략의 가능성을 전임상 및 임상 연구들에서 제시해왔다.이에, 토파시티닙(Tofacitinib)은 주로 JAK1 및 JAK3를, 룩소리티닙)Ruxolitinib과 바리시티닙(Baricitinib)은 JAK1 및 JAK2를 선택적으로 억제함으로써, 해당 신호전달 경로의 다양한 단계를 차단할 수 있다. 이들 JAK 억제제는 염증 축진성 사이토카인 신호와 면역 활성화 루프를 차단하여, 원형탈모증에서의 염증 반응을 억제하고 모낭 파괴를 완화시키는 기전을 가진 것으로 보고되고 있다(Figure 5). 즉, 이러한 경로의 차단은 면역 특권을 부분적으로 복원하고, 염증세포의 침윤을 억제함으로써 치료적 효과를 보이는 것으로 보고되었다. JAK 억제제는 이러한 염증 신호를 억제함으로써 모낭의 자가면역 공격을 차단하고, 모발 재성장을 유도하는 표적 치료제로 주목받고 있다.현재 국내에서 승인된 JAK 억제제는? 현재 '바리시티닙(Baricitinib, Olumiant®, 릴리)', '리틀레시티닙(Ritlecitinib, Litfulo®, 화이자)'이 중증 원형탈모증(AA) 치료제로 승인되었다. 이들 약제는 모두 모낭 주변의 사이토카인 폭풍을 진정시켜 면역 매개 탈모를 억제하고, 모발 재성장을 촉진하는 기전을 공유한다. 이로써 JAK 억제제는 AA의 치료에 있어 새로운 치료 패러다임으로 자리 잡고 있다.먼저, 바리시티닙은 JAK1/2 억제제로, 2022년 미국 FDA 및 유럽 EMA, 2023년 한국 식약처로부터 성인 중증 원형탈모증 치료제로 승인받았다. 이 약제는 JAK1/2를 억제함으로써 IFN 계열 및 IL-6 등 광범위한 염증 촉진성 사이토카인의 신호전달을 차단한다.이 약제는 3상 BRAVE-AA1 및 BRAVE-AA2 임상시험의 결과를 기반으로 허가되었다. 총 1,200명의 성인을 대상으로 36주간 투여 후 평가한 결과, 4 mg 투여군의 35∼38%가 SALT 점수 ≤20(두피 모발 80% 이상 회복)을 달성하였으며, 이는 위약군(3∼6%) 대비 유의미한 차이를 보였다. 2 mg 투여군도 위약군에 비해 우월한 반응률(19∼23%)을 나타냈으나, 4 mg 투여군보다는 효과가 낮았다. 주된 이상반응은 상기도 감염, 두통, 여드름 등이었으며, 심각한 이상반응 발생률은 낮게 보고되었다.다음, 리틀레시티닙은 JAK3 및 TEC 계열 선택적 억제제로, 2023년 미국 및 유럽에서, 2024년 9월에는 국내에서 12세 이상 청소년 및 성인을 대상으로 한 중증 원형탈모증 치료제로 승인되었다. 이 이 야제는 JAK3 및 TEC를 억제함으로써 IL-2, IL-15 등 γc 공유 수용체 계열 사이토카인의 신호를 선택적으로 조절한다.이 약제는 ALLEGRO 2b/3상 및 ALLEGRO-LT 장기 추적 연구를 통해 임상적 근거가 확보되었으며, ALLEGRO 2b/3상에서는 총 718명의 환자를 대상으로 리틀레시티닙 50 mg 1일 1회 투여 시 24주 후 SALT 점수 ≤20 도달율이 23%로, 위약군(1.6%) 대비 우수하였다. 흔한 이상반응으로는 두통, 설사, 여드름, 발진 등이 있었고, 중대한 이상반응의 빈도는 낮고 대조군과 유사하였다.이러한 결과는 JAK 억제제가 중증 원형탈모증 치료에서 염증 촉진성 사이토카인 경로의 차단을 통해 염증 반응을 조절하고, 이는 모발 재생을 유도하는 효과적인 치료제로 볼 수 있다.듀룩솔리티닙은 어떤 약제인가? 듀룩솔리티닙(제품명: Leqselvi®, Sun Pharma)은 선택적 JAK 1/2 억제제로, 2024년 7월 미국 FDA로부터 ‘성인 중증 원형탈모증’ 치료제로 승인되었다. 이 약제는 기존 JAK 억제제인 룩솔리티닙(Ruxolitinib)의 중수소화 유사체(deuterated analog)로 개발되었으며, 중수소 치환을 통해 약물의 대사적 안정성 및 약동학적 특성을 개선한 것이 특징이다.중수소화(deuteration)는 기존 약물의 특정 수소(H)를 중수소(D)로 대체하는 동등한 생물학적 특성을 갖는 원자 치환 방식으로, 산화적 대사 반응을 늦춰 약물의 반감기를 연장하고, 혈중 농도 변동성을 감소시키며, 유해 대사체 생성을 억제할 수 있다. 이에 따라 이 약제는 구조적으로는 룩솔리티닙과 유사하지만, 약물 노출 유지 및 복용 효율성 측면에서 향상된 약동학적 이점을 갖는 2세대 JAK 억제제로 평가된다.전임상 연구에 따르면, 듀룩솔리티닙은 JAK1, JAK2 및 TYK2에 대해 높은 억제 활성을 나타내며, JAK3에 대해서는 상대적으로 낮은 억제력을 보인다. 하지만 이들 효소에 대한 선택적 억제가 임상 효과에 어떤 기여를 하는지에 대해서는 아직 명확한 인과관계가 확립되지 않았다.임상 적용 시, 듀룩솔리티닙은 다른 JAK 억제제, 생물학적 제제, 사이클로스포린 및 강력한 면역억제제와의 병용은 권장되지 않으며, 단독요법으로의 사용이 권장된다.이 약제는 중대한 감염, 악성 종양, 심혈관 질환, 혈전증 등의 발생 위험이 동반될 수 있어 주의가 필요하다. 이에 따라, 치료 전 잠복 결핵 및 B형 간염 검사, CYP2C9 유전자형 분석이 필요하며, 치료 도중 정기적인 간기능, 혈액학적 검사, 감염 모니터링이 요구된다.듀룩솔리티닙의 기전은? 원형탈모증(AA)의 병인 및 병태생리는 아직 완전히 규명되지 않았으나, 모낭의 면역 특권의 붕괴가 초기 변화로 작용하고, 이후 노출된 자가항원이 자가반응성 CD8⁺ T 세포에 의해 인지되면서 면역반응이 유도되는 기전이 주요한 병리 과정이다. 듀룩솔리티닙의 약리 기전은 첫째, 이 약제는 JAK1과 JAK2를 선택적으로 억제함으로써, 다양한 염증 촉진성 사이토카인(예: IFN-γ, IL-2, IL-6, IL-15 등)의 신호전달을 차단하여 염증 반응을 감소시키고 모발 성장을 증진시킨다. 이러한 사이토카인들은 AA의 병태생리에서 중심적인 역할을 하며, T 세포의 활성화, 자연살해세포(NK cell)의 기능 조절, 모낭 주변의 염증 유도에 관여한다.특히, IFN-γ는 IFN-γ 수용체와 결합하여 모낭의 MHC class I 및 II 발현을 증가시켜 면역 특권을 붕괴시키며, 자가 반응성 CD8⁺ T 세포의 공격을 유도한다. 이 약제는 IFN-γ 수용체 하위의 JAK1/JAK2를 억제함으로써 이러한 과정을 차단한다(Figure 6). 둘째, 이 약제는 JAK-STAT 경로 차단을 통해 MHC 분자의 발현을 감소시키고, 면역세포인 CD8⁺ T 세포의 모낭 접근성을 차단하여 모낭의 면역 특권을 회복시킨다. 이는 자가면역 반응을 완화시키는 데 핵심적이다.셋째, 이 약제는 PD-1(programmed death-1)의 발현을 증가시켜 과활성화된 T 세포의 기능을 억제한다. PD-1은 T 세포의 기능적 소진(T-cell exhaustion)을 유도하는 대표적인 억제 수용체로, 지속적인 자가면역 반응을 억제하는 데 관여한다.넷째, 이 약제는 전임상 모델에서 진피유두세포(human dermal papilla cells)에서 Wnt/β-catenin 경로를 활성화하여 모낭의 성장기(anagen) 재진입을 유도함이 확인되었다. 또한 이 경로를 공유함으로써, 모낭 재생 및 탈모 회복 효과를 병행하는 치료적 우위를 갖는다.듀룩솔리티닙의 허가임상은? 듀룩솔리티닙(LEQSELVI)의 THRIVE-AA1과 2는 다기관, 무작위배정, 이중맹검, 위약 대조 3상 임상시험으로 6개월 이상 두피 탈모가 50% 이상인 성인 원형탈모증 환자 총 1,209명을 대상으로 평가하였다. 시험 대상자들은 24주 동안 이 약제 8mg을 하루 2회, 12mg을 하루 2회, 그리고 위약을 투여받았다.현재 승인된 용량은 8mg 하루 2회이며, 12mg 용량은 승인되지 않았다.베이스 라인에서 환자들의 평균 현재 탈모 에피소드 기간은 약 4년이었으며, 전체의 59%가 '완전 또는 거의 완전한 두피 탈모(두피 탈모 ≥ 95%) 상태였다. 치료군 간 통합된 기저 SALT(Severity of Alopecia Tool, 탈모 중증도 평가척도) 점수는 평균 85.9∼88.6 범위였고, 현재 탈모 에피소드의 평균 지속 기간은 3.7∼3.9년이었다. 이 외에도, 약 73%는 눈썹 탈모가, 70%는 속눈썹 탈모가 있었다.두 임상시험의 1차 평가 변수는 24주 시점에서 SALT 점수 ≤ 20(즉, 두피 모발이 80% 이상 회복된 상태)에 도달한 피험자의 비율이었다. 주요 2차 평가 변수에는 다음이 포함되었다:24주차 SPRO(Satisfaction of Hair Patient- Reported Outcome, 환자 만족도 자기보고 결과)에서 “만족” 또는 “매우 만족”이라고 응답한 비율 8, 12, 16, 20주차에 SALT 점수 ≤ 20을 달성한 피험자의 비율 24주 치료가 종료된 후, 환자들은 장기 연장 연구에 등록할 수 있는 자격이 주어졌다.두피 탈모 평가는 SALT 점수를 기준으로 이루어졌다. 24주 시점에서, 이 약제 8mg을 하루 두 번 복용한 환자군은 위약군에 비해 SALT ≤ 20(두피 모발 80% 이상 회복) 및 SALT ≤ 10(두피 모발 90% 이상 회복)에 도달한 비율이 더 높았다.Clinical Response at Week 24 in Adult Subjects with Severe AA in Trials AA-1 and AA-2 어떤 쟁점이 있는가? 듀룩솔리티닙은 룩솔리티닙(Ruxolitinib)의 중수소화 유도체로 개발된 선택적 JAK1/2 억제제이며, 동일한 표적 선택성을 유지하면서도 약동학적 특성 개선을 목표로 설계되었다. 이 약제는 IFN-γ, IL-15 등 염증 촉진성 사이토카인의 신호 전달을 차단함으로써 모낭에 대한 면역학적 공격을 억제하고, 탈모 진행을 늦추며 모발 재생을 유도한다.국내에 소개된 JAK 억제제 중 바리시티닙은 최초로 승인된 중증 원형탈모증 치료제로, JAK1/2 억제를 통해 자가면역 질환 전반에 적용 가능하지만, 장기 복용에 따른 심혈관계 이상 및 악성종양 발생 위험 등 안전성 우려가 지속적으로 제기되어 왔다.이에 듀룩솔리티닙은 이러한 기존 약물과 달리 2세대 JAK 억제제로서, 특히 8mg 1일 2회 투여 시 우수한 치료 반응을 보였다. 바리시티닙과 리틀레시티닙이 1일 1회 복용 방식인 반면, 듀룩솔리티닙은 1일 2회 복용이 권장되어 혈중 농도 유지와 반응률 개선에는 이점이 있지만, 복약 순응도 측면에서는 불리할 수 있다.임상 유효성(SALT score ≤20 도달률) 측면에서, 바리시티닙 4mg은 36주 후 약 35∼38%, 2mg은 19∼23%, 위약군은 3∼6%, 리틀레시티닙 50mg은 24주 후 23%, 위약군은 1.6%였다. 반면, 듀룩솔리티닙 8mg은 24주 후 약 30%, 위약군은 1% 미만으로 유의한 차이를 나타냈다.추가해서, 듀룩솔리티닙의 경우 고용량(12mg)의 효과는 더 높았으나, 해당 용량은 미국 FDA 승인 대상에서 제외되었으며, 24주 시점의 자료만으로는 장기 안전성과 지속적 유효성을 판단하기에는 제한적이므로, 향후 보완 임상자료 확보가 필요할 것으로 보인다. 8mg 경우에도 감염, 악성 종양, 심혈관 질환, 혈전증 등의 발생 위험이 동반될 수 있어 주의가 필요하다한편, 듀룩솔리티닙의 개발사인 Sun Pharma는 룩솔리티닙의 원 개발사인 Incyte로부터 특허 침해 소송에 직면하였으나, 2025년 4월 9일 미국 연방순회항소법원이 예비 금지 명령을 해제함으로써, 미국 내 시판이 가능해졌다.참고로, 룩솔리티닙은 현재 외용제로 개발되어 2021년 아토피 피부염, 2022년 백반증 치료제로 FDA 승인을 받았으나, 원형탈모증에 대해서는 제한적 효과로 인해 승인되지 않았다.이러한 결과는 듀룩솔리티닙이 룩솔리티닙 대비 구조적 차별성과 약동학적 개선을 기반으로 중증 원형탈모증 치료에서 유의미한 치료 옵션이 될 수 있음을 시사한다.현 상황에서 듀룩솔리티닙은 아직 유럽 EMA의 승인을 받지 않은 상태이다. 따라서 유럽 시장 진입을 위한 추가 임상 데이터와 장기 안전성 자료 확보, 그리고 규제기관의 평가 결과를 주의 깊게 지켜볼 필요가 있다.향후 미국 FDA에서 12mg에 대한 추가 승인 및 유럽 EMA 승인까지 이루어진다면, 국내에서도 긍정적으로 판단될 것으로 예상하며, 이는 중증 원형탈모증 치료 전략의 다양성을 확대하는 데 기여할 것으로 기대된다.참고문헌​ 1. Maddison Lensing, Ali Jabbari “An overview of JAK/STAT pathways and JAK inhibition in alopecia areata” Front Immunol. 2022 Aug 30;13:955035. 2. Melinda Gooderham “Small molecules: an overview of emerging therapeutic options in the treatment of psoriasis“ Skin Therapy Letter 2013;18(7):1-4 3. Michael D. Howell, Fiona I. Kuo, Paul A. Smith ”Targeting the Janus Kinase Family in Autoimmune Skin Diseases“ Front. Immunol. 10:2342(2019). 4. Chen Xue, Qinfan Yao, Xinyu Gu, Qingmiao Shi, et al. “Evolving cognition of the JAK-STAT signaling pathway: autoimmune disorders and cancer“ Signal Transduction and Targeted Therapy 2023;8:204). 5. Dante Dahabreh, Seungyeon Jung, Yael Renert-Yuval, et al. “Alopecia Areata: Current Treatments and New Directions” Am J Clin Dermatol. 2023;24(6):886-912 6. Dagmar Gotthardt, Jana Trifinopoulos, Veronika Sexl and Eva Maria Putz “ JAK/STAT Cytokine Signaling at the Crossroad of NK Cell Development and Maturation” Front. Immunol. 2019;10:2590. 7. 기타 인터넷 자료(보도 자료, 제품 설명서 등)2025-05-30 06:40:26최병철 박사
원형탈모 치료제 '렉셀비', 세 번째 경구 JAK 억제제4편: 세 번째 경구 JAK 억제제, 원형탈모증 치료제 렉셀비(Deuruxolitinib)렉셀비(Leqselvi®, lek-sel-vee, 성분명: 듀룩소리티닙, Deuruxolitinib, Sun Pharma)는 미국 FDA로부터 2024년 7월에 성인 중증 원형탈모증(alopecia areata) 치료제로 승인되었다.이 약제는 세 번째 경구용 JAK(Janus kinase) 억제제로, 특히 JAK1과 JAK2를 선택적으로 억제하여 면역 반응을 조절함으로써 탈모를 유발하는 염증 경로를 차단한다. 현재 유럽 EMA에서는 승인되지 않았다.원형탈모증(Alopecia areata, AA)은 비반흔성(non-scarring) 자가면역성 탈모 질환으로, 주로 성장기(anagen phase)의 모낭(hair follicle)이 면역계의 표적이 되어 발생한다. 임상적으로는 국소성 탈모에서 전신 탈모(alopecia universalis)에 이르기까지 다양한 양상을 보인다.여러 연구들은 원형탈모증의 병태생리가 모낭 면역 특권(hair follicle immune privilege)의 붕괴와 밀접하게 연관되어 있음을 밝히며, 최근 이러한 병태생리에 기반한 JAK 억제제들이 개발되면서 치료 패러다임에 중요한 변화가 일어나고 있다.JAK는 원형탈모증의 염증 촉진성 사이토카인(pro-inflammatrory cytokines) 신호전달에서 핵심적인 역할을 하며, 이에 따라 JAK 억제제는 중증 원형탈모증 치료의 유망한 약물 계열로 부상하고 있다. 실제로 미국 FDA는 JAK 억제제인 바리시티닙(Baricitinib)과 리틀레시티닙(Ritlecitinib)을 중증 원형탈모증 치료제로 승인하였고, 국내에도 이미 소개되어 있다.이어 세 번째 경구용 JAK 억제제인 듀룩소리티닙은 JAK1과 JAK2를 선택적으로 억제하고 TYK2도 일부 억제함으로써 염증 반응을 조절하고, 림프구 기능을 부분적으로 유지하는 것이 특징이다. 특히 IFN-γ, IL-2, IL-6, IL-15 등의 광범위한 염증 촉진성 사이토카인에 작용하여, 면역 조절 효과를 극대화한다.듀룩소리티닙의 승인은 두 건의 다국적 3상 임상시험인 THRIVE-AA1 및 THRIVE-AA2를 근거로 이루어졌다. 이들 연구에서는 중증 원형탈모증 환자(두피 탈모 범위 ≥50%) 총 1,220명의 성인 환자를 대상으로 24주간 치료를 시행한 결과, 약 30%의 환자에서 두피 모발의 80% 이상이 회복(SALT 점수 ≤20)되는 유의미한 임상적 개선 효과가 확인되었다.사이토카인(Cytokine)이란 무엇인가?사이토카인은 면역세포를 비롯한 다양한 세포에 의해 생성되며, 주로 폴리펩타이드(polypeptide) 또는 당단백질(glycoprotein)의 형태로 존재하는 세포 간 신호 전달 분자이다.이들은 자가분비(autocrine) 및 측분비(paracrine) 경로를 통해 작용하면서 세포의 증식, 분화, 생존, 그리고 활성화와 같은 핵심 생물학적 과정을 정교하게 조절한다.사이토카인은 특정 세포군에 국한되지 않고, 면역세포뿐만 아니라 상피세포, 섬유아세포, 혈관내피세포 등 다양한 비면역세포에서도 발현될 수 있다. 이는 하나의 사이토카인이 여러 종류의 세포에 작용할 수 있으며, 서로 다른 사이토카인이 동일한 생물학적 효과를 유도하는 경우도 흔하게 관찰된다. 이러한 특성은 세포 간 신호 전달 경로를 복잡하고도 정교하게 구성하게 한다.사이토카인의 작용은 선천 및 후천 면역 반응의 조절뿐 아니라 염증 반응의 유도와 조절, 조직 재생( tissue regeneration), 생체 항상성(homeostasis)의 유지 등 다양한 생리적 과정에서 핵심적인 조절자 역할을 수행한다.사이토카인의 계열로는 인터루킨(interleukins, ILs), 인터페론(interferons, IFNs), 종양괴사인자(tumor necrosis factors, TNFs), 집락자극인자(colony-stimulating factors, CSFs), 케모카인(chemokines), 성장인자(growth factors) 등이 있으며, 이들은 각기 다른 수용체에 결합하여 세포 내 신호전달을 유도하고 세포의 기능적 운명을 결정짓는다.이들 사이토카인은 면역 반응의 시작, 유지, 해소에 관여하는 저분자 단백질로서, 면역세포 간의 신호 전달을 매개하는 주요 인자이다. 이들은 일반적으로 염증 촉진성(pro-inflammatory)과 염증 억제성(anti-inflammatory)으로 분류되며, 세포 내 신호전달, 면역세포의 활성화 상태, 조직 환경 등에 따라 상황 의존적으로 조절된다이러한 두 사이토카인 계열 간의 균형은 병원체 방어와 면역 항상성 유지에 결정적인 역할을 하며, 이 균형이 깨질 경우 자가면역 질환, 만성 염증 또는 면역 억제 상태로 이어질 수 있다.이 중 염증 촉진성 사이토카인은 선천면역 반응 초기 단계에서 빠르게 분비되어 병원체에 대한 방어를 유도하며, 항원제시세포(APC)의 활성화, T 세포 분화, 염증성 케모카인 생성 등을 매개한다. 대표적인 염증성 사이토카인으로는 IFN-γ, IL-1β, IL-6, TNF-α, IL-12, IL-15, IL-17, IL-23 등이 있다.반면, 염증 억제성 사이토카인은 염증 반응을 억제하거나 종결시키는 방향으로 작용하며, 면역 관용 유지 및 조직 복구에 관여한다. 대표적인 억제성 사이토카인으로는 TGF-β, IL-4, IL-10, IL-13, IL-27, IL-35 등이 있다.이와 같이, 두 사이토카인은 상호작용을 통해 면역 반응의 강도와 범위를 조절하며, 이들의 균형은 감염 방어와 자가면역 예방 사이에서 정교하게 조절된다.따라서, 사이토카인(리간드)이 해당 수용체에 결합하면, 수용체에 연계된 JAK가 활성화된다. 활성화된 JAK는 자가 티로신 잔기를 인산화하여 자신의 키나아제 활성을 증가시키며, 이어서 STAT 단백질을 인산화한다. 인산화된 STAT는 이형 혹은 동형 다이머(dimer)를 형성한 후 핵으로 이동하여, 표적 유전자의 전사(transcription)를 촉진한다(Figure 1). 사이토카인 수용체(Cytokine receptors)의 분류와 역할은? 사이토카인 수용체는 사이토카인과의 특이적인 결합을 통해 세포 내 신호 전달을 유도하는 막관통 단백질(transmembrane proteins)이다.사이토카인 수용체는 기능적으로는 결합하는 리간드의 종류에 따라 인터루킨 수용체, 인터페론 수용체, 종양괴사인자(TNF) 수용체, 케모카인 수용체, 조혈자극인자(CSF) 수용체, 성장인자 수용체 등으로 분류되며, 각각 특정한 세포 신호 경로를 통해 고유의 생리학적 효과를 매개한다.또한, 구조적 유사성과 진화적 상동성을 기준으로 분류하면, 크게 제1형 및 제2형 사이토카인 수용체, 케모카인 수용체 계열, TNF 수용체 초계열(superfamily), TGF-β 수용체 계열, 그리고 면역글로불린(Ig) 수용체 초계열로 나뉜다. 각 계열은 공통된 구조적 도메인 및 신호전달 기전을 공유하며, 세포의 운명 결정에 중요한 신호를 전달한다.이 중 제1형 사이토카인 수용체(Type I cytokine receptors)은 다양한 사이토카인에 반응하는 세포막 수용체로, 주로 인터루킨(IL)과 같은 사이토카인을 인식한다. 이 계열에는 IL-2(β-서브유닛), IL-3, IL-4, IL-5, IL-6, IL-7, IL-9, IL-11, IL-12, GM-CSF, G-CSF, 에리스로포이에틴(EPO), LIF, CNTF, TPO(혈소판생성인자), 프로락틴, 성장호르몬 등의 수용체가 있다. 이들 수용체 대부분 JAK-STAT 경로를 통해 세포 내로 신호를 전달한다.또한, 제2형 사이토카인 수용체(Type II cytokine receptors)는 주로 인터페론 계열 및 일부 인터루킨 계열의 사이토카인을 인식하며, 제1형과는 기능적 구조 단위(motif)와 도메인의 구성 및 배열 방식에서 구조적 차이를 보인다. 이 계열에는 IFN-α, IFN-β, IFN-γ, IL-10, IL-22, Tissue factor 등이 있다. 이들 수용체는 리간드 결합 도메인에서 구조적 유사성을 가지며, JAK-STAT 경로를 통해 세포 내로 신호를 전달한다.JAK(Janus kinase)란 무엇인가? JAK는 세포막을 직접 관통하지 않는 비수용체형 티로신 단백질 키나아제((non-receptor tyrosine kinase)로, 사이토카인 수용체의 세포질 도메인에 결합해 세포 외부의 신호를 세포 내부로 전달하는 데 핵심적인 역할을 한다.JAK는 일반적으로 두 개의 기능적 도메인으로 구성되며, 하나는 기질의 인산화를 수행하는 tyrosine kinase 도메인이고, 다른 하나는 촉매 활성을 갖지 않는 pseudokinase 도메인이다. 이러한 이중적인 구조는 로마 신화에서 두 얼굴을 가진 신인 ‘야누스(Janus)’를 연상시키며, Janus kinase라는 명칭의 유래가 되었다.JAK는 단순한 키나아제 활성을 넘어, 수용체 복합체의 안정화, 수용체의 세포 내 이동 및 성숙 조절, 그리고 SOCS(suppressor of cytokine signaling)와 같은 음성 조절인자와의 상호작용을 통해 신호 전달을 정밀하게 조율하는 기능도 수행한다. 이에는 JAK1, JAK2, JAK3 그리고 TYK2로 구분된다.JAK1은 대부분의 조직에서 발현되며, Type I 인터페론 수용체(IFN-α, IFN-β 등), Type II 인터페론 수용체(IFN-γ), IL-6 계열 수용체, 그리고 γc(공통 감마사슬) 수용체와 연계되어 작용한다. 이러한 분자들과의 상호작용을 통해 JAK1은 면역 및 염증 반응의 조절에 중심적인 역할을 한다.JAK2는 다양한 조직에서 광범위하게 발현되며, erythropoietin(EPO), thrombopoietin(TPO), granulocyte colony-stimulating factor(G-CSF) 등 호르몬 유사 사이토카인의 수용체에 특이적으로 작용한다. 이러한 기능을 통해 JAK2는 조혈 및 배아 발생 과정에 필수적인 역할을 한다.JAK3는 주로 골수 및 림프계 조직(T 세포, B 세포, NK 세포 등)에서 특이적으로 발현되며, γc(공통 감마사슬)를 공유하는 IL-2, IL-4, IL-7, IL-9, IL-15, IL-21 수용체에 한정적으로 결합하여 림프구의 발달 및 항상성 유지에 관여한다.TYK2는 Type I 인터페론 수용체를 비롯하여 IL-12 및 IL-23 수용체의 신호 전달에 관여하며, 항바이러스 면역, Th1/Th17 관련 면역 반응, 자가면역 질환의 병태생리 조절에 핵심적인 역할을 한다.STAT(Signal transducer and activator of transcription)는 무엇인가? STAT은 세포 외부의 사이토카인 또는 성장인자 자극을 핵 내 유전자 전사로 연결하는 전사 조절 인자로서, JAK-STAT 경로의 주요 하위 신호 전달자로 기능한다. STAT 단백질은 면역 반응, 염증 조절, 세포 생존 및 분화 등 다양한 생리적 과정에 관여하며, 이들의 활성 이상은 자가면역질환, 염증성 질환, 종양 등의 병태생리와 밀접하게 연관되어 있다.현재까지 밝혀진 STAT은 총 7종(STAT1, STAT2, STAT3, STAT4, STAT5A, STAT5B, STAT6)으로 구성되며, 각 STAT 단백질은 특정 사이토카인 자극에 의해 선택적으로 인산화된 후 이합체(homodimer 또는 heterodimer)를 형성하여 핵으로 이동하고, 표적 유전자의 전사를 조절한다.각 JAK 단백질은 STAT1~4, STAT5A/B, STAT6 등 다양한 STAT 인자들과 선택적으로 결합하며, 이는 특정 리간드-수용체 조합에 따른 하위 신호 전달의 특이성을 매개하는 데 중요한 역할을 한다. 예를 들어, IL-4 수용체는 JAK1과 JAK3의 이종이합체를 형성하여 STAT6를 주로 활성화한다. 이러한 다양성은 사이토카인 신호의 선택성과 세포 특이적 반응을 정밀하게 조절하는 분자적 기반을 제공한다(Figure 2). 이처럼 JAK 계열 단백질은 면역, 염증, 조혈, 항바이러스 반응을 포함한 다양한 생리적·병리적 기능의 중심에서 핵심적 신호전달 플랫폼으로 작용하며, 이를 표적으로 하는 JAK 억제제는 자가면역질환, 염증성 질환, 혈액암 등에서 치료 전략으로 각광받고 있다.JAK-STAT(Janus kinase-Signal transducer and activator of transcription) 경로는 무엇인가?사이토카인과 성장인자는 JAK-STAT 신호 전달 경로를 활성화하는 주요 인자로, 진화적으로 잘 보존되어 있는 신호 체계이다. 이러한 경로는 점균류(slime mold)와 같은 단순한 진핵생물부터 인간에 이르기까지 다양한 생물에서 발견되며, 세포 간 의사소통을 가능하게 하기 위해 진화한 가장 초기의 신호 전달 기전 중 하나이다. 이후 이 경로는 다양한 세포 내 신호전달 기전과 함께 진화하면서, 특정 리간드에 반응하는 정교하고 특이적인 신호 전달 시스템으로 발전하게 되었다.JAK-STAT 경로는 유전자 발현을 정밀하게 조절하여 세포 기능의 다양성과 항상성을 유지하고, 세포 증식, 분화, 이동, 생존, 세포사멸 등 다양한 생물학적 현상을 조절한다. 이 경로는 자극의 종류와 세포 및 조직 환경에 따라 상이한 생리적 반응을 유도하며, 조혈, 면역세포 발달, 줄기세포 항상성, 개체 성장, 유선 발달 등 필수적인 생물학적 과정에서 핵심적인 기능을 담당한다.현재까지 50종 이상의 사이토카인 및 펩타이드 호르몬이 이 경로를 통해 신호를 전달하는 것으로 밝혀져 있으며, 이를 통해 세포 및 조직 수준에서의 반응에 유연성과 정밀성을 부여한다. 이 경로는 인터루킨(IL), 인터페론(IFN), 성장인자, 호르몬 등 다양한 리간드에 의해 활성화된다.JAK-STAT 경로의 활성화는 사이토카인이 세포막 사이토카인 수용체에 결합하면서 시작된다. 사이토카인 결합은 수용체에 결합된 JAK의 자가인산화 및 상호인산화(phosphorylation)를 유도하고, 이에 따라 수용체의 세포질 도메인 내 특정 티로신 잔기가 인산화된다.이 인산화 부위는 Src homology 2(SH2) 도메인을 가진 STAT 단백질의 도킹 부위로 작용하며, STAT은 이곳에 결합한 후 JAK에 의해 인산화되어 활성화된다. 활성화된 STAT은 수용체로부터 분리되어 동종 또는 이종 이합체(dimerization)를 형성한 뒤, 핵으로 이동하여 특정 DNA 서열에 결합함으로써 전사인자로서 유전자 발현을 조절한다(Figure 3). 모낭의 면역 특권(immune privilege, IP)이란 무엇인가? 모낭은 성장기(anagen phase) 동안 자가항원에 대한 면역 반응을 회피하기 위해 면역 특권(IP)이라는 국소적 면역억제 환경을 형성한다. 이는 MHC class I 및 II 분자의 발현 억제, 형질전환 성장인자(transforming growth factor-beta,TGF-β), 알파 멜라닌세포자극호르몬(alpha-melanocyte-stimulating hormone, α-MSH, IL-10 등의 면역조절 인자의 발현, 그리고 NK 및 T 세포 억제 인자의 작용을 통해 이루어진다.이러한 면역 특권은 외부 항원으로부터 모낭 줄기세포 및 멜라닌세포와 같은 면역학적으로 취약한 구조물을 보호하는 역할을 한다. 특히, 모낭 상피 줄기세포는 자가면역성 공격 중에도 보존되므로, 항염증 치료 후에도 모발 재생의 가능성을 보여준다.그러나 원형탈모증에서는 이러한 면역 특권이 국소적으로 붕괴되어 유도되는 자가면역 질환이다. 면역 특권의 손실은 세포독성 T 세포(cytotoxic T cell)의 한 종류인 CD8⁺ NKG2D⁺ T 세포(CD8⁺ Natural Killer Group 2 Member D⁺ T cell)의 모낭 침윤, IFN-γ 및 IL-15와 같은 염증 촉진성 사이토카인(pro-inflammatory cytokine)의 과발현, CXCR3–CXCL9/10 축을 통한 림프구 유입 등이 복합적으로 작용하여 모낭 파괴와 탈모가 유도된다(Figure 4). 요약하면, 원형탈모증에서 사이토카인은 자가면역 반응의 유도, 증폭, 유지에 핵심적인 역할을 하며, 특히 IFN-γ, IL-15, CXCL10 등의 염증 촉진성 사이토카인은 모낭 면역 특권 붕괴 및 세포독성 T 세포의 활성화를 매개한다. 반면, TGF-β 및 IL-10과 같은 염증 억제성 사이토카인의 감소는 이 균형을 더욱 악화시킨다. 이러한 사이토카인 네트워크는 JAK/STAT 신호전달 경로와 밀접히 연관되어 있어, 현재 JAK 억제제를 포함한 다양한 표적 치료제의 개발 근거로 활용되고 있다.현재 원형탈모증 치료제에는 어떤 약제를 사용하는가?원형탈모증은 흉터를 남기지 않는 자가면역성 탈모 질환으로, 모낭 수준에서의 만성 염증을 특징으로 한다. 임상적으로는 국소적이고 경계가 명확한 두피 병변부터 전신 및 두피의 광범위한 탈모에 이르기까지 다양한 양상으로 나타날 수 있다.현재 치료법은 두피 및 체모 침범 정도에 따라 달라지며, 경증의 경우 국소 도포제 및 병변 내 스테로이드 주사(intralesional corticosteroid injection)가 1차 치료로 사용되며, 중등도에서 중증의 경우 전신 면역억제제가 주요 치료법이다. 국소 스테로이드 주사는 두피나 눈썹 부위의 탈모 병변에 직접 주사할 수 있으며, 작은 병변에 가장 효과적인 치료법이다. 또한, 전신 스테로이드제(경구용)는 고용량으로 경구 투여하면 모발 재성장이 유도될 수 있으나, 치료 중단 시 탈모가 재발하는 경우가 많다.외용제로 디트라놀(Dithranol) 크림은 주로 건선(psoriasis) 치료에 사용되는 크림으로, 피부에 자극 반응을 유도함으로써 모발 성장 자극 효과가 보고된 바 있다. 또한 미녹시딜(Minoxidil) 로션은 탈모 부위에 도포하면 일부 환자에서 미세한 모발 성장을 유도할 수 있다.경구용 면역억제제(Sulfasalazine, Methotrexate, Cyclosporine, Azathioprine 등)는 면역 반응을 억제함으로써 기존 치료에 반응하지 않는 중증 원형탈모증 환자에서 제한적으로 사용된다.프로스타글란딘 유사체(Prostaglandin analogs)로 라타노프로스트(Latanoprost), 비마토프로스트(Bimatoprost) 등은 안약 형태 약물이 속눈썹 성장 효과를 보이는 것으로 알려져 있다.JAK 억제제(Baricitinib, Ritlecitinib 등)은 JAK-STAT 신호전달을 차단함으로써 자가면역 반응을 억제하는 작용을 한다.JAK 억제제는 무엇인가? 모낭 상피세포(Follicular epithelial cells)에 MHC class I 분자와 NKG2D 리간드(예: MICA, ULBP 계열)를 비정상적으로 과발현하면, 이는 CD8⁺ NKG2D⁺ T 세포에 의해 인식되어 면역학적 공격의 대상이 된다. 이들 세포는 항원 제시 또는 세포 스트레스 신호에 반응하여 모낭 상피세포와 면역 접합부(immune synapse)를 형성하고, 이를 통해 세포독성 반응을 유도한다.CD8⁺ NKG2D⁺ T 세포는 진피로 침윤하여 모낭 구부(hair follicle bulb) 부위에 분포화되며, IFN-γ를 분비한다. 이는 모낭 상피세포에 발현된 IFN-γ 수용체와 결합하여 JAK1/JAK2 의존적 경로를 활성화시킨다. 이러한 자극은 모낭의 면역 특권을 붕괴시키고, 모발 주기의 퇴행기(catagen phase)로의 전환을 유도한다.동시에, IFN-γ 자극은 모낭 상피세포로 하여금 IL-15를 생성하도록 유도하며, 이 역시 JAK1 및 JAK2 경로를 통해 매개된다. 분비된 IL-15는 CD8⁺ T 세포의 IL-15 수용체에 결합하고, JAK1/JAK3 경로를 통해 추가적으로 IFN-γ 생성을 촉진함으로써, 염증 촉진성 양성 피드백 루프가 증폭된다. 이 루프는 모낭 상피세포의 MHC class I과 NKG2D 리간드(MICA, ULBP-3 등)의 발현을 더욱 촉진하며, 지속적인 자가면역적 공격을 유도하여 원형탈모증의 병태생리에 중심적인 역할을 한다.따라서, IFN-γ는 MHC 분자 및 NKG2D 리간드의 비정상적인 발현을 유도함으로써 면역계에 의한 인식을 촉진하며, IL-15는 자가반응성 기억 T 세포(autoreactive memory T cell)의 생존과 증식을 조절하여 염증 반응을 지속시킨다. 이러한 면역 특권의 병리적 붕괴를 표적으로 하는 치료 전략의 가능성을 전임상 및 임상 연구들에서 제시해왔다.이에, 토파시티닙(Tofacitinib)은 주로 JAK1 및 JAK3를, 룩소리티닙)Ruxolitinib과 바리시티닙(Baricitinib)은 JAK1 및 JAK2를 선택적으로 억제함으로써, 해당 신호전달 경로의 다양한 단계를 차단할 수 있다. 이들 JAK 억제제는 염증 축진성 사이토카인 신호와 면역 활성화 루프를 차단하여, 원형탈모증에서의 염증 반응을 억제하고 모낭 파괴를 완화시키는 기전을 가진 것으로 보고되고 있다(Figure 5). 즉, 이러한 경로의 차단은 면역 특권을 부분적으로 복원하고, 염증세포의 침윤을 억제함으로써 치료적 효과를 보이는 것으로 보고되었다. JAK 억제제는 이러한 염증 신호를 억제함으로써 모낭의 자가면역 공격을 차단하고, 모발 재성장을 유도하는 표적 치료제로 주목받고 있다.현재 국내에서 승인된 JAK 억제제는? 현재 '바리시티닙(Baricitinib, Olumiant®, 릴리)', '리틀레시티닙(Ritlecitinib, Litfulo®, 화이자)'이 중증 원형탈모증(AA) 치료제로 승인되었다. 이들 약제는 모두 모낭 주변의 사이토카인 폭풍을 진정시켜 면역 매개 탈모를 억제하고, 모발 재성장을 촉진하는 기전을 공유한다. 이로써 JAK 억제제는 AA의 치료에 있어 새로운 치료 패러다임으로 자리 잡고 있다.먼저, 바리시티닙은 JAK1/2 억제제로, 2022년 미국 FDA 및 유럽 EMA, 2023년 한국 식약처로부터 성인 중증 원형탈모증 치료제로 승인받았다. 이 약제는 JAK1/2를 억제함으로써 IFN 계열 및 IL-6 등 광범위한 염증 촉진성 사이토카인의 신호전달을 차단한다.이 약제는 3상 BRAVE-AA1 및 BRAVE-AA2 임상시험의 결과를 기반으로 허가되었다. 총 1,200명의 성인을 대상으로 36주간 투여 후 평가한 결과, 4 mg 투여군의 35∼38%가 SALT 점수 ≤20(두피 모발 80% 이상 회복)을 달성하였으며, 이는 위약군(3∼6%) 대비 유의미한 차이를 보였다. 2 mg 투여군도 위약군에 비해 우월한 반응률(19∼23%)을 나타냈으나, 4 mg 투여군보다는 효과가 낮았다. 주된 이상반응은 상기도 감염, 두통, 여드름 등이었으며, 심각한 이상반응 발생률은 낮게 보고되었다.다음, 리틀레시티닙은 JAK3 및 TEC 계열 선택적 억제제로, 2023년 미국 및 유럽에서, 2024년 9월에는 국내에서 12세 이상 청소년 및 성인을 대상으로 한 중증 원형탈모증 치료제로 승인되었다. 이 이 야제는 JAK3 및 TEC를 억제함으로써 IL-2, IL-15 등 γc 공유 수용체 계열 사이토카인의 신호를 선택적으로 조절한다.이 약제는 ALLEGRO 2b/3상 및 ALLEGRO-LT 장기 추적 연구를 통해 임상적 근거가 확보되었으며, ALLEGRO 2b/3상에서는 총 718명의 환자를 대상으로 리틀레시티닙 50 mg 1일 1회 투여 시 24주 후 SALT 점수 ≤20 도달율이 23%로, 위약군(1.6%) 대비 우수하였다. 흔한 이상반응으로는 두통, 설사, 여드름, 발진 등이 있었고, 중대한 이상반응의 빈도는 낮고 대조군과 유사하였다.이러한 결과는 JAK 억제제가 중증 원형탈모증 치료에서 염증 촉진성 사이토카인 경로의 차단을 통해 염증 반응을 조절하고, 이는 모발 재생을 유도하는 효과적인 치료제로 볼 수 있다.듀룩솔리티닙은 어떤 약제인가? 듀룩솔리티닙(제품명: Leqselvi®, Sun Pharma)은 선택적 JAK 1/2 억제제로, 2024년 7월 미국 FDA로부터 ‘성인 중증 원형탈모증’ 치료제로 승인되었다. 이 약제는 기존 JAK 억제제인 룩솔리티닙(Ruxolitinib)의 중수소화 유사체(deuterated analog)로 개발되었으며, 중수소 치환을 통해 약물의 대사적 안정성 및 약동학적 특성을 개선한 것이 특징이다.중수소화(deuteration)는 기존 약물의 특정 수소(H)를 중수소(D)로 대체하는 동등한 생물학적 특성을 갖는 원자 치환 방식으로, 산화적 대사 반응을 늦춰 약물의 반감기를 연장하고, 혈중 농도 변동성을 감소시키며, 유해 대사체 생성을 억제할 수 있다. 이에 따라 이 약제는 구조적으로는 룩솔리티닙과 유사하지만, 약물 노출 유지 및 복용 효율성 측면에서 향상된 약동학적 이점을 갖는 2세대 JAK 억제제로 평가된다.전임상 연구에 따르면, 듀룩솔리티닙은 JAK1, JAK2 및 TYK2에 대해 높은 억제 활성을 나타내며, JAK3에 대해서는 상대적으로 낮은 억제력을 보인다. 하지만 이들 효소에 대한 선택적 억제가 임상 효과에 어떤 기여를 하는지에 대해서는 아직 명확한 인과관계가 확립되지 않았다.임상 적용 시, 듀룩솔리티닙은 다른 JAK 억제제, 생물학적 제제, 사이클로스포린 및 강력한 면역억제제와의 병용은 권장되지 않으며, 단독요법으로의 사용이 권장된다.이 약제는 중대한 감염, 악성 종양, 심혈관 질환, 혈전증 등의 발생 위험이 동반될 수 있어 주의가 필요하다. 이에 따라, 치료 전 잠복 결핵 및 B형 간염 검사, CYP2C9 유전자형 분석이 필요하며, 치료 도중 정기적인 간기능, 혈액학적 검사, 감염 모니터링이 요구된다.듀룩솔리티닙의 기전은? 원형탈모증(AA)의 병인 및 병태생리는 아직 완전히 규명되지 않았으나, 모낭의 면역 특권의 붕괴가 초기 변화로 작용하고, 이후 노출된 자가항원이 자가반응성 CD8⁺ T 세포에 의해 인지되면서 면역반응이 유도되는 기전이 주요한 병리 과정이다. 듀룩솔리티닙의 약리 기전은 첫째, 이 약제는 JAK1과 JAK2를 선택적으로 억제함으로써, 다양한 염증 촉진성 사이토카인(예: IFN-γ, IL-2, IL-6, IL-15 등)의 신호전달을 차단하여 염증 반응을 감소시키고 모발 성장을 증진시킨다. 이러한 사이토카인들은 AA의 병태생리에서 중심적인 역할을 하며, T 세포의 활성화, 자연살해세포(NK cell)의 기능 조절, 모낭 주변의 염증 유도에 관여한다.특히, IFN-γ는 IFN-γ 수용체와 결합하여 모낭의 MHC class I 및 II 발현을 증가시켜 면역 특권을 붕괴시키며, 자가 반응성 CD8⁺ T 세포의 공격을 유도한다. 이 약제는 IFN-γ 수용체 하위의 JAK1/JAK2를 억제함으로써 이러한 과정을 차단한다(Figure 6). 둘째, 이 약제는 JAK-STAT 경로 차단을 통해 MHC 분자의 발현을 감소시키고, 면역세포인 CD8⁺ T 세포의 모낭 접근성을 차단하여 모낭의 면역 특권을 회복시킨다. 이는 자가면역 반응을 완화시키는 데 핵심적이다.셋째, 이 약제는 PD-1(programmed death-1)의 발현을 증가시켜 과활성화된 T 세포의 기능을 억제한다. PD-1은 T 세포의 기능적 소진(T-cell exhaustion)을 유도하는 대표적인 억제 수용체로, 지속적인 자가면역 반응을 억제하는 데 관여한다.넷째, 이 약제는 전임상 모델에서 진피유두세포(human dermal papilla cells)에서 Wnt/β-catenin 경로를 활성화하여 모낭의 성장기(anagen) 재진입을 유도함이 확인되었다. 또한 이 경로를 공유함으로써, 모낭 재생 및 탈모 회복 효과를 병행하는 치료적 우위를 갖는다.듀룩솔리티닙의 허가임상은? 듀룩솔리티닙(LEQSELVI)의 THRIVE-AA1과 2는 다기관, 무작위배정, 이중맹검, 위약 대조 3상 임상시험으로 6개월 이상 두피 탈모가 50% 이상인 성인 원형탈모증 환자 총 1,209명을 대상으로 평가하였다. 시험 대상자들은 24주 동안 이 약제 8mg을 하루 2회, 12mg을 하루 2회, 그리고 위약을 투여받았다.현재 승인된 용량은 8mg 하루 2회이며, 12mg 용량은 승인되지 않았다.베이스 라인에서 환자들의 평균 현재 탈모 에피소드 기간은 약 4년이었으며, 전체의 59%가 '완전 또는 거의 완전한 두피 탈모(두피 탈모 ≥ 95%) 상태였다. 치료군 간 통합된 기저 SALT(Severity of Alopecia Tool, 탈모 중증도 평가척도) 점수는 평균 85.9∼88.6 범위였고, 현재 탈모 에피소드의 평균 지속 기간은 3.7∼3.9년이었다. 이 외에도, 약 73%는 눈썹 탈모가, 70%는 속눈썹 탈모가 있었다.두 임상시험의 1차 평가 변수는 24주 시점에서 SALT 점수 ≤ 20(즉, 두피 모발이 80% 이상 회복된 상태)에 도달한 피험자의 비율이었다. 주요 2차 평가 변수에는 다음이 포함되었다:24주차 SPRO(Satisfaction of Hair Patient- Reported Outcome, 환자 만족도 자기보고 결과)에서 “만족” 또는 “매우 만족”이라고 응답한 비율 8, 12, 16, 20주차에 SALT 점수 ≤ 20을 달성한 피험자의 비율 24주 치료가 종료된 후, 환자들은 장기 연장 연구에 등록할 수 있는 자격이 주어졌다.두피 탈모 평가는 SALT 점수를 기준으로 이루어졌다. 24주 시점에서, 이 약제 8mg을 하루 두 번 복용한 환자군은 위약군에 비해 SALT ≤ 20(두피 모발 80% 이상 회복) 및 SALT ≤ 10(두피 모발 90% 이상 회복)에 도달한 비율이 더 높았다.Clinical Response at Week 24 in Adult Subjects with Severe AA in Trials AA-1 and AA-2 어떤 쟁점이 있는가? 듀룩솔리티닙은 룩솔리티닙(Ruxolitinib)의 중수소화 유도체로 개발된 선택적 JAK1/2 억제제이며, 동일한 표적 선택성을 유지하면서도 약동학적 특성 개선을 목표로 설계되었다. 이 약제는 IFN-γ, IL-15 등 염증 촉진성 사이토카인의 신호 전달을 차단함으로써 모낭에 대한 면역학적 공격을 억제하고, 탈모 진행을 늦추며 모발 재생을 유도한다.국내에 소개된 JAK 억제제 중 바리시티닙은 최초로 승인된 중증 원형탈모증 치료제로, JAK1/2 억제를 통해 자가면역 질환 전반에 적용 가능하지만, 장기 복용에 따른 심혈관계 이상 및 악성종양 발생 위험 등 안전성 우려가 지속적으로 제기되어 왔다.이에 듀룩솔리티닙은 이러한 기존 약물과 달리 2세대 JAK 억제제로서, 특히 8mg 1일 2회 투여 시 우수한 치료 반응을 보였다. 바리시티닙과 리틀레시티닙이 1일 1회 복용 방식인 반면, 듀룩솔리티닙은 1일 2회 복용이 권장되어 혈중 농도 유지와 반응률 개선에는 이점이 있지만, 복약 순응도 측면에서는 불리할 수 있다.임상 유효성(SALT score ≤20 도달률) 측면에서, 바리시티닙 4mg은 36주 후 약 35∼38%, 2mg은 19∼23%, 위약군은 3∼6%, 리틀레시티닙 50mg은 24주 후 23%, 위약군은 1.6%였다. 반면, 듀룩솔리티닙 8mg은 24주 후 약 30%, 위약군은 1% 미만으로 유의한 차이를 나타냈다.추가해서, 듀룩솔리티닙의 경우 고용량(12mg)의 효과는 더 높았으나, 해당 용량은 미국 FDA 승인 대상에서 제외되었으며, 24주 시점의 자료만으로는 장기 안전성과 지속적 유효성을 판단하기에는 제한적이므로, 향후 보완 임상자료 확보가 필요할 것으로 보인다. 8mg 경우에도 감염, 악성 종양, 심혈관 질환, 혈전증 등의 발생 위험이 동반될 수 있어 주의가 필요하다한편, 듀룩솔리티닙의 개발사인 Sun Pharma는 룩솔리티닙의 원 개발사인 Incyte로부터 특허 침해 소송에 직면하였으나, 2025년 4월 9일 미국 연방순회항소법원이 예비 금지 명령을 해제함으로써, 미국 내 시판이 가능해졌다.참고로, 룩솔리티닙은 현재 외용제로 개발되어 2021년 아토피 피부염, 2022년 백반증 치료제로 FDA 승인을 받았으나, 원형탈모증에 대해서는 제한적 효과로 인해 승인되지 않았다.이러한 결과는 듀룩솔리티닙이 룩솔리티닙 대비 구조적 차별성과 약동학적 개선을 기반으로 중증 원형탈모증 치료에서 유의미한 치료 옵션이 될 수 있음을 시사한다.현 상황에서 듀룩솔리티닙은 아직 유럽 EMA의 승인을 받지 않은 상태이다. 따라서 유럽 시장 진입을 위한 추가 임상 데이터와 장기 안전성 자료 확보, 그리고 규제기관의 평가 결과를 주의 깊게 지켜볼 필요가 있다.향후 미국 FDA에서 12mg에 대한 추가 승인 및 유럽 EMA 승인까지 이루어진다면, 국내에서도 긍정적으로 판단될 것으로 예상하며, 이는 중증 원형탈모증 치료 전략의 다양성을 확대하는 데 기여할 것으로 기대된다.참고문헌​ 1. Maddison Lensing, Ali Jabbari “An overview of JAK/STAT pathways and JAK inhibition in alopecia areata” Front Immunol. 2022 Aug 30;13:955035. 2. Melinda Gooderham “Small molecules: an overview of emerging therapeutic options in the treatment of psoriasis“ Skin Therapy Letter 2013;18(7):1-4 3. Michael D. Howell, Fiona I. Kuo, Paul A. Smith ”Targeting the Janus Kinase Family in Autoimmune Skin Diseases“ Front. Immunol. 10:2342(2019). 4. Chen Xue, Qinfan Yao, Xinyu Gu, Qingmiao Shi, et al. “Evolving cognition of the JAK-STAT signaling pathway: autoimmune disorders and cancer“ Signal Transduction and Targeted Therapy 2023;8:204). 5. Dante Dahabreh, Seungyeon Jung, Yael Renert-Yuval, et al. “Alopecia Areata: Current Treatments and New Directions” Am J Clin Dermatol. 2023;24(6):886-912 6. Dagmar Gotthardt, Jana Trifinopoulos, Veronika Sexl and Eva Maria Putz “ JAK/STAT Cytokine Signaling at the Crossroad of NK Cell Development and Maturation” Front. Immunol. 2019;10:2590. 7. 기타 인터넷 자료(보도 자료, 제품 설명서 등)2025-05-30 06:40:26최병철 박사 -
 인터루킨 아토피 신약 '엡글리스', 종병 처방권 진입엡글리스 제품 사진 [데일리팜=어윤호 기자] 아토피피부염 신약 '엡글리스'가 종합병원 처방권에 진입하고 있다.관련 업계에 따르면 한국릴리의 인터루킨(Interleukin, IL)-13억제제 엡글리스(레브리키주맙)는 서울아산병원, 신촌세브란스병원 등 상급종합병원을 비롯해 분당서울대병원 등 전국 9개 의료기관의 약사위원회(DC, Drug committee)를 통과했다.이에 따라 엡글리스가 보험급여 등재에 성공할 경우 빠르게 처방으로 연계될 것으로 전망된다.엡글리스는 지난 2월 건강보험심사평가원 약제급여평가위원회가 제시한 평가금액 이하(대체약제의 가중평균가 이하) 금액을 수용하고 현재 국민공단보험공단과 약가협상을 진행 중이다.이 약이 등재되면 국내 임상현장에서 아토피피부염 치료에 쓸 수 있는 치료옵션은 총 7종이 된다. 생물학적제제(주사제)로 '듀피젠트(두필루맙)', '아트랄자(트랄로키누맙)'가 있으며, JAK억제제(경구제)는 '린버크(유파다시티닙)', '시빈코(아브로시티닙)', '올루미언트(바리시티닙)' 등이 있다.최근 보건당국이 JAK억제제를 기존 치료제(생물학적제제)에 적절히 반응하지 않거나 내약성이 없는 경우에 사용할 수 있도록 허용하는 방안을 추진하고 있는 만큼, 시장 경쟁은 더욱 활발해 질 전망이다. 엡글리스의 경우 등재에 성공하면 곧바로 제도 개선의 혜택을 볼 수 있다.한편 엡글리스는 2024년 8월 식품의약품안전처로부터 성인 및 12세 이상 청소년(체중 40kg 이상)에서 국소치료제로 적절히 조절되지 않거나 이들 치료제가 권장되지 않는 중등도에서 중증의 아토피피부염 치료제로 허가 받았다.엡글리스는 주요 3상 임상 연구를 통해 임상적 유효성 및 안전성 프로파일을 확인했으며, 16주 투여 후 임상 반응을 달성하면 이후 유지 용량(250mg)은 4주마다 투여할 수 있어 국내 아토피피부염 환자들에게 유용한 1차 치료 옵션이 될 것으로 기대된다.허가의 기반이 된 임상 연구는 ADvocate-1, ADvocate-2, ADhere 3상 임상시험이다. 중등도에서 중증 아토피피부염이 있는 성인 및 청소년 1062명의 환자를 대상으로 엡글리스의 임상적 유효성 및 안전성을 평가했다.엡글리스 단독 요법을 평가한 ADvocate-1, ADvocate-2에서 엡글리스군은 유도기간(0~16주) 동안 EASI(Eczema Area and Severity Index, 이하 EASI) 75가 각각 58.8%, 52.1%(위약군 16.2%, 18.1%), EASI 90이 각각 38.3%, 30.7% (위약군 9%, 9.5%)로 위약군 대비 개선됐다.또 1년 간의 유지요법 후(52 주차) 엡글리스군의 EASI 75 도달률은 81.7%(위약군 66.4%), EASI 90 도달률은 66.4%(위약군 41.9%)까지 증가하며 장기 치료에서도 유의미한 증상 개선을 확인했다.2025-05-16 06:00:14어윤호
인터루킨 아토피 신약 '엡글리스', 종병 처방권 진입엡글리스 제품 사진 [데일리팜=어윤호 기자] 아토피피부염 신약 '엡글리스'가 종합병원 처방권에 진입하고 있다.관련 업계에 따르면 한국릴리의 인터루킨(Interleukin, IL)-13억제제 엡글리스(레브리키주맙)는 서울아산병원, 신촌세브란스병원 등 상급종합병원을 비롯해 분당서울대병원 등 전국 9개 의료기관의 약사위원회(DC, Drug committee)를 통과했다.이에 따라 엡글리스가 보험급여 등재에 성공할 경우 빠르게 처방으로 연계될 것으로 전망된다.엡글리스는 지난 2월 건강보험심사평가원 약제급여평가위원회가 제시한 평가금액 이하(대체약제의 가중평균가 이하) 금액을 수용하고 현재 국민공단보험공단과 약가협상을 진행 중이다.이 약이 등재되면 국내 임상현장에서 아토피피부염 치료에 쓸 수 있는 치료옵션은 총 7종이 된다. 생물학적제제(주사제)로 '듀피젠트(두필루맙)', '아트랄자(트랄로키누맙)'가 있으며, JAK억제제(경구제)는 '린버크(유파다시티닙)', '시빈코(아브로시티닙)', '올루미언트(바리시티닙)' 등이 있다.최근 보건당국이 JAK억제제를 기존 치료제(생물학적제제)에 적절히 반응하지 않거나 내약성이 없는 경우에 사용할 수 있도록 허용하는 방안을 추진하고 있는 만큼, 시장 경쟁은 더욱 활발해 질 전망이다. 엡글리스의 경우 등재에 성공하면 곧바로 제도 개선의 혜택을 볼 수 있다.한편 엡글리스는 2024년 8월 식품의약품안전처로부터 성인 및 12세 이상 청소년(체중 40kg 이상)에서 국소치료제로 적절히 조절되지 않거나 이들 치료제가 권장되지 않는 중등도에서 중증의 아토피피부염 치료제로 허가 받았다.엡글리스는 주요 3상 임상 연구를 통해 임상적 유효성 및 안전성 프로파일을 확인했으며, 16주 투여 후 임상 반응을 달성하면 이후 유지 용량(250mg)은 4주마다 투여할 수 있어 국내 아토피피부염 환자들에게 유용한 1차 치료 옵션이 될 것으로 기대된다.허가의 기반이 된 임상 연구는 ADvocate-1, ADvocate-2, ADhere 3상 임상시험이다. 중등도에서 중증 아토피피부염이 있는 성인 및 청소년 1062명의 환자를 대상으로 엡글리스의 임상적 유효성 및 안전성을 평가했다.엡글리스 단독 요법을 평가한 ADvocate-1, ADvocate-2에서 엡글리스군은 유도기간(0~16주) 동안 EASI(Eczema Area and Severity Index, 이하 EASI) 75가 각각 58.8%, 52.1%(위약군 16.2%, 18.1%), EASI 90이 각각 38.3%, 30.7% (위약군 9%, 9.5%)로 위약군 대비 개선됐다.또 1년 간의 유지요법 후(52 주차) 엡글리스군의 EASI 75 도달률은 81.7%(위약군 66.4%), EASI 90 도달률은 66.4%(위약군 41.9%)까지 증가하며 장기 치료에서도 유의미한 증상 개선을 확인했다.2025-05-16 06:00:14어윤호 -
 아토피피부염 신약 '엡글리스', 교체투여 혜택 볼까[데일리팜=어윤호 기자] 아토피치료제 교체 투여 허용 물살과 함께 '엡글리스'가 신규 플레이어로 합류할 수 있을지 주목된다.관련 업계에 따르면 한국릴리는 지난 2월 건강보험심사평가원 약제급여평가위원회가 제시한 엡글리스(레브리키주맙)의 평가금액 이하(대체약제의 가중평균가 이하) 금액을 수용하고 현재 국민공단보험공단과 약가협상을 진행 중이다.엡글리스가 등재되면 국내 임상현장에서 아토피피부염 치료에 쓸 수 있는 치료옵션은 6종이 된다. 생물학적제제(주사제)로 '듀피젠트(두필루맙)', '아트랄자(트랄로키누맙)'가 있으며, JAK억제제(경구제)는 '린버크(유파다시티닙)', '시빈코(아브로시티닙)', '올루미언트(바리시티닙)' 등이 있다.이같은 상황에서 최근 보건당국이 JAK억제제를 기존 치료제(생물학적제제)에 적절히 반응하지 않거나 내약성이 없는 경우에 사용할 수 있도록 허용하는 방안을 추진하면서 시장 경쟁은 더욱 활발해 질 전망이다. 엡글리스의 경우 등재에 성공할 경우 곧바로 제도 개선의 혜택을 볼 수 있다.한편 엡글리스는 2024년 8월 식품의약품안전처로부터 성인 및 12세 이상 청소년(체중 40kg 이상)에서 국소치료제로 적절히 조절되지 않거나 이들 치료제가 권장되지 않는 중등도에서 중증의 아토피피부염 치료제로 허가 받았다.엡글리스는 주요 3상 임상 연구를 통해 임상적 유효성 및 안전성 프로파일을 확인했으며, 16주 투여 후 임상 반응을 달성 하면 이후 유지 용량(250mg)은 4주마다 투여할 수 있어 국내 아토피피부염 환자들에게 유용한 1차 치료 옵션이 될 것으로 기대된다.허가의 기반이 된 임상 연구는 ADvocate-1, ADvocate-2, ADhere 3상 임상시험이다. 중등도에서 중증 아토피피부염이 있는 성인 및 청소년 1062명의 환자를 대상으로 엡글리스의 임상적 유효성 및 안전성을 평가했다.엡글리스 단독 요법을 평가한 ADvocate-1, ADvocate-2에서 엡글리스군은 유도기간(0~16주) 동안 EASI(Eczema Area and Severity Index, 이하 EASI) 75가 각각 58.8%, 52.1%(위약군 16.2%, 18.1%), EASI 90이 각각 38.3%, 30.7% (위약군 9%, 9.5%)로 위약군 대비 개선됐다.또 1년 간의 유지요법 후(52 주차) 엡글리스군의 EASI 75 도달률은 81.7%(위약군 66.4%), EASI 90 도달률은 66.4%(위약군 41.9%)까지 증가하며 장기 치료에서도 유의미한 증상 개선을 확인했다.2025-05-02 06:00:13어윤호
아토피피부염 신약 '엡글리스', 교체투여 혜택 볼까[데일리팜=어윤호 기자] 아토피치료제 교체 투여 허용 물살과 함께 '엡글리스'가 신규 플레이어로 합류할 수 있을지 주목된다.관련 업계에 따르면 한국릴리는 지난 2월 건강보험심사평가원 약제급여평가위원회가 제시한 엡글리스(레브리키주맙)의 평가금액 이하(대체약제의 가중평균가 이하) 금액을 수용하고 현재 국민공단보험공단과 약가협상을 진행 중이다.엡글리스가 등재되면 국내 임상현장에서 아토피피부염 치료에 쓸 수 있는 치료옵션은 6종이 된다. 생물학적제제(주사제)로 '듀피젠트(두필루맙)', '아트랄자(트랄로키누맙)'가 있으며, JAK억제제(경구제)는 '린버크(유파다시티닙)', '시빈코(아브로시티닙)', '올루미언트(바리시티닙)' 등이 있다.이같은 상황에서 최근 보건당국이 JAK억제제를 기존 치료제(생물학적제제)에 적절히 반응하지 않거나 내약성이 없는 경우에 사용할 수 있도록 허용하는 방안을 추진하면서 시장 경쟁은 더욱 활발해 질 전망이다. 엡글리스의 경우 등재에 성공할 경우 곧바로 제도 개선의 혜택을 볼 수 있다.한편 엡글리스는 2024년 8월 식품의약품안전처로부터 성인 및 12세 이상 청소년(체중 40kg 이상)에서 국소치료제로 적절히 조절되지 않거나 이들 치료제가 권장되지 않는 중등도에서 중증의 아토피피부염 치료제로 허가 받았다.엡글리스는 주요 3상 임상 연구를 통해 임상적 유효성 및 안전성 프로파일을 확인했으며, 16주 투여 후 임상 반응을 달성 하면 이후 유지 용량(250mg)은 4주마다 투여할 수 있어 국내 아토피피부염 환자들에게 유용한 1차 치료 옵션이 될 것으로 기대된다.허가의 기반이 된 임상 연구는 ADvocate-1, ADvocate-2, ADhere 3상 임상시험이다. 중등도에서 중증 아토피피부염이 있는 성인 및 청소년 1062명의 환자를 대상으로 엡글리스의 임상적 유효성 및 안전성을 평가했다.엡글리스 단독 요법을 평가한 ADvocate-1, ADvocate-2에서 엡글리스군은 유도기간(0~16주) 동안 EASI(Eczema Area and Severity Index, 이하 EASI) 75가 각각 58.8%, 52.1%(위약군 16.2%, 18.1%), EASI 90이 각각 38.3%, 30.7% (위약군 9%, 9.5%)로 위약군 대비 개선됐다.또 1년 간의 유지요법 후(52 주차) 엡글리스군의 EASI 75 도달률은 81.7%(위약군 66.4%), EASI 90 도달률은 66.4%(위약군 41.9%)까지 증가하며 장기 치료에서도 유의미한 증상 개선을 확인했다.2025-05-02 06:00:13어윤호 -
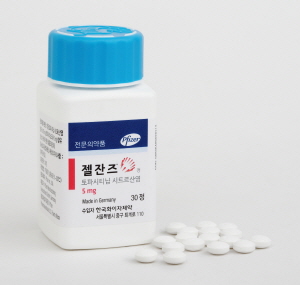 젤잔즈, 소아 특발성관절염 급여시장 최초 진입[데일리팜=어윤호 기자] 젤잔즈가 JAK억제제 최초로 소아 특발성관절염 보험급여 시대를 열었다.보건복지부는 최근 '요양급여의 적용기준 및 방법에 관한 세부사항(약제) 일부개정고시안' 행정예고를 통해 4월부터 한국화이자의 젤잔즈(토파시티닙)의 급여 기준을 확대키로 했다.구체적인 투여 대상은 ILAR 진단기준(2001년 제정)에 부합하는 소아(2~17세) 특발성 관절염 환자로 ▲5개 이상 부종 관절이 있는 다관절형 관절염 ▲확장성 소수 관절염 또는 ▲건선성 관절염에 해당하는 경우로 ▲1종 이상의 생물학적 제제에 반응이 불충분하거나 부작용 등으로 치료를 중단한 환자다.6개월간 사용 후 평가 시 활성 관절수(부종 관절 등)가 최초 투여시점 보다 30% 이상 감소된 경우 추가 6개월간의 사용을 인정하며, 이후에는 6개월마다 평가해 첫 6개월째의 평가 결과가 유지되면 지속적인 투여를 인정한다.이는 JAK억제제 중 최초의 성과다. 현재 한국릴리의 '올루미언트(바리시티닙)'의 경우 지난해 9월 해당 적응증을 확보했지만 비급여 상태며, 한국애브비의 '린버크(유파다시티닙)'는 아직 특발성관절염에 대한 국내 승인이 이뤄지지 않았다.화이자는 젤잔즈의 특허만료에 따라 제형 다변화를 통한 경쟁력 상승을 꿰하고 있다. 이 회사는 지난 2020년 다양한 관절염 치료에서 복용 횟수를 줄인 서방형 제제를 출시한 데 이어, 2023년에는 소아 환자에서 복용 편의를 높인 시럽제를 선보이기도 했다.따라서 선점의 기회를 잡은 젤잔즈가 특발성관절염 영역에서 처방 활성화를 이끌어낼 지 지켜볼 부분이다.한편 젤잔즈는 만 2세 이상, 만 18세 미만 환자 225명을 대상으로 위약군과 효과, 안전성을 비교 평가한 3상 'JIA-I'를 통해 특발성관절염에서 특발성관절염에서 유효성을 입증했다.이 연구에서 임상 18주 동안 젤잔즈 정제 또는 시럽제(용량은 체중 범위에 따름, 5mg 1일 2회 이하)를 투여했고, JIA ACR 30(30% 증상 개선) 반응을 달성한 환자(142명)를 대상으로 다시 젤잔즈와 위약을 나눠 투여했다. 그 결과 44주차 시점에 젤잔즈군(29%, 72명)이 위약군(53%, 70명) 대비 질환 악화가 유의미하게 낮은 것을 확인했다.같은 시점에 JIA ACR30∙50∙70 달성률(30∙50∙70% 증상 개선)도 젤잔즈 군이 유의하게 더 높았다. 소아 건강 평가지(CHAQ)로 확인한 장애 지수 변화도 젤잔즈군(-0.11)이 위약군(0.00) 대비 유의미한 개선을 나타냈다.2025-03-24 06:00:01어윤호
젤잔즈, 소아 특발성관절염 급여시장 최초 진입[데일리팜=어윤호 기자] 젤잔즈가 JAK억제제 최초로 소아 특발성관절염 보험급여 시대를 열었다.보건복지부는 최근 '요양급여의 적용기준 및 방법에 관한 세부사항(약제) 일부개정고시안' 행정예고를 통해 4월부터 한국화이자의 젤잔즈(토파시티닙)의 급여 기준을 확대키로 했다.구체적인 투여 대상은 ILAR 진단기준(2001년 제정)에 부합하는 소아(2~17세) 특발성 관절염 환자로 ▲5개 이상 부종 관절이 있는 다관절형 관절염 ▲확장성 소수 관절염 또는 ▲건선성 관절염에 해당하는 경우로 ▲1종 이상의 생물학적 제제에 반응이 불충분하거나 부작용 등으로 치료를 중단한 환자다.6개월간 사용 후 평가 시 활성 관절수(부종 관절 등)가 최초 투여시점 보다 30% 이상 감소된 경우 추가 6개월간의 사용을 인정하며, 이후에는 6개월마다 평가해 첫 6개월째의 평가 결과가 유지되면 지속적인 투여를 인정한다.이는 JAK억제제 중 최초의 성과다. 현재 한국릴리의 '올루미언트(바리시티닙)'의 경우 지난해 9월 해당 적응증을 확보했지만 비급여 상태며, 한국애브비의 '린버크(유파다시티닙)'는 아직 특발성관절염에 대한 국내 승인이 이뤄지지 않았다.화이자는 젤잔즈의 특허만료에 따라 제형 다변화를 통한 경쟁력 상승을 꿰하고 있다. 이 회사는 지난 2020년 다양한 관절염 치료에서 복용 횟수를 줄인 서방형 제제를 출시한 데 이어, 2023년에는 소아 환자에서 복용 편의를 높인 시럽제를 선보이기도 했다.따라서 선점의 기회를 잡은 젤잔즈가 특발성관절염 영역에서 처방 활성화를 이끌어낼 지 지켜볼 부분이다.한편 젤잔즈는 만 2세 이상, 만 18세 미만 환자 225명을 대상으로 위약군과 효과, 안전성을 비교 평가한 3상 'JIA-I'를 통해 특발성관절염에서 특발성관절염에서 유효성을 입증했다.이 연구에서 임상 18주 동안 젤잔즈 정제 또는 시럽제(용량은 체중 범위에 따름, 5mg 1일 2회 이하)를 투여했고, JIA ACR 30(30% 증상 개선) 반응을 달성한 환자(142명)를 대상으로 다시 젤잔즈와 위약을 나눠 투여했다. 그 결과 44주차 시점에 젤잔즈군(29%, 72명)이 위약군(53%, 70명) 대비 질환 악화가 유의미하게 낮은 것을 확인했다.같은 시점에 JIA ACR30∙50∙70 달성률(30∙50∙70% 증상 개선)도 젤잔즈 군이 유의하게 더 높았다. 소아 건강 평가지(CHAQ)로 확인한 장애 지수 변화도 젤잔즈군(-0.11)이 위약군(0.00) 대비 유의미한 개선을 나타냈다.2025-03-24 06:00:01어윤호 -
 화이자, 새 기전 JAK 억제제 출시…중증원형탈모 시장 공략[데일리팜=황병우 기자] 한국화이자가 새로운 야누스 키나아제(JAK) 억제제인 리트풀로(리트레시티닙토실산염)를 출시하며 중증 원형탈모증 시장 공략에 나선다.앞서 성인 중증 원형탈모증에 국내 최초로 허가받았던 올루미언트(바리시티닙)가 시장에 자리 잡은 상황. 12세 이상 청소년이라는 더 넓은 적응증을 앞세울 것으로 전망된다.원종현 서울아산병원 피부과 교수지난 5일 한국화이자는 중증 원형탈모증 치료제 리트풀로 출시 간담회를 개최하고 임상적 의의를 조명했다.리트풀로는 국내 원형탈모증 치료제 중에는 청소년 환자를 대상으로 처음으로 허가된 의약품으로 지난해 9월 식품의약품안전처 허가를 받았다.원형탈모증은 두피, 얼굴 또는 신체에 반점형 또는 완전 탈모가 나타나는 자가면역질환으로 면역 염증 병인이 있으면서 면역 체계가 신체의 모낭을 공격해 모발이 빠지게 될 때 발생한다.국내에서 원형탈모증으로 진료받은 환자 수는 지난 2013년 15만4380명에서 2023년 17만8009명을 기록하며 최근 10년간 증가 추세를 보였다.일반적으로 증상이 심하지 않은 원형탈모증 대부분은 자연 회복되거나 치료에 잘 반응하지만 흔하게 재발하는 특징을 가지고 있어 약 40~80% 환자가 1년 이내에 재발을 경험하는 것으로 알려져 있다.이날 간담회에 참석한 원종현 서울아산병원 피부과 교수는 "원형탈모는 20년 이내에 환자 100%가 재발을 경험할 정도로 재발률이 높은 질환이다"며 "환자에게 상당한 심리적 부담을 유발하고, 우울증과 같은 정신건강 문제와도 밀접한 관련이 있어 삶의 질에 큰 영향을 미친다"고 설명했다.하지만 리트풀로와 같은 JAK 억제제의 등장으로 치료 환경에도 변화가 있는 상태다. 그동안 스테로이드나 사이클로스포린 등의 치료제를 사용했던 중증 원형탈모에 새로운 옵션이 생긴 만큼 적극적인 치료도 고려되고 있다는 평가다.원 교수는 "새로운 치료제 출시는 오랫동안 원형탈모증으로 고생해 미충족수요가 있는 환자들에게 새로운 희망이다. 의료진에게는 안전한 새 옵션이 등장했다는 측면에서 의미가 있다는 생각이다"고 밝혔다.리트풀로는 글로벌 임상 연구인 ALLEGRO 2b/3상을 바탕으로 허가받았다. 1차 평가 변수인 탈모 중증도 기준(Severity of Alopecia Tool, SALT) 점수 20점 이하 환자 비율을 평가한 결과 치료 24주 시점에서 치료군의 23%가 SALT 점수 20점 이하를 기록해 위약군의 2% 대비 통계적으로 치료 유효성을 나타냈다.또 48주 시점에서 치료군은 SALT 점수 20점 이하인 비율은 43%로서 위약군(10%) 대비 유의미한 치료 유효성을 확인해, 시간 경과에 따라 치료 유효성이 높아지는 경향을 보였다.(왼쪽부터) 원종현 서울아산병원 피부과 교수, 정성범 화이자 의학부 이사 앞서 올루미언트 출시 당시에는 원형탈모 적응증이 비급여 영역임에도 불구하고 미충족수요가 높았던 질환인 만큼 현장의 예상보다 많은 환자가 치료제를 선택하고 있다는 평가를 받았다.반대로 이야기하면 이미 올루미언트가 시장에 자리를 잡은 상황에서 리트풀로가 존재감을 드러내야 하는 과제가 있다.우선 가장 큰 차이점은 기전과 적응증이다. 올루미언트가 JAK1, 2를 표적하는 것과 달리 리트풀로는 JAK3를 중점적으로 표적한다.또 올루미언트는 18세 이상 성인, 리트풀로는 12세 이상 청소년을 대상으로 한다는 점에서 차이가 있다.이에 대해 원 교수는 "2023년 기준 원형탈모증 환자 중 청소년 비율은 10% 정도로 중증을 고려하면 그 수는 줄어들 수 있다. 하지만 이른 나이에 원형탈모증이 생기면 더 오래 치료하고 재발하면서 예후가 나빠질 수 있다는 점에서 조기에 치료할 수 있다는 점은 의미가 크다고 본다"고 말했다.또 원 교수는 현시점에서 기존 치료제와 신규 치료제 간 교체투여 등을 판단하는 것은 시기상조라고 언급했다.그는 "교체투여의 경우 약제의 효과와 안정성을 판단해야 하는 부분으로 아직 명확한 답이 나온 상태는 아니다"며 "기존 약제에 어떤 환자가 더 잘 치료받고 안정성이 오래 갈 수 있는지 확인하는 과정이 더 필요한 단계다"고 덧붙였다.2025-03-05 15:59:18황병우
화이자, 새 기전 JAK 억제제 출시…중증원형탈모 시장 공략[데일리팜=황병우 기자] 한국화이자가 새로운 야누스 키나아제(JAK) 억제제인 리트풀로(리트레시티닙토실산염)를 출시하며 중증 원형탈모증 시장 공략에 나선다.앞서 성인 중증 원형탈모증에 국내 최초로 허가받았던 올루미언트(바리시티닙)가 시장에 자리 잡은 상황. 12세 이상 청소년이라는 더 넓은 적응증을 앞세울 것으로 전망된다.원종현 서울아산병원 피부과 교수지난 5일 한국화이자는 중증 원형탈모증 치료제 리트풀로 출시 간담회를 개최하고 임상적 의의를 조명했다.리트풀로는 국내 원형탈모증 치료제 중에는 청소년 환자를 대상으로 처음으로 허가된 의약품으로 지난해 9월 식품의약품안전처 허가를 받았다.원형탈모증은 두피, 얼굴 또는 신체에 반점형 또는 완전 탈모가 나타나는 자가면역질환으로 면역 염증 병인이 있으면서 면역 체계가 신체의 모낭을 공격해 모발이 빠지게 될 때 발생한다.국내에서 원형탈모증으로 진료받은 환자 수는 지난 2013년 15만4380명에서 2023년 17만8009명을 기록하며 최근 10년간 증가 추세를 보였다.일반적으로 증상이 심하지 않은 원형탈모증 대부분은 자연 회복되거나 치료에 잘 반응하지만 흔하게 재발하는 특징을 가지고 있어 약 40~80% 환자가 1년 이내에 재발을 경험하는 것으로 알려져 있다.이날 간담회에 참석한 원종현 서울아산병원 피부과 교수는 "원형탈모는 20년 이내에 환자 100%가 재발을 경험할 정도로 재발률이 높은 질환이다"며 "환자에게 상당한 심리적 부담을 유발하고, 우울증과 같은 정신건강 문제와도 밀접한 관련이 있어 삶의 질에 큰 영향을 미친다"고 설명했다.하지만 리트풀로와 같은 JAK 억제제의 등장으로 치료 환경에도 변화가 있는 상태다. 그동안 스테로이드나 사이클로스포린 등의 치료제를 사용했던 중증 원형탈모에 새로운 옵션이 생긴 만큼 적극적인 치료도 고려되고 있다는 평가다.원 교수는 "새로운 치료제 출시는 오랫동안 원형탈모증으로 고생해 미충족수요가 있는 환자들에게 새로운 희망이다. 의료진에게는 안전한 새 옵션이 등장했다는 측면에서 의미가 있다는 생각이다"고 밝혔다.리트풀로는 글로벌 임상 연구인 ALLEGRO 2b/3상을 바탕으로 허가받았다. 1차 평가 변수인 탈모 중증도 기준(Severity of Alopecia Tool, SALT) 점수 20점 이하 환자 비율을 평가한 결과 치료 24주 시점에서 치료군의 23%가 SALT 점수 20점 이하를 기록해 위약군의 2% 대비 통계적으로 치료 유효성을 나타냈다.또 48주 시점에서 치료군은 SALT 점수 20점 이하인 비율은 43%로서 위약군(10%) 대비 유의미한 치료 유효성을 확인해, 시간 경과에 따라 치료 유효성이 높아지는 경향을 보였다.(왼쪽부터) 원종현 서울아산병원 피부과 교수, 정성범 화이자 의학부 이사 앞서 올루미언트 출시 당시에는 원형탈모 적응증이 비급여 영역임에도 불구하고 미충족수요가 높았던 질환인 만큼 현장의 예상보다 많은 환자가 치료제를 선택하고 있다는 평가를 받았다.반대로 이야기하면 이미 올루미언트가 시장에 자리를 잡은 상황에서 리트풀로가 존재감을 드러내야 하는 과제가 있다.우선 가장 큰 차이점은 기전과 적응증이다. 올루미언트가 JAK1, 2를 표적하는 것과 달리 리트풀로는 JAK3를 중점적으로 표적한다.또 올루미언트는 18세 이상 성인, 리트풀로는 12세 이상 청소년을 대상으로 한다는 점에서 차이가 있다.이에 대해 원 교수는 "2023년 기준 원형탈모증 환자 중 청소년 비율은 10% 정도로 중증을 고려하면 그 수는 줄어들 수 있다. 하지만 이른 나이에 원형탈모증이 생기면 더 오래 치료하고 재발하면서 예후가 나빠질 수 있다는 점에서 조기에 치료할 수 있다는 점은 의미가 크다고 본다"고 말했다.또 원 교수는 현시점에서 기존 치료제와 신규 치료제 간 교체투여 등을 판단하는 것은 시기상조라고 언급했다.그는 "교체투여의 경우 약제의 효과와 안정성을 판단해야 하는 부분으로 아직 명확한 답이 나온 상태는 아니다"며 "기존 약제에 어떤 환자가 더 잘 치료받고 안정성이 오래 갈 수 있는지 확인하는 과정이 더 필요한 단계다"고 덧붙였다.2025-03-05 15:59:18황병우 -
 아토피, 3월부터 'JAK억제제-생물제제' 교체투여 급여[데일리팜=이정환 기자] 중증 아토피피부염 치료제의 건강보험 급여 기준이 3월 1일부터 확대된다. 그간 허용되지 않았던 JAK억제제와 생물학적제제 간 교체투여 시 건보급여가 허용되는 게 핵심이다.보건복지부는 약제 요양급여 적용기준 일부 개정안을 행정예고했다고 20일 밝혔다.아토피 치료제는 JAK억제제인 애브비 린버크(성분명 유파다시티닙), 릴리 올루미언트(성분명 바리시티닙), 화이자 시빈코(성분명 아브로시티닙) 등과 생물학적제제인 사노피 듀피젠트(성분명 두필루맙), 레오파마 아트랄자(성분명 트랄로키누맙) 등이 국내 시판허가됐다.복지부는 이번 행정예고에서 기존 치료제인 생물학적제제 투여에도 아토피 질환에 적절히 반응하지 않거나 내약성이 없는 경우 JAK억제제로 교체해도 급여를 적용하도록 기준을 개선했다.JAK억제제에 효과가 없거나 부작용 등으로 투약을 지속할 수 없는 경우(교체한 약제는 최소 6개월 투여 유지권고)엔 생물학적 제제로 교체투여가 가능하다.이 때 의료진은 투여소견서를 첨부해야 한다. 단 JAK억제제 간 교체투여는 급여가 인정되지 않는다.생물학적제제 역시 치료 효과가 없거나 부작용 등으로 투약을 지속할 수 없는 경우 JAK억제제로 교체투여가 가능하다. 다만 듀피젠트와 아트랄자 교체투여는 급여가 인정되지 않는다.한편 JAK억제제 허가 사항은 '65세 이상 환자를 비롯한 일부 환자에서 기존 치료제로 치료에 실패한 경우'로 규정중으로 투여 대상에서 제외됐었지만 교체투여가 허용된 이후부터는 해당 환자군에서도 투여가 가능해진다.2025-02-20 10:58:10이정환
아토피, 3월부터 'JAK억제제-생물제제' 교체투여 급여[데일리팜=이정환 기자] 중증 아토피피부염 치료제의 건강보험 급여 기준이 3월 1일부터 확대된다. 그간 허용되지 않았던 JAK억제제와 생물학적제제 간 교체투여 시 건보급여가 허용되는 게 핵심이다.보건복지부는 약제 요양급여 적용기준 일부 개정안을 행정예고했다고 20일 밝혔다.아토피 치료제는 JAK억제제인 애브비 린버크(성분명 유파다시티닙), 릴리 올루미언트(성분명 바리시티닙), 화이자 시빈코(성분명 아브로시티닙) 등과 생물학적제제인 사노피 듀피젠트(성분명 두필루맙), 레오파마 아트랄자(성분명 트랄로키누맙) 등이 국내 시판허가됐다.복지부는 이번 행정예고에서 기존 치료제인 생물학적제제 투여에도 아토피 질환에 적절히 반응하지 않거나 내약성이 없는 경우 JAK억제제로 교체해도 급여를 적용하도록 기준을 개선했다.JAK억제제에 효과가 없거나 부작용 등으로 투약을 지속할 수 없는 경우(교체한 약제는 최소 6개월 투여 유지권고)엔 생물학적 제제로 교체투여가 가능하다.이 때 의료진은 투여소견서를 첨부해야 한다. 단 JAK억제제 간 교체투여는 급여가 인정되지 않는다.생물학적제제 역시 치료 효과가 없거나 부작용 등으로 투약을 지속할 수 없는 경우 JAK억제제로 교체투여가 가능하다. 다만 듀피젠트와 아트랄자 교체투여는 급여가 인정되지 않는다.한편 JAK억제제 허가 사항은 '65세 이상 환자를 비롯한 일부 환자에서 기존 치료제로 치료에 실패한 경우'로 규정중으로 투여 대상에서 제외됐었지만 교체투여가 허용된 이후부터는 해당 환자군에서도 투여가 가능해진다.2025-02-20 10:58:10이정환 -
![[기자의 눈] 아토피 교차투여 절반의 진전과 한계](https://pds.dailypharm.com/news_image/202502/320488_1.jpg) [기자의 눈] 아토피 교차투여 절반의 진전과 한계[데일리팜=황병우 기자] 아토피피부염 치료제 간 급여적용이 가시화 되면서 기대가 커지고 있다.건강보험심사평가원이 사전약가인하 제도를 통해 검토를 완료했고, 건강보험공단 협상만 남은 상황이다.예상 청구액 규모가 크지 않아 협상이 무리 없이 완료될 것이라는 게 업계의 관측이다. 급여 확대는 빠르면 1분기 이내에 이뤄질 것으로 전망된다.아토피 신약이 늘어나면서 치료제 간 교체투여의 필요성은 지속적으로 강조됐다. 여러 요인이 복합적으로 작용하는 다인성질환인 아토피 특성상 같은 약을 사용하더라도 환자마다 효과가 다르게 나타날 수 있다는 것이 그 이유다.이러한 측면에서 치료제 간 교체투여는 아토피 환자들에게 실질적인 도움이 될 것으로 예상된다.아토피 치료제의 급여 확대는 반길만한 요소이지만 절반의 진전이라는 평가를 받고 있다. 아직 같은 계열의 치료제 간 교체투여라는 과제를 남겼기 때문이다.이번 교차투여 결정의 핵심은 생물학적제제와 JAK 억제제 간 교차투여다. 현재 아토피 치료제는 생물학적제제로는 듀피젠트(두필루맙), 아트랄자(트랄로키누맙)가 있고, JAK 억제제는 린버크(유파다시티닙), 올루미언트(바리시티닙), 시빈코(아브로시티닙) 등이 존재한다.치료제는 각각의 치료기전을 가지고 있으며, 환자 개개인의 반응 또한 다르게 나타나는 것으로 알려져 있다.그런데도 교차투여가 여전히 절반의 성과에 그쳤다는 점은 아쉬움으로 남는 대목이다. 전문가들은 이 같은 제한점이 아토피 치료의 유연성을 제한하고 환자의 치료 선택권에도 한계가 존재한다고 지적한다.지난해 9년 만에 바뀐 '한국 아토피피부염 치료 가이드라인'에서도 다른 계열 치료제뿐만 아니라 같은 계열 내 치료제에도 교차투여를 제한하지 않았다. 같은 피부과 영역의 건선과 비교해도 이번 급여확대는 여전히 한계가 존재하고 있다.즉, 아토피 치료제의 급여 범위를 넓힘으로써 환자의 부담을 줄이고자 하는 정부의 구상에도 완전히 부합하지 않다는 게 전문가의 판단이다.전문가는 아토피 치료에 있어서 개인의 특성을 더욱 세심하게 고려할 필요가 있다고 강조하고 있다. 단순히 증상 개선을 떠나 병변 부위, 생활방식 등 복합적인 요소가 치료제 선택에 반영된다는 의미다.중증아토피피부염연합회 측은 "아토피 특성상 환자가 가지고 있는 원인이 다른 상황에서 교체투여의 기회가 한정된다면 환자 관점에서 치료제를 전환하는 것도 쉽지 않다"며 "아토피 치료 환경 개선이 논의 된다면 교체투여 시, 계열과 횟수에 대한 제한이 없어야 한다"고 밝혔다.아토피 치료제 급여 확대는 환자들에게 혜택을 주는 중요한 진전이지만, 더욱 광범위한 관점에서 이 문제를 바라봐야 한다는 요구도는 높다.제도 개선의 속도 조절도 중요하지만, 대외적으로 알려질 것처럼 예상 청구액 규모가 크지 않다면 좀 더 전향적이고 심도 있는 논의와 정책적 접근이 필요한 시점이다.2025-02-19 06:00:07황병우
[기자의 눈] 아토피 교차투여 절반의 진전과 한계[데일리팜=황병우 기자] 아토피피부염 치료제 간 급여적용이 가시화 되면서 기대가 커지고 있다.건강보험심사평가원이 사전약가인하 제도를 통해 검토를 완료했고, 건강보험공단 협상만 남은 상황이다.예상 청구액 규모가 크지 않아 협상이 무리 없이 완료될 것이라는 게 업계의 관측이다. 급여 확대는 빠르면 1분기 이내에 이뤄질 것으로 전망된다.아토피 신약이 늘어나면서 치료제 간 교체투여의 필요성은 지속적으로 강조됐다. 여러 요인이 복합적으로 작용하는 다인성질환인 아토피 특성상 같은 약을 사용하더라도 환자마다 효과가 다르게 나타날 수 있다는 것이 그 이유다.이러한 측면에서 치료제 간 교체투여는 아토피 환자들에게 실질적인 도움이 될 것으로 예상된다.아토피 치료제의 급여 확대는 반길만한 요소이지만 절반의 진전이라는 평가를 받고 있다. 아직 같은 계열의 치료제 간 교체투여라는 과제를 남겼기 때문이다.이번 교차투여 결정의 핵심은 생물학적제제와 JAK 억제제 간 교차투여다. 현재 아토피 치료제는 생물학적제제로는 듀피젠트(두필루맙), 아트랄자(트랄로키누맙)가 있고, JAK 억제제는 린버크(유파다시티닙), 올루미언트(바리시티닙), 시빈코(아브로시티닙) 등이 존재한다.치료제는 각각의 치료기전을 가지고 있으며, 환자 개개인의 반응 또한 다르게 나타나는 것으로 알려져 있다.그런데도 교차투여가 여전히 절반의 성과에 그쳤다는 점은 아쉬움으로 남는 대목이다. 전문가들은 이 같은 제한점이 아토피 치료의 유연성을 제한하고 환자의 치료 선택권에도 한계가 존재한다고 지적한다.지난해 9년 만에 바뀐 '한국 아토피피부염 치료 가이드라인'에서도 다른 계열 치료제뿐만 아니라 같은 계열 내 치료제에도 교차투여를 제한하지 않았다. 같은 피부과 영역의 건선과 비교해도 이번 급여확대는 여전히 한계가 존재하고 있다.즉, 아토피 치료제의 급여 범위를 넓힘으로써 환자의 부담을 줄이고자 하는 정부의 구상에도 완전히 부합하지 않다는 게 전문가의 판단이다.전문가는 아토피 치료에 있어서 개인의 특성을 더욱 세심하게 고려할 필요가 있다고 강조하고 있다. 단순히 증상 개선을 떠나 병변 부위, 생활방식 등 복합적인 요소가 치료제 선택에 반영된다는 의미다.중증아토피피부염연합회 측은 "아토피 특성상 환자가 가지고 있는 원인이 다른 상황에서 교체투여의 기회가 한정된다면 환자 관점에서 치료제를 전환하는 것도 쉽지 않다"며 "아토피 치료 환경 개선이 논의 된다면 교체투여 시, 계열과 횟수에 대한 제한이 없어야 한다"고 밝혔다.아토피 치료제 급여 확대는 환자들에게 혜택을 주는 중요한 진전이지만, 더욱 광범위한 관점에서 이 문제를 바라봐야 한다는 요구도는 높다.제도 개선의 속도 조절도 중요하지만, 대외적으로 알려질 것처럼 예상 청구액 규모가 크지 않다면 좀 더 전향적이고 심도 있는 논의와 정책적 접근이 필요한 시점이다.2025-02-19 06:00:07황병우 -
 아토피치료제 교차투여 급여 목전…공단 협상 단계로[데일리팜=이탁순 기자] 아토피피부염 치료제 간 교차투여 급여적용이 조만간 현실화될 전망이다. 심평원이 사전약가인하 제도를 통해 검토를 완료했고, 이제 건보공단 협상만 남았기 때문이다. 예상청구액 규모가 크지 않아 협상도 무리없이 완료될 것으로 전망된다.3일 업계에 따르면 생물학적제제와 JAK 억제제 간 교차투여 급여 확대에 대해 심평원은 사전약가인하 제도를 통해 검토를 완료해 복지부에 보고했다.지난 1월 9일 열린 약제급여평가위원회에서 급여적정성이 인정된 후 제약사 의견청취 후 검토를 마무리한 것이다. 관련 제약사들은 별도의 이의신청서를 제출하지 않은 것으로 전해진다.사용범위 확대의 경우 예상 추가청구액이 15억원 미만이면 약가인하가 미적용되고, 15억원 이상 100억원 미만이면 사전약가인하, 100억원 이상이면 약가협상을 진행하게 된다.이번 생물학적제제와 JAK 억제제 간 교차투여는 사전약가인하 대상으로, 산식에 따라 개별 제품들의 약가인하율이 결정됐다.대상품목은 생물학적제제로는 듀피젠트(두필루맙), 아트랄자(트랄로키누맙)가 있고, JAK 억제제는 린버크(유파다시티닙), 올루미언트(바리시티닙), 시빈코(아브로시티닙) 등이다.교차투여가 허용되면 생물학적제제를 사용하다 JAK 억제제로 넘어가는 경우가 다수여서 JAK 억제제의 청구액이 증가할 가능성이 높은 것으로 알려졌다. 하지만 예상 추가 청구액이 높은 수준은 아닌 것으로 파악된다.이에 대부분 약제가 약가 협상없이 산식에 따라 결정된 약가인하율이 결정될 수도 있다는 분석이다. 공단 협상에 들어간다 해도 예상 추가 청구액 수준이 낮아 수월하게 합의될 것으로 업계는 보고 있다. 빠르면 2월말 건정심 보고 통해 3월 등재도 가능하다는 분석이다.한편 현재 급여기준은 중증 아토피 피부염 환자들이 생물학적제제 또는 JAK 억제제를 사용했을 때 타 계열 약제로 교체하려면 3개월간 1차 치료제를 투여하고 EASI(Eczema Area and Severity Index) 23 이상이라는 기준을 충족해야 한다. 이 때문에 부작용이 생기거나 치료효과가 없더라도 바로 교체투여하기가 어려워 의료현장에서는 조건없이 교차 투여에 대한 급여를 촉구해 왔다.보건당국은 작년부터 생물학적 제제와 JAK억제제 간 교차투여 급여 확대를 검토해 왔다.생물학적제제-JAK 억제제 급여 확대2025-02-03 17:02:00이탁순
아토피치료제 교차투여 급여 목전…공단 협상 단계로[데일리팜=이탁순 기자] 아토피피부염 치료제 간 교차투여 급여적용이 조만간 현실화될 전망이다. 심평원이 사전약가인하 제도를 통해 검토를 완료했고, 이제 건보공단 협상만 남았기 때문이다. 예상청구액 규모가 크지 않아 협상도 무리없이 완료될 것으로 전망된다.3일 업계에 따르면 생물학적제제와 JAK 억제제 간 교차투여 급여 확대에 대해 심평원은 사전약가인하 제도를 통해 검토를 완료해 복지부에 보고했다.지난 1월 9일 열린 약제급여평가위원회에서 급여적정성이 인정된 후 제약사 의견청취 후 검토를 마무리한 것이다. 관련 제약사들은 별도의 이의신청서를 제출하지 않은 것으로 전해진다.사용범위 확대의 경우 예상 추가청구액이 15억원 미만이면 약가인하가 미적용되고, 15억원 이상 100억원 미만이면 사전약가인하, 100억원 이상이면 약가협상을 진행하게 된다.이번 생물학적제제와 JAK 억제제 간 교차투여는 사전약가인하 대상으로, 산식에 따라 개별 제품들의 약가인하율이 결정됐다.대상품목은 생물학적제제로는 듀피젠트(두필루맙), 아트랄자(트랄로키누맙)가 있고, JAK 억제제는 린버크(유파다시티닙), 올루미언트(바리시티닙), 시빈코(아브로시티닙) 등이다.교차투여가 허용되면 생물학적제제를 사용하다 JAK 억제제로 넘어가는 경우가 다수여서 JAK 억제제의 청구액이 증가할 가능성이 높은 것으로 알려졌다. 하지만 예상 추가 청구액이 높은 수준은 아닌 것으로 파악된다.이에 대부분 약제가 약가 협상없이 산식에 따라 결정된 약가인하율이 결정될 수도 있다는 분석이다. 공단 협상에 들어간다 해도 예상 추가 청구액 수준이 낮아 수월하게 합의될 것으로 업계는 보고 있다. 빠르면 2월말 건정심 보고 통해 3월 등재도 가능하다는 분석이다.한편 현재 급여기준은 중증 아토피 피부염 환자들이 생물학적제제 또는 JAK 억제제를 사용했을 때 타 계열 약제로 교체하려면 3개월간 1차 치료제를 투여하고 EASI(Eczema Area and Severity Index) 23 이상이라는 기준을 충족해야 한다. 이 때문에 부작용이 생기거나 치료효과가 없더라도 바로 교체투여하기가 어려워 의료현장에서는 조건없이 교차 투여에 대한 급여를 촉구해 왔다.보건당국은 작년부터 생물학적 제제와 JAK억제제 간 교차투여 급여 확대를 검토해 왔다.생물학적제제-JAK 억제제 급여 확대2025-02-03 17:02:00이탁순 -
 아토피약 교차 투여 급물살…듀피젠트·올루미언트 수용[데일리팜=이탁순 기자] 아토피피부염 치료제 간 교차투여 급여확대가 속도가 붙을 전망이다. 조만간 심평원을 넘어 건보공단과 협상 단계로 넘어갈 것으로 예상된다.30일 업계에 따르면 지난 9일 열린 심평원 약제급여평가위원회(약평위)에서 아토피피부염 치료제 간 교차투여 안건이 상정돼 급여적정성이 인정됐고, 이후 듀피젠트, 올루미언트가 결과를 수용했다.다만 나머지 약제들이 결과를 수용했는지 여부는 알려지지 않았다. 아토피피부염 치료제 교차투여 안건은 생물학적제제와 JAK 억제제 간 교차투여에 대한 급여 인정 여부를 다루고 있다.현재는 교차투여에 대한 급여 적용이 어려워 현장에서 환자 치료에 불편을 겪고 있다. 이에 학회 등에서 꾸준히 교차투여 급여확대를 요구해왔고, 보건당국은 작년부터 검토하고 있다.지난해 10월 심평원은 전문가 논의 등을 통해 급여기준을 마련했고, 관련 제약사들로부터 재정영향 분석서를 받아 관련 절차를 서두르겠다고 밝힌 바 있다. 이후 제약사의 의견을 받아 심평원 내부 검토가 완료된 뒤 지난 9일 약평위에 안건으로 올라온 것으로 알려졌다.약평위는 급여적정성이 있다고 판단한 것으로 전해진다. 급여확대 대상 품목은 생물학적제제로는 듀피젠트(두필루맙), 아트랄자(트랄로키누맙)가 있고, JAK 억제제는 린버크(유파다시티닙), 올루미언트(바리시티닙), 시빈코(아브로시티닙) 등이 있다.이 가운데 듀피젠트와 올루미언트가 약평위 결과를 수용한 것으로 전해진다. 이는 급여적정성에 따른 사전 약가인하를 수용한 것으로 풀이된다. 다만, 나머지 품목은 수용 여부가 확인되지 않았다.제약사들이 약평위 결과를 수용하면 이후 복지부 협상명령에 따라 건보공단과 협상이 진행된다. 이번 교차투여로 막대한 건보재정 소요가 예상되는 만큼 공단 협상이 급여 확대의 마지막 관건이 될 것이라 전망이 나온다.2025-01-30 17:43:55이탁순
아토피약 교차 투여 급물살…듀피젠트·올루미언트 수용[데일리팜=이탁순 기자] 아토피피부염 치료제 간 교차투여 급여확대가 속도가 붙을 전망이다. 조만간 심평원을 넘어 건보공단과 협상 단계로 넘어갈 것으로 예상된다.30일 업계에 따르면 지난 9일 열린 심평원 약제급여평가위원회(약평위)에서 아토피피부염 치료제 간 교차투여 안건이 상정돼 급여적정성이 인정됐고, 이후 듀피젠트, 올루미언트가 결과를 수용했다.다만 나머지 약제들이 결과를 수용했는지 여부는 알려지지 않았다. 아토피피부염 치료제 교차투여 안건은 생물학적제제와 JAK 억제제 간 교차투여에 대한 급여 인정 여부를 다루고 있다.현재는 교차투여에 대한 급여 적용이 어려워 현장에서 환자 치료에 불편을 겪고 있다. 이에 학회 등에서 꾸준히 교차투여 급여확대를 요구해왔고, 보건당국은 작년부터 검토하고 있다.지난해 10월 심평원은 전문가 논의 등을 통해 급여기준을 마련했고, 관련 제약사들로부터 재정영향 분석서를 받아 관련 절차를 서두르겠다고 밝힌 바 있다. 이후 제약사의 의견을 받아 심평원 내부 검토가 완료된 뒤 지난 9일 약평위에 안건으로 올라온 것으로 알려졌다.약평위는 급여적정성이 있다고 판단한 것으로 전해진다. 급여확대 대상 품목은 생물학적제제로는 듀피젠트(두필루맙), 아트랄자(트랄로키누맙)가 있고, JAK 억제제는 린버크(유파다시티닙), 올루미언트(바리시티닙), 시빈코(아브로시티닙) 등이 있다.이 가운데 듀피젠트와 올루미언트가 약평위 결과를 수용한 것으로 전해진다. 이는 급여적정성에 따른 사전 약가인하를 수용한 것으로 풀이된다. 다만, 나머지 품목은 수용 여부가 확인되지 않았다.제약사들이 약평위 결과를 수용하면 이후 복지부 협상명령에 따라 건보공단과 협상이 진행된다. 이번 교차투여로 막대한 건보재정 소요가 예상되는 만큼 공단 협상이 급여 확대의 마지막 관건이 될 것이라 전망이 나온다.2025-01-30 17:43:55이탁순 -
 케이캡·엔트레스토·올루미언트·린버크, PVA 계약 합의HK이노엔 [데일리팜=이탁순 기자] 국산 P-CAB 계열 위식도역류질환 치료제 '케이캡정(테고프라잔, HK이노엔)'과 심부전 치료제 '엔트레스토필름코팅정(사쿠비트릴·발사르탄나르륨염수화물, 노바티스)', 경구용 JAK 억제제 '올루미언트정(바리시티닙, 릴리)', 린버크서방정(유파다시티닙반수화물, 애브비)이 건강보험공단과 사용량-약가 연동 협상(PVA) 계약에 합의했다.이에따라 케이캡은 환급액이 조정됐고, 엔트레스토와 올루미언트는 내달 상한금액이 인하된다.27일 업계에 따르면 3개 제품은 최근 건보공단과 PVA 유형 나 협상에 합의해 환급·상한금액이 조정된다.케이캡은 지난 2021년부터 건보공단과 사용량-약가 연동 협상 환급계약을 체결해 진행하고 있다. 이 계약에 따라 제약사는 상한금액 인하 대신 사용량 증가에 해당하는 금액을 공단에 환급하고 있다. 이번 계약 합의로 환급분이 조정됐을 것으로 보인다.케이캡은 환급 계약 이후 지금껏 두 번의 사용량-약가 연동 협상을 진행해 공단에 사용량 증가분에 대한 금액을 환급했다. 환급계약으로 2019년 등재 시 상한금액인 정당 1300원이 유지되고 있다.심부전치료제 엔트레스토는 PVA를 통해 3개 제품 종전 상한금액 정당 1683원에서 1599원으로 인하된다. 엔트레스토는 2023년 아이큐비아 기준 판매액 594억원을 기록, 전년대비 29% 성장했다.릴리 올루미언트도 성장세에 힘입어 PVA를 비껴가지 못했다. 올루미언트도 작년 179억원을 기록, 전년대비 16% 성장했다. 이번 계약으로 4mg 정제는 2만635원에서 2만172원, 2mg 정제는 1만3757원에서 1만3448원으로 인하된다.또다른 JAK억제제 린버크서방정도 PVA 유형 나 협상을 통해 상한금액이 인하된다. 15mg 제품은 1만9831원에서 1만8740원으로, 30mg 제품은 3만1628원에서 2만9850원으로 조정된다. 린버크서방정은 작년 아이큐비아 기준 판매액 207억원으로 전년대비 81% 실적이 증가했다.유형 나 협상은 유형 가에 의해 상한금액이 조정됐거나 유형 가 협상을 하지 않고 최초 등재일 혹은 상한금액이 협상을 통해 조정된 날로부터 4년이 지난 동일제품군의 청구액이 전년도 청구액보다 60% 이상 증가했거나, 10% 이상 증가했으며 그 증가액이 50억원 이상인 경우 진행된다.이밖에 얀센의 자가면역질환 치료제 트렘피어프리필드시린지주(구셀쿠맙) 등 2개 제품도 PVA 유형 나 협상을 통해 상한금액이 인하된다. 2년 연속이다.이에따라 트렘피어프리필드시린지주와 트렘피어원프레스오토인젝터주 상한금액이 154만9300원에서 152만4511원으로 조정된다.사노피의 B형 혈우병 치료제 알프로릭스주 5개 제품도 PVA 유형 나를 통해 상한금액이 1181원에서 1108원으로 인하된다. 이들 제품의 상한금액 조정일은 2025년 1월 1일이다.2024-12-27 10:06:38이탁순
케이캡·엔트레스토·올루미언트·린버크, PVA 계약 합의HK이노엔 [데일리팜=이탁순 기자] 국산 P-CAB 계열 위식도역류질환 치료제 '케이캡정(테고프라잔, HK이노엔)'과 심부전 치료제 '엔트레스토필름코팅정(사쿠비트릴·발사르탄나르륨염수화물, 노바티스)', 경구용 JAK 억제제 '올루미언트정(바리시티닙, 릴리)', 린버크서방정(유파다시티닙반수화물, 애브비)이 건강보험공단과 사용량-약가 연동 협상(PVA) 계약에 합의했다.이에따라 케이캡은 환급액이 조정됐고, 엔트레스토와 올루미언트는 내달 상한금액이 인하된다.27일 업계에 따르면 3개 제품은 최근 건보공단과 PVA 유형 나 협상에 합의해 환급·상한금액이 조정된다.케이캡은 지난 2021년부터 건보공단과 사용량-약가 연동 협상 환급계약을 체결해 진행하고 있다. 이 계약에 따라 제약사는 상한금액 인하 대신 사용량 증가에 해당하는 금액을 공단에 환급하고 있다. 이번 계약 합의로 환급분이 조정됐을 것으로 보인다.케이캡은 환급 계약 이후 지금껏 두 번의 사용량-약가 연동 협상을 진행해 공단에 사용량 증가분에 대한 금액을 환급했다. 환급계약으로 2019년 등재 시 상한금액인 정당 1300원이 유지되고 있다.심부전치료제 엔트레스토는 PVA를 통해 3개 제품 종전 상한금액 정당 1683원에서 1599원으로 인하된다. 엔트레스토는 2023년 아이큐비아 기준 판매액 594억원을 기록, 전년대비 29% 성장했다.릴리 올루미언트도 성장세에 힘입어 PVA를 비껴가지 못했다. 올루미언트도 작년 179억원을 기록, 전년대비 16% 성장했다. 이번 계약으로 4mg 정제는 2만635원에서 2만172원, 2mg 정제는 1만3757원에서 1만3448원으로 인하된다.또다른 JAK억제제 린버크서방정도 PVA 유형 나 협상을 통해 상한금액이 인하된다. 15mg 제품은 1만9831원에서 1만8740원으로, 30mg 제품은 3만1628원에서 2만9850원으로 조정된다. 린버크서방정은 작년 아이큐비아 기준 판매액 207억원으로 전년대비 81% 실적이 증가했다.유형 나 협상은 유형 가에 의해 상한금액이 조정됐거나 유형 가 협상을 하지 않고 최초 등재일 혹은 상한금액이 협상을 통해 조정된 날로부터 4년이 지난 동일제품군의 청구액이 전년도 청구액보다 60% 이상 증가했거나, 10% 이상 증가했으며 그 증가액이 50억원 이상인 경우 진행된다.이밖에 얀센의 자가면역질환 치료제 트렘피어프리필드시린지주(구셀쿠맙) 등 2개 제품도 PVA 유형 나 협상을 통해 상한금액이 인하된다. 2년 연속이다.이에따라 트렘피어프리필드시린지주와 트렘피어원프레스오토인젝터주 상한금액이 154만9300원에서 152만4511원으로 조정된다.사노피의 B형 혈우병 치료제 알프로릭스주 5개 제품도 PVA 유형 나를 통해 상한금액이 1181원에서 1108원으로 인하된다. 이들 제품의 상한금액 조정일은 2025년 1월 1일이다.2024-12-27 10:06:38이탁순 -
 저용량 아스피린+PPI에 고함량 은행엽·디오스민까지[데일리팜=이혜경 기자] 기존 위산 분비 억제제로 사용되던 양성자 펌프 억제제(PPI)와 저용량 아스피린을 성분으로 하는 복합제 허가가 이어지고 있습니다. 지난해 한미약품이 선보인 '라스피린'에 이어 올해에만 동광제약, 한국파마, 휴온스, 영진약품, 지엘파마 등이 저용량 라베프라졸 복합제 시장에 뛰어들었습니다.지난달에는 국내 원형탈모증 치료제 중 청소년 환자를 대상으로 승인된 최초이자 유일한 의약품인 한국화이자제약의 '리트풀로캡슐50mg' 허가도 눈에 띕니다.일반의약품에서는 고함량 뇌기능개선제 '은행엽건조엑스'제제와 치질 치료제 성분의 '디오스민' 고함량 허가도 진행됐습니다. 식약처의 9월 허가 현황을 보면, 일반의약품 51개 품목, 전문의약품 35개 품목 등 총 86개 품목이 허가를 받았습니다.식약처는 매달 의료제품 허가현황을 공개하고 있는데, 정보공개 대상은 신약, 자료제출의약품, 조건부 허가 의약품 등에 한정하고 있습니다.◆일반의약품=지난 9월 허가(신고)된 일반약은 모두 51개 품목으로 나타났습니다.제조법을 공인한 표준제조기준 품목이 24개 품목, 제네릭 등 기타품목이 27개 품목을 보였습니다. 마더스제약 '깅코라민정240mg' (9월 2일 허가, 제네릭)하루 한 알 복용하는 고함량 은행엽건조엑스 제제가 지난달에만 9개 회사의 9개 품목이 허가를 받았습니다.마더스제약의 '깅코라민정', 제일헬스사이언스의 '제일진코심정', 구주제약의 '바소필정', 한미약품의 '한미징코정', 한국휴텍스제약의 '징코에프정', 아이월드제약의 '징코리프정', 케이에스제약의 '징코에스정', 화이트생명과학의 '징코뉴로정', 한국피엠지제약의 '바넥신정' 등이 주인공입니다.고함량 은행엽건조엑스 제제는 2020년 11월 풍림무약의 '징코필정'이 첫 제품인데, 최근까지 50여개 품목이 허가를 받으면서 인기를 이어가고 있습니다.은행엽건조엑스 제제는 저용량은 40mg부터 80mg, 120mg, 240mg 용량으로 허가를 받은 상태입니다.기존 용량(40mg, 80mg, 120mg)의 경우 말초동맥 순환장애(간헐성 파행증) 치료와 어지러움, 혈관성 및 퇴행성 이명(귀울림), 그리고 두통, 기억력감퇴, 집중력장애, 우울감, 어지러움 등 치매성 증상을 수반하는 기질성 뇌기능장애 치료 등 혈액순환과 연관된 적응증을 보유하고 있습니다.반면 고용량 제제는 집중력 저하, 기억력 감퇴, 현기증(동맥경화 증상)과 같은 증상이 동반되는 정신 기능 저하 등 뇌기능 개선에 초점을 맞추고 있습니다. 케이엠에스제약 '디오프로정600mg' (9월 9일 허가, 제네릭)디오스민 성분이 국내 최대 용량 함유된 치질 치료제가 허가를 받았습니다.케이엠에스제약 '디오프로정600mg'은 치질로 인한 통증 및 가려움증 등의 증상과 다리 중압감, 통증 등 정맥부전과 관련된 증상의 개선에 효능·효과가 있는 디오스민을 주성분으로 한 치질 치료제입니다.디오스민 600mg은 최대 기존 제품의 300mg 보다 2배 가량 함량이 높으며, 정맥부전의 치료를 위해서는 매일 아침 식전 1일 1정 1회 복용하고 치질의 치료를 위해서는 1일 1정 2~3회 복용하면 됩니다.고함량 디오스민 일반약은 지난 2019년 풍림무약이 '디오맥스정600mg'을 허가 받은데 이어, 최근까지 19개 품목이 허가 목록에 이름을 올리고 있습니다.올해는 케이엠에스제약을 비롯해 경동제약의 '치렉스정600mg', 일동제약의 '푸레파센600정' 등 3개 품목의 고함량 디오스민이 허가를 받았습니다. ◆전문의약품=지난 9월 허가 받은 전문의약품은 모두 35개 품목으로 나타났습니다.신약 2개 품목과 희귀의약품 3개 품목의 허가가 있었습니다. 제네릭 등 기타 유형이 23개 품목을 차지했습니다.의약품이나 염기, 제형 따위의 변화로 안전성, 유효성 심사를 받아 기존 약을 다르게 만든 자료제출의약품은 7개 품목으로 나타났습니다.GC녹십자 '리나엠파정'(9월 23일 허가, 제네릭)베링거인겔하임의 '에스글리토정(엠파글리플로진, 리나글립틴)' 두 번째 제네릭 허가가 나왔습니다.GC녹십자는 리나엠파정 10/5mg과 25/5mg 등 2개 용량을 개발해 식약처로부터 허가를 받았습니다.오리지널인 에스글리토는 제2형 당뇨병 환자의 혈당조절을 향상시키기 위한 식사요법 및 운동요법의 보조제로, SGLT-2(나트륨포도당 공동 수송체 2형) 억제제인 '엠파글리플로진'과 DPP-4(인슐린 분비 호르몬 분해효소) 억제제 '리나글립틴'의 복합제입니다.그동안 국내 제약회사들은 에스글리토의 특허를 깨기 위해 소극적 권리범위확인 심판, 무효심판 등을 진행하는 한편 생동성 시험을 이어 왔습니다.에스글리토 제네릭 허가는 지난해 9월 동구바이오제약의 '트라디앙정'에 이어 GC녹십자가 두 번째입니다.GC녹십자는 지난 2022년 에스글리토가 보유한 결정형 특허와 제형 특허 회피를 위한 소송에서 둘다 승소했지만, 엠파글리플로진 단일제인 '자디앙'의 물질특허 만료일이 내년 10월인 만큼 출시는 늦어질 것으로 보입니다.의약품 시장조사기관 유비스트에 따르면 에스글리토의 지난해 처방액은 27억원으로 나타났습니다.SGLT-2 억제제와 DPP-4 억제제 조합인 LG화학 '제미다파(다파글리플로진+제미글립틴)' 22억원, 아스트라제네카 '큐턴(다파글리플로진+삭사글립틴)' 21억원, 종근당 '엑시글루에스(다파글리플로진+시타글립틴)' 6억원, 동아에스티 '슈가다파(다파글리플로진+에보글립틴)' 5억원 등으로 뒤를 잇고 있습니다.한국화이자제약 '리트풀로캡슐50mg'(9월 24일 허가, 신약)한국화이자제약의 경구용 JAK 억제제 리트로풀(리틀레시티닙)이 중증 원형탈모증 환자 치료제로 국내 허가를 받았습니다.리트풀로는 성인 및 12세 이상의 청소년에서 중증 원형탈모증 치료제로 허가된 1일 1회 경구용 JAK 억제제로, 국내 원형탈모증 치료제 중 청소년 환자를 대상으로 승인된 최초이자 유일한 의약품입니다. 미국 허가 과정에서 임상 시험을 진행하며 혁신치료제로 지정되기도 했는데, 미국에 이어 같은 달 일본 후생노동성(MHLW)의 허가를 받은 지 3개월 만에 유럽의약품청(EMA)에서도 줄이어 허가를 받으면서 기대를 모았습니다.리트풀로의 허가는 ALLEGRO 연구 결과를 바탕으로 이뤄졌으며, 연구에 따르면 리트풀로 치료군은 위약군 대비 통계적으로 유의미하게 높은 비율로 80% 이상의 두피가 모발로 덮인 것(SALT 20 이상)을 확인했습니다.리트풀로 투여군의 SALT 20 이상 비율은 23%, 위약군은 1.6%로 나타났으며, 리트풀로군과 위약군 간 이상반응 발생률은 비슷했고, 사망자는 없었습니다.국내에서는 원형탈모증 치료제로 릴리의 경구용 JAK 억제제 '올루미언트(바리시티닙)'가 지난해 허가를 받았으며, 올루미언트는 18세 이상 성인 환자에서 중증 원형 탈모증에 쓰입니다.한국파마 '아라텍트캡슐100/5mg'(9월 27일 허가, 제네릭)저용량 아스피린에 저용량 라베프라졸을 한 캡슐에 담은 복합제 개발이 허가로 이어지고 있습니다.한국파마가 '아라텍트캡슐100/5mg(아스피린, 라베프라졸)'을 9월 27일 허가 받은데 이어, 9월 30일 휴온스와 영진약품이 각각 '아스라베캡슐100/5mg'과 '아스라졸캡슐100/5mg)'을 허가 받았습니다.저용량 라베프라졸 복합제는 궤양 과거력 있는 아스피린 장기 복용 환자 새 치료제로, 지난해 10월 한미약품이 '라스피린캡슐'을 처음 선보였습니다.이어 올해 동광제약, 지엘파마, 휴온스, 한국파마 등이 잇따라 허가를 받고 있습니다.아라텍트캡슐은 위·십이지장 궤양 과거력이 있으면서 심근경색, 뇌경색, 불안정형 협심증, 관상동맥 우회술(CABG) 또는 경피경관 관상동맥 성형술(PTCA), 고위험군 환자(허혈성 심장질환의 가족력, 고혈압, 고콜레스테롤혈증, 비만, 당뇨 등 복합적 위험인자를 가진 환자) 등에서의 혈전 생성 억제가 적응증입니다.아스피린은 혈전 생성을 억제해 심혈관질환의 예방 및 치료에 사용되고 있지만 장기 복용시 위장관 출혈 등의 부작용 우려가 제기되면서 라베프라졸 복합제가 인기를 끄는 것으로 보입니다.2024-10-04 11:55:24이혜경
저용량 아스피린+PPI에 고함량 은행엽·디오스민까지[데일리팜=이혜경 기자] 기존 위산 분비 억제제로 사용되던 양성자 펌프 억제제(PPI)와 저용량 아스피린을 성분으로 하는 복합제 허가가 이어지고 있습니다. 지난해 한미약품이 선보인 '라스피린'에 이어 올해에만 동광제약, 한국파마, 휴온스, 영진약품, 지엘파마 등이 저용량 라베프라졸 복합제 시장에 뛰어들었습니다.지난달에는 국내 원형탈모증 치료제 중 청소년 환자를 대상으로 승인된 최초이자 유일한 의약품인 한국화이자제약의 '리트풀로캡슐50mg' 허가도 눈에 띕니다.일반의약품에서는 고함량 뇌기능개선제 '은행엽건조엑스'제제와 치질 치료제 성분의 '디오스민' 고함량 허가도 진행됐습니다. 식약처의 9월 허가 현황을 보면, 일반의약품 51개 품목, 전문의약품 35개 품목 등 총 86개 품목이 허가를 받았습니다.식약처는 매달 의료제품 허가현황을 공개하고 있는데, 정보공개 대상은 신약, 자료제출의약품, 조건부 허가 의약품 등에 한정하고 있습니다.◆일반의약품=지난 9월 허가(신고)된 일반약은 모두 51개 품목으로 나타났습니다.제조법을 공인한 표준제조기준 품목이 24개 품목, 제네릭 등 기타품목이 27개 품목을 보였습니다. 마더스제약 '깅코라민정240mg' (9월 2일 허가, 제네릭)하루 한 알 복용하는 고함량 은행엽건조엑스 제제가 지난달에만 9개 회사의 9개 품목이 허가를 받았습니다.마더스제약의 '깅코라민정', 제일헬스사이언스의 '제일진코심정', 구주제약의 '바소필정', 한미약품의 '한미징코정', 한국휴텍스제약의 '징코에프정', 아이월드제약의 '징코리프정', 케이에스제약의 '징코에스정', 화이트생명과학의 '징코뉴로정', 한국피엠지제약의 '바넥신정' 등이 주인공입니다.고함량 은행엽건조엑스 제제는 2020년 11월 풍림무약의 '징코필정'이 첫 제품인데, 최근까지 50여개 품목이 허가를 받으면서 인기를 이어가고 있습니다.은행엽건조엑스 제제는 저용량은 40mg부터 80mg, 120mg, 240mg 용량으로 허가를 받은 상태입니다.기존 용량(40mg, 80mg, 120mg)의 경우 말초동맥 순환장애(간헐성 파행증) 치료와 어지러움, 혈관성 및 퇴행성 이명(귀울림), 그리고 두통, 기억력감퇴, 집중력장애, 우울감, 어지러움 등 치매성 증상을 수반하는 기질성 뇌기능장애 치료 등 혈액순환과 연관된 적응증을 보유하고 있습니다.반면 고용량 제제는 집중력 저하, 기억력 감퇴, 현기증(동맥경화 증상)과 같은 증상이 동반되는 정신 기능 저하 등 뇌기능 개선에 초점을 맞추고 있습니다. 케이엠에스제약 '디오프로정600mg' (9월 9일 허가, 제네릭)디오스민 성분이 국내 최대 용량 함유된 치질 치료제가 허가를 받았습니다.케이엠에스제약 '디오프로정600mg'은 치질로 인한 통증 및 가려움증 등의 증상과 다리 중압감, 통증 등 정맥부전과 관련된 증상의 개선에 효능·효과가 있는 디오스민을 주성분으로 한 치질 치료제입니다.디오스민 600mg은 최대 기존 제품의 300mg 보다 2배 가량 함량이 높으며, 정맥부전의 치료를 위해서는 매일 아침 식전 1일 1정 1회 복용하고 치질의 치료를 위해서는 1일 1정 2~3회 복용하면 됩니다.고함량 디오스민 일반약은 지난 2019년 풍림무약이 '디오맥스정600mg'을 허가 받은데 이어, 최근까지 19개 품목이 허가 목록에 이름을 올리고 있습니다.올해는 케이엠에스제약을 비롯해 경동제약의 '치렉스정600mg', 일동제약의 '푸레파센600정' 등 3개 품목의 고함량 디오스민이 허가를 받았습니다. ◆전문의약품=지난 9월 허가 받은 전문의약품은 모두 35개 품목으로 나타났습니다.신약 2개 품목과 희귀의약품 3개 품목의 허가가 있었습니다. 제네릭 등 기타 유형이 23개 품목을 차지했습니다.의약품이나 염기, 제형 따위의 변화로 안전성, 유효성 심사를 받아 기존 약을 다르게 만든 자료제출의약품은 7개 품목으로 나타났습니다.GC녹십자 '리나엠파정'(9월 23일 허가, 제네릭)베링거인겔하임의 '에스글리토정(엠파글리플로진, 리나글립틴)' 두 번째 제네릭 허가가 나왔습니다.GC녹십자는 리나엠파정 10/5mg과 25/5mg 등 2개 용량을 개발해 식약처로부터 허가를 받았습니다.오리지널인 에스글리토는 제2형 당뇨병 환자의 혈당조절을 향상시키기 위한 식사요법 및 운동요법의 보조제로, SGLT-2(나트륨포도당 공동 수송체 2형) 억제제인 '엠파글리플로진'과 DPP-4(인슐린 분비 호르몬 분해효소) 억제제 '리나글립틴'의 복합제입니다.그동안 국내 제약회사들은 에스글리토의 특허를 깨기 위해 소극적 권리범위확인 심판, 무효심판 등을 진행하는 한편 생동성 시험을 이어 왔습니다.에스글리토 제네릭 허가는 지난해 9월 동구바이오제약의 '트라디앙정'에 이어 GC녹십자가 두 번째입니다.GC녹십자는 지난 2022년 에스글리토가 보유한 결정형 특허와 제형 특허 회피를 위한 소송에서 둘다 승소했지만, 엠파글리플로진 단일제인 '자디앙'의 물질특허 만료일이 내년 10월인 만큼 출시는 늦어질 것으로 보입니다.의약품 시장조사기관 유비스트에 따르면 에스글리토의 지난해 처방액은 27억원으로 나타났습니다.SGLT-2 억제제와 DPP-4 억제제 조합인 LG화학 '제미다파(다파글리플로진+제미글립틴)' 22억원, 아스트라제네카 '큐턴(다파글리플로진+삭사글립틴)' 21억원, 종근당 '엑시글루에스(다파글리플로진+시타글립틴)' 6억원, 동아에스티 '슈가다파(다파글리플로진+에보글립틴)' 5억원 등으로 뒤를 잇고 있습니다.한국화이자제약 '리트풀로캡슐50mg'(9월 24일 허가, 신약)한국화이자제약의 경구용 JAK 억제제 리트로풀(리틀레시티닙)이 중증 원형탈모증 환자 치료제로 국내 허가를 받았습니다.리트풀로는 성인 및 12세 이상의 청소년에서 중증 원형탈모증 치료제로 허가된 1일 1회 경구용 JAK 억제제로, 국내 원형탈모증 치료제 중 청소년 환자를 대상으로 승인된 최초이자 유일한 의약품입니다. 미국 허가 과정에서 임상 시험을 진행하며 혁신치료제로 지정되기도 했는데, 미국에 이어 같은 달 일본 후생노동성(MHLW)의 허가를 받은 지 3개월 만에 유럽의약품청(EMA)에서도 줄이어 허가를 받으면서 기대를 모았습니다.리트풀로의 허가는 ALLEGRO 연구 결과를 바탕으로 이뤄졌으며, 연구에 따르면 리트풀로 치료군은 위약군 대비 통계적으로 유의미하게 높은 비율로 80% 이상의 두피가 모발로 덮인 것(SALT 20 이상)을 확인했습니다.리트풀로 투여군의 SALT 20 이상 비율은 23%, 위약군은 1.6%로 나타났으며, 리트풀로군과 위약군 간 이상반응 발생률은 비슷했고, 사망자는 없었습니다.국내에서는 원형탈모증 치료제로 릴리의 경구용 JAK 억제제 '올루미언트(바리시티닙)'가 지난해 허가를 받았으며, 올루미언트는 18세 이상 성인 환자에서 중증 원형 탈모증에 쓰입니다.한국파마 '아라텍트캡슐100/5mg'(9월 27일 허가, 제네릭)저용량 아스피린에 저용량 라베프라졸을 한 캡슐에 담은 복합제 개발이 허가로 이어지고 있습니다.한국파마가 '아라텍트캡슐100/5mg(아스피린, 라베프라졸)'을 9월 27일 허가 받은데 이어, 9월 30일 휴온스와 영진약품이 각각 '아스라베캡슐100/5mg'과 '아스라졸캡슐100/5mg)'을 허가 받았습니다.저용량 라베프라졸 복합제는 궤양 과거력 있는 아스피린 장기 복용 환자 새 치료제로, 지난해 10월 한미약품이 '라스피린캡슐'을 처음 선보였습니다.이어 올해 동광제약, 지엘파마, 휴온스, 한국파마 등이 잇따라 허가를 받고 있습니다.아라텍트캡슐은 위·십이지장 궤양 과거력이 있으면서 심근경색, 뇌경색, 불안정형 협심증, 관상동맥 우회술(CABG) 또는 경피경관 관상동맥 성형술(PTCA), 고위험군 환자(허혈성 심장질환의 가족력, 고혈압, 고콜레스테롤혈증, 비만, 당뇨 등 복합적 위험인자를 가진 환자) 등에서의 혈전 생성 억제가 적응증입니다.아스피린은 혈전 생성을 억제해 심혈관질환의 예방 및 치료에 사용되고 있지만 장기 복용시 위장관 출혈 등의 부작용 우려가 제기되면서 라베프라졸 복합제가 인기를 끄는 것으로 보입니다.2024-10-04 11:55:24이혜경 -
 10월 시행 앞둔 류마티스 JAK억제제 교체투약 보류국내 처방되고 있는 JAK억제제들 [데일리팜=어윤호 기자] 10월로 예상됐던 류마티스관절염에서 JAK억제제 간 교체 투여에 대한 보험급여 인정이 답보 상태로 전환됐다.관련업계에 따르면, 보건당국은 최근 류마티스관절염에서 JAK억제제 간 교차 투약 개정안 고시를 보류했다. 잠정적인 고시 예정 시기는 연말이지만 이 역시 확정은 아닌 상황이다.지연 원인은 예산안에 대한 최종 승인에 문제가 있었던 것으로 알려졌다.현재 국내에는 한국화이자 '젤잔즈(토파시티닙)', 한국릴리 '올루미언트(바리시티닙)', 한국애브비 '린버크(우파다시티닙), 한국에자이 '지셀레카(필고티닙)' 등 4종의 약제가 류마티스관절염에서 처방되고 있다.정부는 그간 JAK억제제 교차 투약과 관련, 임상적인 근거가 부족하다는 이유로 급여 적용이 어렵다는 입장을 보여 왔다.그러나 대한류마티스학회 등의 지속적인 의견서 제출과 교체 투여에 대한 처방 경험을 근거로 제시하면서 정부는 재검토에 들어갔고, 긍정적인 결론을 도출해 10월 적용이 예상됐지만 개정안 고시는 미뤄지게 됐다.이에 따라, 연내 JAK억제제에 대한 자유로운 교체 처방이 시작될 수 있을지 지켜 볼 부분이다.한편 교차 투약에 대한 급여가 인정되면 JAK억제제 시장은 더욱 활기를 띠게 될 것으로 판단된다.의약품 시장조사기관 유비스트에 따르면 지난 상반기 JAK억제제 원외처방 시장 규모는 275억원이다. 작년 상반기 178억원 대비 1년 새 54% 증가했다.JAK억제제 시장은 빠른 속도로 확대되고 있다.2019년 125억원이던 JAK억제제 시장은 2020년 187억원, 2021년 255억원, 2022년 335억원, 지난해 400억원 등으로 커졌다. 올해 상반기에만 275억원을 기록, 연말까지 500억원 돌파가 예상된다.2024-09-27 06:00:45어윤호
10월 시행 앞둔 류마티스 JAK억제제 교체투약 보류국내 처방되고 있는 JAK억제제들 [데일리팜=어윤호 기자] 10월로 예상됐던 류마티스관절염에서 JAK억제제 간 교체 투여에 대한 보험급여 인정이 답보 상태로 전환됐다.관련업계에 따르면, 보건당국은 최근 류마티스관절염에서 JAK억제제 간 교차 투약 개정안 고시를 보류했다. 잠정적인 고시 예정 시기는 연말이지만 이 역시 확정은 아닌 상황이다.지연 원인은 예산안에 대한 최종 승인에 문제가 있었던 것으로 알려졌다.현재 국내에는 한국화이자 '젤잔즈(토파시티닙)', 한국릴리 '올루미언트(바리시티닙)', 한국애브비 '린버크(우파다시티닙), 한국에자이 '지셀레카(필고티닙)' 등 4종의 약제가 류마티스관절염에서 처방되고 있다.정부는 그간 JAK억제제 교차 투약과 관련, 임상적인 근거가 부족하다는 이유로 급여 적용이 어렵다는 입장을 보여 왔다.그러나 대한류마티스학회 등의 지속적인 의견서 제출과 교체 투여에 대한 처방 경험을 근거로 제시하면서 정부는 재검토에 들어갔고, 긍정적인 결론을 도출해 10월 적용이 예상됐지만 개정안 고시는 미뤄지게 됐다.이에 따라, 연내 JAK억제제에 대한 자유로운 교체 처방이 시작될 수 있을지 지켜 볼 부분이다.한편 교차 투약에 대한 급여가 인정되면 JAK억제제 시장은 더욱 활기를 띠게 될 것으로 판단된다.의약품 시장조사기관 유비스트에 따르면 지난 상반기 JAK억제제 원외처방 시장 규모는 275억원이다. 작년 상반기 178억원 대비 1년 새 54% 증가했다.JAK억제제 시장은 빠른 속도로 확대되고 있다.2019년 125억원이던 JAK억제제 시장은 2020년 187억원, 2021년 255억원, 2022년 335억원, 지난해 400억원 등으로 커졌다. 올해 상반기에만 275억원을 기록, 연말까지 500억원 돌파가 예상된다.2024-09-27 06:00:45어윤호 -
 화이자 '리트풀로' 허가...원형탈모 치료제 경쟁 예고[데일리팜=이혜경 기자] 한국화이자제약의 중증 원형탈모 치료 신약인 '리트풀로50mg(리틀레시티닙토실산염)'가 국내 품목허가를 받았다.식품의약품안전처는 24일 성인 및 12세 이상의 청소년에서 중증 원형탈모증 치료제로 리트풀로의 허가를 승인했다.리트풀로는 12세 이상 중증 원형탈모증 환자를 대상으로 개발한 전신 치료제로, 지난해 6월 미국 FDA로부터 청소년용으로 허가받은 원형탈모증 최초의 치료제다.미국 허가 과정에서 임상 시험을 진행하며 혁신치료제로 지정되기도 했는데, 미국에 이어 같은 달 일본 후생노동성(MHLW)의 허가를 받은 지 3개월 만에 유럽의약품청(EMA)에서도 줄이어 허가를 받으면서 기대를 모았다.원형 탈모증은 두피, 얼굴 또는 신체에 반점형 또는 완전 탈모가 나타나는 자가면역질환으로 면역 염증 병인이 있으면서 면역 체계가 신체의 모낭을 공격해 모발이 빠지게 될 때 발생한다.리틀레시티닙은 새로운 종류의 경구용 고선택적 키나아제 중 최초의 경구 1일 1회 치료제로, JAK3 및 TEC 계열 키나아제 억제제로 원형 탈모증의 발병에 관여하는 사이토카인의 신호 전달과 T세포의 세포 용해 활동을 차단하는 기전을 가진다.화이자는 전 세계적으로 약 1억4700만명의 원형탈모 환자가 있다고 보고 있으며, 유럽과 아시아 지역에서도 원형탈모 시장 진출을 서두르고 있다.성인 및 청소년 원형탈모 환자, 백반증에 이어 크론병, 궤양성 대장염을 대상으로 추가 적응증 확대를 위한 임상시험도 전 세계적으로 진행 중이다.한편 국내에서는 원형탈모증 치료제로 릴리의 경구용 JAK 억제제 '올루미언트(바리시티닙)'가 지난해 허가를 받았다. 올루미언트는 18세 이상 성인 환자에서 중증 원형 탈모증에 쓰인다.2024-09-24 17:23:56이혜경
화이자 '리트풀로' 허가...원형탈모 치료제 경쟁 예고[데일리팜=이혜경 기자] 한국화이자제약의 중증 원형탈모 치료 신약인 '리트풀로50mg(리틀레시티닙토실산염)'가 국내 품목허가를 받았다.식품의약품안전처는 24일 성인 및 12세 이상의 청소년에서 중증 원형탈모증 치료제로 리트풀로의 허가를 승인했다.리트풀로는 12세 이상 중증 원형탈모증 환자를 대상으로 개발한 전신 치료제로, 지난해 6월 미국 FDA로부터 청소년용으로 허가받은 원형탈모증 최초의 치료제다.미국 허가 과정에서 임상 시험을 진행하며 혁신치료제로 지정되기도 했는데, 미국에 이어 같은 달 일본 후생노동성(MHLW)의 허가를 받은 지 3개월 만에 유럽의약품청(EMA)에서도 줄이어 허가를 받으면서 기대를 모았다.원형 탈모증은 두피, 얼굴 또는 신체에 반점형 또는 완전 탈모가 나타나는 자가면역질환으로 면역 염증 병인이 있으면서 면역 체계가 신체의 모낭을 공격해 모발이 빠지게 될 때 발생한다.리틀레시티닙은 새로운 종류의 경구용 고선택적 키나아제 중 최초의 경구 1일 1회 치료제로, JAK3 및 TEC 계열 키나아제 억제제로 원형 탈모증의 발병에 관여하는 사이토카인의 신호 전달과 T세포의 세포 용해 활동을 차단하는 기전을 가진다.화이자는 전 세계적으로 약 1억4700만명의 원형탈모 환자가 있다고 보고 있으며, 유럽과 아시아 지역에서도 원형탈모 시장 진출을 서두르고 있다.성인 및 청소년 원형탈모 환자, 백반증에 이어 크론병, 궤양성 대장염을 대상으로 추가 적응증 확대를 위한 임상시험도 전 세계적으로 진행 중이다.한편 국내에서는 원형탈모증 치료제로 릴리의 경구용 JAK 억제제 '올루미언트(바리시티닙)'가 지난해 허가를 받았다. 올루미언트는 18세 이상 성인 환자에서 중증 원형 탈모증에 쓰인다.2024-09-24 17:23:56이혜경 -
 JAK억제제 후발주자 '지셀레카', 빅5 병원 성공 안착[데일리팜=어윤호 기자] 후발 JAK억제제 '지셀레카'가 안정적으로 종합병원을 공략한 모습이다.관련 업계에 따르면 국내 다섯번째 JAK억제제인 지셀레카는 현재 삼성서울병원, 서울대병원, 서울성모병원, 서울아산병원, 신촌세브란스병원 등 빅5 상급종합병원을 비롯해 강북삼성병원, 고대안암병원, 분당차병원, 세종충남대병원, 울산대병원, 충주건국대병원, 한양대병원 등 의료기관과 주요 거점 국립대병원 약사위원회(DC, Drug committee)를 통과했다.국내에서 다섯번째로 승인된 JAK억제제임을 감안하면 지난해 11월 보험급여 등재 후 빠르게 처방 환경을 조성하고 있다.지셀레카의 최초 급여 적용 적응증은 류마티스관절염 및 증등도-중증 활동성 궤양염이다.급여 기준은 각각의 질환에 대한 보편적인 약제에 적절하게 반응하지 않거나 내약성이 없는 경우로, 65세 이상에서는 TNF-α억제제에도 적절히 반응하지 않거나 내약성이 없는 경우다.국내에는 현재 '젤잔즈(토파시티닙)', '올루미언트(바리시티닙)', '린버크(유파다시티닙)' 등 JAK억제제가 처방되고 있다. 향후 지셀레카가 이들 약제 사이에서 얼마나 존재감을 발휘할 수 있을지 지켜 볼 부분이다.이들 약제는 출시 후 꾸준히 적응증 및 급여 기준을 확대하고 있다. 최초로 개발된 젤잔즈가 지난해 궤양성대장염과 건선성관절염 등 적응증을 추가 확보했고 린버크를 포함한 후발 약물들 역시 아토피피부염, 크론병, 강직성척추염 등 자가면역질환에서 처방 영역을 넓혀가고 있다.여기에 최근 희소식이 생겼다. 보건당국이 내달(10월)부터 류마티스관절염에서 JAK억제제 간 교차 투약에 대한 보험급여를 인정키로 한 것.이에 따라, 류마티스관절염 치료 환경이 적잖게 개선될 것으로 예상된다. 당연히 지셀레카를 비롯, JAK억제제들의 처방 활용도 역시 크게 상승할 전망이다.의약품 시장조사기관 유비스트에 따르면 지난 상반기 JAK억제제 원외처방 시장 규모는 275억원이다. 작년 상반기 178억원 대비 1년 새 54% 증가했다.한편 지셀레카는 아데노신삼인산(ATP)-경쟁적이고 가역적인 억제제로서, JAK1을 선택적으로 억제한다. JAK1은 염증성 사이토카인의 신호를 전달하는 물질로, 류마티스관절염의 주요 치료 표적으로 꼽힌다.최근 출시된 치료제들이 기전에 따라 JAK2나 JAK3를 억제하기도 하는데, 두 기전 모두 면역세포 증식 및 항상성 조절에 관여해 이상반응이 발생할 수 있다는 의견도 존재한다.이 약은 FINCH1, FINCH2, FINCH3 등 3상 연구를 통해 유효성을 입증했다. FINCH1 연구에서 메토트렉세이트(MTX) 치료를 지속했음에도 중등도-중증인 활동성 RA 환자에게 지셀레카를 투여했을 때 200mg 용량이 12주에서 ACR20을 더 빨리 달성하는 모습을 보였다.2024-09-13 06:00:01어윤호
JAK억제제 후발주자 '지셀레카', 빅5 병원 성공 안착[데일리팜=어윤호 기자] 후발 JAK억제제 '지셀레카'가 안정적으로 종합병원을 공략한 모습이다.관련 업계에 따르면 국내 다섯번째 JAK억제제인 지셀레카는 현재 삼성서울병원, 서울대병원, 서울성모병원, 서울아산병원, 신촌세브란스병원 등 빅5 상급종합병원을 비롯해 강북삼성병원, 고대안암병원, 분당차병원, 세종충남대병원, 울산대병원, 충주건국대병원, 한양대병원 등 의료기관과 주요 거점 국립대병원 약사위원회(DC, Drug committee)를 통과했다.국내에서 다섯번째로 승인된 JAK억제제임을 감안하면 지난해 11월 보험급여 등재 후 빠르게 처방 환경을 조성하고 있다.지셀레카의 최초 급여 적용 적응증은 류마티스관절염 및 증등도-중증 활동성 궤양염이다.급여 기준은 각각의 질환에 대한 보편적인 약제에 적절하게 반응하지 않거나 내약성이 없는 경우로, 65세 이상에서는 TNF-α억제제에도 적절히 반응하지 않거나 내약성이 없는 경우다.국내에는 현재 '젤잔즈(토파시티닙)', '올루미언트(바리시티닙)', '린버크(유파다시티닙)' 등 JAK억제제가 처방되고 있다. 향후 지셀레카가 이들 약제 사이에서 얼마나 존재감을 발휘할 수 있을지 지켜 볼 부분이다.이들 약제는 출시 후 꾸준히 적응증 및 급여 기준을 확대하고 있다. 최초로 개발된 젤잔즈가 지난해 궤양성대장염과 건선성관절염 등 적응증을 추가 확보했고 린버크를 포함한 후발 약물들 역시 아토피피부염, 크론병, 강직성척추염 등 자가면역질환에서 처방 영역을 넓혀가고 있다.여기에 최근 희소식이 생겼다. 보건당국이 내달(10월)부터 류마티스관절염에서 JAK억제제 간 교차 투약에 대한 보험급여를 인정키로 한 것.이에 따라, 류마티스관절염 치료 환경이 적잖게 개선될 것으로 예상된다. 당연히 지셀레카를 비롯, JAK억제제들의 처방 활용도 역시 크게 상승할 전망이다.의약품 시장조사기관 유비스트에 따르면 지난 상반기 JAK억제제 원외처방 시장 규모는 275억원이다. 작년 상반기 178억원 대비 1년 새 54% 증가했다.한편 지셀레카는 아데노신삼인산(ATP)-경쟁적이고 가역적인 억제제로서, JAK1을 선택적으로 억제한다. JAK1은 염증성 사이토카인의 신호를 전달하는 물질로, 류마티스관절염의 주요 치료 표적으로 꼽힌다.최근 출시된 치료제들이 기전에 따라 JAK2나 JAK3를 억제하기도 하는데, 두 기전 모두 면역세포 증식 및 항상성 조절에 관여해 이상반응이 발생할 수 있다는 의견도 존재한다.이 약은 FINCH1, FINCH2, FINCH3 등 3상 연구를 통해 유효성을 입증했다. FINCH1 연구에서 메토트렉세이트(MTX) 치료를 지속했음에도 중등도-중증인 활동성 RA 환자에게 지셀레카를 투여했을 때 200mg 용량이 12주에서 ACR20을 더 빨리 달성하는 모습을 보였다.2024-09-13 06:00:01어윤호
오늘의 TOP 10
- 1복지부, 1월 약가인하 4천품목 리스트 곧 사전 공개
- 2오름, 1450억 CPS 투자 유치…"TPD 임상 가속"
- 3임무 종료 위임형 제네릭 한국 철수…올메액트 허가 취하
- 4생존의 문제 '탈모'...급여 시급한 중증 원형탈모치료제
- 5위더스제약, 차세대 다중표적 알츠하이머 치료제 개발 속도
- 6의협, 건보공단 특사경 반대 국회앞 1인 시위
- 7'2천억 조달·해외 진출 고삐'...카티스템, 얼마나 팔렸나
- 8모더나 RSV 예방백신, 식약처 신속심사 통해 허가
- 9이연제약, 130억 투자 뉴라클 신약 북미 1/2a상 완료
- 10"신약 파이프라인 10배로"...정부, AI바이오 전략 발표
-
상품명최고최저평균
-
케토톱플라스타(34매)13,00013,00013,000
-
게보린(10정)4,0003,0003,620
-
노스카나겔(20g)22,00018,00020,703
-
베나치오에프액(75ml)1,0008001,000
-
비코그린에스(20정)5,0004,0004,417













![[리쥬올]리쥬올 PDRN 약국 1위 PDRN](https://cdn.platpharm.co.kr/2025/09/2509260220180000170.webp)
![[리쥬올]레티노 멜라세럼 저자극 레티놀](https://cdn.platpharm.co.kr/2025/09/2509260219360000145.webp)
![[SK케미칼] 트라스트패취 피록시캄 성분](https://cdn.platpharm.co.kr/2025/10/2510020656150002375.webp)
![[유한양행] 콘택콜드 걸렸구나 생각되면](https://cdn.platpharm.co.kr/2025/10/2510282252420008436.webp)
![[유한양행] 미녹펜겔 탈모스팟 집중케어](https://cdn.platpharm.co.kr/2025/09/2509220824180004563.webp)
![[종근당] 벤포벨에스 어른들의 피로회복제](https://cdn.platpharm.co.kr/2025/07/2507290841210004645.webp)
